
- •Самостоятельная работа № 6 Тема: «окислительно-восстановительные и электрохимические процессы»
- •Раздел 1. Методические указания к изучению темы
- •Раздел 2. Обучающие задания с алгоритмами решения для закрепления темы «Окислительно-восстановительные и электрохимические процессы» а. Окислительно-восстановительные процессы
- •Б. Электрохимические процессы в гальваническом элементе
- •В. Электрохимические процессы при электролизе
- •Раздел 3. Приобретение компетенций и закрепление навыков
- •А. Домашнее задание №6 для закрепления навыков решения задач
- •Б. Домашнее задание № 6 для закрепления знаний теоретического материала
Б. Электрохимические процессы в гальваническом элементе
Пример 5. Вычисление равновесных электродных потенциалов металлов и
газовых электродов
1. Вычислите потенциал цинкового электрода при 298К в 150 мл раствора, содержащего 1,2 г цинка сульфата ZnSO4. Кажущаяся степень диссоциации соли в растворе равна 60%.
Решение. Вначале рассчитываем молярную концентрацию раствора цинка сульфата:
Сμ(ZnSO4) =
![]() =
=
![]() =
=
![]() 0,0496
моль/л.
0,0496
моль/л.
В данном примере молярная концентрация раствора цинка сульфата не совпадает с молярной концентрацией ионов Zn2+, т.к. кажущаяся степень диссоциации соли равна 0,6. Молярная концентрация ионов цинка в растворе составит:
Сμ(Zn2+) = a×Cμ(ZnSO4) = 0,6∙0,0496=0,0298 (моль/л).
Потенциал цинкового электрода определяется уравнением Нернста (уравнение 9 теоретической части раздела):
j Zn2+/
Zn = j0
Zn2+/ Zn
+
![]() ℓna(Zn2+).
ℓna(Zn2+).
В случае разбавленных растворов при вычислении электродного потенциала в уравнении Нернста вместо активности потенциалопределяющего иона можно использовать его молярную концентрацию. Учтем также и стандартные условия измерения электродного потенциала, тогда:
j Zn2+/ Zn = j0 Zn2+/ Zn + ℓgСμ(Zn2+);
j Zn2+/ Zn = –0,763 + 0,0296∙ℓg0,0298 = –0,763 – (0,0296∙1,526) = 0,808 (В).
Значение стандартного электродного потенциала цинка j0 Zn2+/Zn взято из таблицы № 1 Приложения.
Ответ: j Zn2+/ Zn = 0,808 В.
2. Потенциал серебряного электрода, погруженного в насыщенный раствор соли серебра бромида при 298К, равен 0,435 В (относительно стандартного водородного электрода). Вычислите активность ионов серебра в растворе, если j0 Аg+/ Ag = 0,799 В.
Решение. Потенциал серебряного электрода определяется уравнением Нернста:
jAg+/ Ag = j0 Ag+/ Ag + ℓna(Ag+) = 0,799 + 0,0591∙ℓga(Ag+),
откуда находим
ℓga(Ag+)
=
![]() = -6,159 = -7+0,841;
= -6,159 = -7+0,841;
a(Ag+) = 10-7∙6,934 = 6,934∙10-7.
Ответ: a(Ag+) = 6,934∙10-7 моль/кг.
3. Рассчитайте равновесный потенциал хлорного газового электрода, на котором при температуре 298 К установилось равновесие:
Cl2 + 2ē <=> 2Cl–
при парциальном давлении газообразного хлора P̃(Cl2) = 10 кПа и активности хлорид-ионов а(Cl–) = 1∙10-2 моль/кг.
Решение. Величина равновесного
электродного потенциала электрохимической
системы рассчитывается по уравнению
Нернста, причем, для газообразного
электрода оно имеет вид: φCl2/2Cl-
= φ0Cl2/2Cl-
+
ℓn![]() .
.
Решим это уравнение, предварительно найдя в Таблице № 1 Приложения значение стандартного электродного потенциала хлора φ0Cl2/2Cl- = 1,39 В:
φCl2/2Cl-
= 1,39 +
ℓg![]() = 1,39 +
= 1,39 +
![]() = 1,39 + 0,177 = 1,567 В.
= 1,39 + 0,177 = 1,567 В.
Ответ: φCl2/2Cl- = 1,567 В.
4. Рассчитайте равновесный потенциал стандартного водородного электрода, погруженного при температуре 298 К в кислотный раствор с рН, равным 3,5.
Решение. Для измерения рН водных растворов используют в качестве электрода сравнения стандартный водородный электрод Н2|2Н+, потенциал которого при стандартных условиях φ0Н2|2Н+ (Т = 298 К, Р = 101 кПа) принят равным нулю. Если активность ионов водорода в исследуемом растворе отлична от 1 моль/кг, то значение равновесного электродного потенциала водородного электрода можно определить по уравнению Нернста:
φН2|2Н+ =
φ0Н2|2Н+
+
ℓn![]() .
.
В этом уравнении:
φ0Н2|2Н+ = 0, сомножитель RT∙2,303/F = 0,0591, Nē = 2 (2H+ + 2ē = H2) и тогда
φН2|2Н+ = ℓga2(Н+).
Из уравнения рН = - ℓga(Н+) найдем ℓga(Н+) = - рН = -3,5 = -4 + 0,5, следовательно, а(Н+) = 10-4∙3,16 = 0,3∙10-3 (моль/кг).
Теперь решим уравнение Нернста: φН2|2Н+ = 0,0295∙ℓg(0,3∙10-3)2 = -0,208 (В).
Ответ: φН2|2Н+ = -0,208 В.
5. Определите, при какой концентрации (моль/кг) ионов Fe2+ потенциал железного электрода φFe|Fe2+ при стандартных условиях станет на 0,015 В меньше его стандартного электродного потенциала. Коэффициент активности ионов железа Fe2+ равен 0,752.
Решение. Потенциал железного электрода для равновесного процесса Fe - 2ē <=> Fe2+ определяется по уравнению Нернста
φFe|Fe2+
= φ0Fe|Fe2+
+
ℓn![]() .
.
Поскольку величина стандартного железного электрода, согласно Таблице № 1 Приложения, равна 0,44 В, то уменьшение величины потенциала на 0,015 В приходится на второе слагаемое в указанной формуле, следовательно,
ℓn = -0,015.
Решим это уравнение, имея в виду, что при стандартных условиях сомножитель RT∙2,303/F = 0,0591, Ne = 2, и тогда
ℓg a(Fe2+)
=-![]() =
-0,508 = -1 + 0,492; a(Fe2+)
= 10-1∙3,1
= 0,31 (моль/кг).
=
-0,508 = -1 + 0,492; a(Fe2+)
= 10-1∙3,1
= 0,31 (моль/кг).
Зная, что активность ионов в растворе равна произведению коэффициента активности на моляльную концентрацию, несложно рассчитать теперь искомую концентрацию ионов железа в растворе:
a(Fe2+) = f(Fe2+)∙Cm(Fe2+), следовательно, Cm(Fe2+) = a(Fe2+)/f(Fe2+) и тогда Cm(Fe2+) = 0,31/0,752 = 0,41 (моль/кг).
Ответ: При уменьшении концентрации ионов Fe2+ в растворе до 0,41 моль/кг потенциал электрода уменьшится на 0,015 В.
Пример 6. Расчеты ЭДС гальванического элемента, составление схем
гальванических элементов
1. Вычислите при 45оС электродвижущую силу гальванического элемента
Cu | (0,1 М) CuSO4 || (0,02 М)Tl2SO4 | Tl.
Кажущаяся степень диссоциации CuSO4 равна 40%, а Tl2SO4 – 87%.
Решение. В представленном гальваническом элементе протекают следующие электродные процессы:
на аноде Cu0 – 2ē = Cu2+, окисление;
на катоде 2Tl+ + 2ē = 2Tl, восстановление.
Согласно уравнению Нернста для ЭДС такого гальванического элемента (уравнение 14)
Е = Е0 +
ℓn ,
где Е0 = φ0Tl+/Tl
– φ0Cu/Cu2+.
,
где Е0 = φ0Tl+/Tl
– φ0Cu/Cu2+.
Значения стандартных электродных потенциалов медного и таллиевого электродов найдем по Таблице № 1 Приложения: φ0Tl+/Tl = - 0,34 В; φ0Cu/Cu2+ = - 0,34 В. Отсюда следует, что Е0 = 0.
Для расчета второго слагаемого в уравнении Нернста вводим допущение, что при низких концентрациях молярная и моляльная концентрации ионов в растворе практически равны между собой, т.е. Cμ ≈ Cm, и тогда, с учетом значений степени диссоциации солей меди сульфата и таллия сульфата, находим:
Cm(Cu2+) = α∙Cμ(CuSO4) = 0,4∙0,1 = 0,04 (моль/кг);
Cm(Tl+) = 2∙α∙Cμ(Tl2SO4) = 2∙0,87∙0,02 = 0,035 (моль/кг).
Теперь рассчитаем ЭДС, используя упрощенную формулу:
Е =
![]() ℓg
,
где Ne
= 2, Т = 273 + 45 = 318 К, и тогда
ℓg
,
где Ne
= 2, Т = 273 + 45 = 318 К, и тогда
Е =
![]() ℓg
ℓg![]() = 0,0318∙ℓg(0,031)= 0,0318∙(-1,514)
= - 0,048 (В).
= 0,0318∙ℓg(0,031)= 0,0318∙(-1,514)
= - 0,048 (В).
Ответ: Е = - 0,048 В.
2. Определите, какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов а(Cu2+) = 1 моль/кг, а у другого – 1,0∙10-3 моль/кг. Составьте схему работы этого гальванического элемента и определите его ЭДС.
Решение. В концентрационном гальваническом элементе у электрода с большей активностью действующих ионов протекает процесс восстановления ионов (этот электрод – катод), противоположный электрод с меньшей aктивностью ионов играет роль анода, на нем протекает процесс окисления (как правило, окисляется сам электрод, если он изготовлен из того же металла).
Таким образом, на катоде протекает реакция: Cu2+ + 2ē = Cu0;
на аноде Cu0 - 2ē = Cu2+.
В результате этих процессов у катода активность ионов меди уменьшается, а у анода – увеличивается, процесс будет продолжаться до тех пор, пока активности ионов у электродов не сравняются, т.е. а(Cu2+)K = a(Cu2+)A.
Схема гальванического элемента:
(A, –) Сu | Cu2+(a = 1,0∙10-3) || Cu2+(a = 1,0) | Cu (K, +).
ЭДС такого гальванического элемента в начальный момент времени будет равна
Е =
ℓn =
ℓg
=
ℓg![]() =
=
![]() = 0,089 B.
= 0,089 B.
Ответ: Е = 0,089 В.
3. Установите, как должен быть составлен гальванический элемент, чтобы в нем протекала реакция
2Au3+ + 3H2 = 2Au + 6H+.
Составьте схему работы такого гальванического элемента и рассчитайте его стандартную ЭДС.
Решение. Уравнение окислительно-восстановительного процесса указывает на то, что окислителем в нем выступает катион золота Au3+, а восстановителем – газообразный водород Н2. Следовательно, в гальваническом элементе водородный электрод служит анодом φ(Н2|2Н+)А, а золотой электрод – катодом φ(Au3+/Au)K, электрический ток перемещается от водородного электрода к золотому, и тогда схема гальванического элемента будет следующей:
(A, –) H2(Pt) | 2H+ || Au3+ | Au (K, +).
Стандартная ЭДС такого гальванического элемента определяется по уравнению Нернста как разность стандартных электродных потенциалов катода (золотого электрода) и анода (водородного электрода), т.е.
Е0 = φ0(Au3+/Au) – φ0(2Н+/Н2),
и поскольку стандартный электродный потенциал водородного электрода принят равным нулю, то Е0 = φ0(Au3+/Au).
Найдем значение этого потенциала в Таблице № 1 Приложения:
φ0(Au3+/Au) = 1,50 В и тогда Е0 = 1,50 В.
Ответ: Е0 = 1,50 В.
4. В гальваническом элементе
(-) Zn |Zn2+ || HCl (0,001 M, α = 100%) | H2(Cu) (+)
концентрация ионов Zn2+ в растворе Сμ(Zn2+) = 2,1∙10-3 моль/л. Рассчитайте ЭДС этого элемента при температуре 600С и напишите уравнения его электродных процессов.
Решение. Поскольку в данном гальваническом элементе цинковый электрод является анодом, а водородный – катодом, то в нем идут следующие электродные процессы: а) на аноде - процесс окисления Zn - 2ē = Zn2+;
б) на катоде – процесс восстановления 2H+ + 2ē = H2.
Согласно уравнению (14) ЭДС гальванического элемента определяется по формуле
Е = Е0 +
ℓn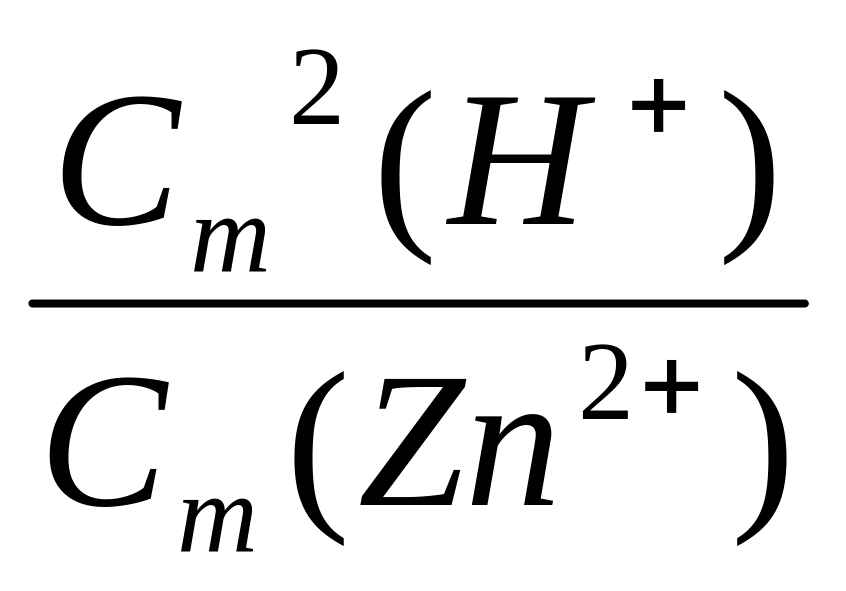 .
.
По таблице № 1 Приложения найдем значение стандартного электродного потенциала цинка φ0(Zn2+/Zn) и рассчитаем стандартную ЭДС, зная что φ0(2Н+/Н2) = 0:
Е0 = φ0(2Н+/Н2) - φ0(Zn2+/Zn) = 0 – (-0,736) = 0,763 B.
Подставим полученное значение в уравнение Нернста и упростим его с учетом условий задачи, имея в виду, что Т = 273 + 60 = 333 К и Ne = 2:
Е = Е0 + ℓg ,
Е = 0,763 +
![]() ℓg
ℓg![]() =
0,763 + 0,033 ℓg(0,48∙10-3)
= 0,653 (В).
=
0,763 + 0,033 ℓg(0,48∙10-3)
= 0,653 (В).
Ответ: Е = 0,653 В; на катоде 2H+ + 2ē = H2; на аноде Zn - 2ē = Zn2+.
