
- •Хрестоматия
- •По анатомии
- •Центральной нервной
- •Системы
- •Предисловие
- •Б. Албертс, д. Брей, Дж. Льюис и др. Введение*
- •1. Общий обзор строения центральной нервной системы э.Д. Моренков Общий обзор строения центральной нервной системы*
- •2. Гистология и ультраструктура нервной ткани Дж. Шаде, д. Форд Нервная клетка*
- •Э.Д. Моренков Гистология и ультраструктура нервной ткани*
- •Дж. Шаде, д. Форд Типы нейронов*
- •Б. Албертс, д. Брей, Дж. Льюис и др. Клетки нервной системы: строение и функция*
- •Стрелками указано направление передачи сигналов. Самые крупные нейроны достигают у человека длины около метра и имеют аксоны диаметром до 15 мкм
- •3. Развитие и созревание мозга Дж. Шаде, д. Форд [Морфогенез и гистогенез]*
- •Перечень изменений полушарий мозга
- •Б. Албертс, д. Брей, Дж. Льюис и др. Рождение, рост и гибель нейронов*
- •4. Кровеносная система мозга э.Д. Моренков Кровеносная система мозга*
- •Дж. Шаде, д. Форд Кровеносные сосуды*
- •5. Оболочки мозга Дж. Шаде, д. Форд [Система циркуляции спинномозговой жидкости]*
- •М.Р. Сапин, ю.М. Селин Оболочки спинного мозга*
- •Э.Д. Моренков Оболочки мозга*
- •М.Р. Сапин, ю.М. Селин Оболочки головного мозга*
- •6. Спинной мозг м.Р. Сапин. Ю.М. Селин Спинной мозг*
- •Дж. Шаде, д. Форд Спинной мозг*
- •Э.Д. Моренков Спинной мозг*
- •Э.Д. Моренков [Полушария головного мозга]*
- •Проекционные волокна
- •Борозды и извилины медиальной поверхности
- •М.Р. Сапин, ю.М. Селин Локализация функций в коре полушарий большого мозга*
- •Промежуточный мозг м.Р. Сапин, ю.М. Селин Промежуточный мозг*
- •Э.Д. Моренков Промежуточный мозг*
- •Средний мозг м.Р. Сапин, ю.М. Селин Средний мозг*
- •Э.Д. Моренков Средний мозг*
- •Задний мозг м.Р. Сапин, ю.М. Селин
- •М.Р. Сапин, ю.М. Селин Мозжечок*
- •Э.Д. Моренков Мозжечок*
- •Продолговатый мозг м.Р. Сапин, ю.М. Селин Продолговатый мозг*
- •8. Проводящие пути мозга м.Р. Сапин Проводящие пути головного и спинного мозга*
- •9. Возрастные особенности мозга м.Р. Сапин, ю.М. Селин [Возрастные особенности головного и спинного мозга]*
- •10. Периферическая нервная система и автономная (вегетативная) нервная система э.И. Борзяк, м.Р. Сапин, б.А. Спирин [Периферическая нервная система и автономная (вегетативная) нервная система]*
- •Автономная (вегетативная) нервная система
- •11. Органы чувств р.Д. Синельников, я.Р. Синельников [Органы чувств]*
- •Собственно сосудистая оболочка глазного яблока
- •12. Изменчивость мозга человека с.В. Савельев Изменчивость мозга*
- •13. Указатели анатомических терминов с.В. Савельев Указатели*
- •Русско-латинский указатель
- •Латинско-русский указатель
- •Cодержание
2. Гистология и ультраструктура нервной ткани Дж. Шаде, д. Форд Нервная клетка*
* Шаде Дж., Форд Д. Основы неврологии. М.:Мир, 1976.С.136-182.
Рис 2.1. Нейрон, или нервная клетка, состоит из тела, от которого отходит один отросток (псевдоуниполярный нейрон) или несколько отростков (мультиполярный нейрон).

Рис. 2.1. Основные компоненты нейрона: 1 – ядро; 2 – ядрышко; 3 – сателлит ядрышка; 4 – дендрит; 5 – эндоплазматическая сеть с гранулами РНК (вещество Ниссля); 6 – синоптическое окончание; 7 – ножка астроцита; 8 – гранулы ДНК; 9 – липофусцин; 10 – аппарат Гольджи; 11 –митохондрия; 12 – аксонный холмик; 13 – нейрофибриллы; 14 – аксон; 15 – миелиновая оболочка; 16 – перехват Ранвье; 17–ядро шванновской клетки; 18 – шванповская клетка в области нервно-мышечного синапса; 19 – ядро мышечной клетки; 20 – нервно-мышечное соединение; 21 – мышца
Нервные клетки обладают особым свойством – способностью проводить и передавать импульсы. Они синтезируют вещества-передатчики (нейротрансмиттеры, или медиаторы), такие, как ацетилхолин, катехоламины и индоламины, а также обеспечивают себя (при участии клеток глии) всем "необходимым для существования". Следовательно, нервные клетки синтезируют также липиды, углеводы и белки. Известно, что обмен ДНК и РНК протекает в этих клетках как обычно <...>. Некоторые специализированные нервные клетки способны синтезировать белковые продукты (октапептиды), которые накапливаются в клетке и секретируются как гормоны (антидиуретический гормон, вазопрессин и окситоцин) <...>. Другие нейроны, входящие в состав базальных отделов гипоталамуса, вырабатывают так называемые релизинг-факторы (rеlеаsing factors), которые влияют на функцию аденогипофиза. Было показано, что релизинг-фактортиреотропного гормона представляет собой трипептид. Для всех нейронов характерна высокая интенсивность обмена, и поэтому они нуждаются в постоянном поступлении кислорода и глюкозы, а также других питательных веществ.
Отростки нейрона делятся на два типа. Одни отростки, дендриты (афферентные), проводят импульс, как правило, к телу клетки, а другие – аксоны (эфферентные) в обычных условиях проводят импульс от тела клетки. Поверхность дендритов, которые получают "информацию, передаваемую по аксонам” от других нервных клеток, значительно увеличивается за счет небольших выростов (шипиков). Так, у клеток Пуркинье площадь дендритов достигает почти 250 000 мкм2.
Бодиан, исходя из того, что существующие обозначения структур нервной клетки не соответствуют современным представлениям об их функции, пересмотрел терминологию обобщенного типа нейрона позвоночных. Он дал следующие определения основным частям нейрона, подчеркивая их участие в проведении импульса, а не отношение к телу клетки как к центральному образованию.

Рис. 2.2. Обобщенная схема нейронов позвоночных (но Бодиану, изменено):
А – слуховой рецепторный нейрон; Б – кожный реценторный нейрон; В – двигательный нейрон; Г – вставочный нейрон; а – дендритная зона; б – аксон; а – перикарион (тело нейрона); г – телодендрии (концевые разветвления аксона)
Рис 2.2. Дендритная зона (а), рецепторная мембрана нервной клетки, которая либо состоит из комплекса сужающихся к концу цитоплазматических выростов (дендритов), на которых находятся синаптические окончания других нейронов (В, Г), либо дифференцируется в структуру, трансформирующую воздействия внешней среды в локальную импульсную активность (А, Б). В этих образованиях могут находиться скопления митохондрий.
Аксон (б), одиночный, нередко ветвящийся и удлиненный вырост цитоплазмы, структурно и функционально особым образом приспособленный для проведения нервных импульсов от дендритной зоны. Для аксона характерны постоянный диаметр и наличие оболочки, образованной клетками глии. Дифференцировка оболочек аксона и его диаметр имеют определенное отношение к скорости проведения нервного импульса.
Перикарион (в), тело клетки, или скопление цитоплазмы вокруг ядра, характеризуется обычно наличием окрашивающихся веществ. Эта часть нервной клетки является центральным образованием, обеспечивающим рост дендритов и аксонов в эмбриогенезе, а также регенерацию аксона.
Телодендрии аксона (г) – это обычно разветвленные и различно дифференцированные окончания аксонов, которым присуща мембранная и цитоплазматическая специализация, связанная с синаптической передачей или нейросекреторной активностью. В концевых расширениях аксонов обычно находятся скопления митохондрий, "синаптические пузырьки" или секреторные гранулы.
Цитоплазматическое содержимое тела клетки и дендритов, в состав которого входит эндоплазматическая сеть и связанная с нею РНК, следует рассматривать как основу механизмов синтеза, поддерживающих целостность мембран тела клетки и ее отростков и обеспечивающих проведение ими электрических импульсов.
Тело нервной клетки в основном сходно с телами других клеток. Оно заключено в клеточную оболочку и содержит ядро с ядрышком, митохондрии, сетчатый аппарат Гольджи, эндоплазматическую сеть и рибосомы, фибриллы (нейрофибриллы) (рис. 2.1), а также нейротрубочки, плотные тельца и микропузырьки. Необходимо отметить, что в нервной клетке эндоплазматическая сеть и связанные с ней рибосомы образуют хромофильную структуру, которая при световой микроскопии выявляется как вещество Ниссля. Нейроны широко варьируют по размерам и форме – от 600–700 мкм2 (тела клеток-зерен мозжечка) до 70000 мкм2 (некоторые нейроны передних рогов спинного мозга). Объем клеток коры головного мозга может достигать 20000 мкм2, а их наименьший объем – всего 500 мкм2<...>. На долю белка приходится около 80% сухого веса нейрона, а на долю липидов – 20%. Содержание углеводов во всей центральной нервной системе очень невелико и составляет всего 10% ее общего веса, при этом количество гликогена варьирует в зависимости от вида животного от 0,4до 0,14%.
Оболочка клетки

Рис. 2.3. Нервно-мышечный синапс:
А – схема концевой двигательной пластинки. Концевые веточки нервного волокна лежат в "синаптических ямках ", и обе структуры образуют нервно-мышечный синапс. Непосредственно под границей раздела аксоплазмы и саркоплазмы находятся лентовидные субневральные пластинки, которые в поперечном сечении имеют форму палочек; Б – синаптическая "ямка", или "желобок", на поперечном разрезе; В – две складки в области нервно-мышечного соединения; видно, как поверхностная саркоплазматическая мембрана соединяется с поверхностной аксоплазматической мембраной, образуя сложную синаптическую мембрану; 1 – аксоплазма (с митохондриями); 1a – митохондрия; 2 – миелиновая оболочка; 3 – шванновская клетка в области нервно-мышечного соединения; 4 – саркоплазма (с митохондриями); 5 – ядро мышечной клетки; 6 – миофибриллы; 7 – складка нервно-мышечного соединения; 8 – коллагеновые волокна; 9 – пузырьки
Рис 2.3. До появления электронной микроскопии о структуре клеточной оболочки было известно очень мало. Теперь мы знаем, что она представляет собой непрерывную сдвоенную мембрану, окружающую целиком тело клетки, дендриты и аксон. Помимо этого, аксон дополнительно окружен серией сложных липопротеидных пластин, спирально обернутых вокруг него, которые в периферической нервной системе образованы шванновскими клетками, а в центральной – клетками олигодендроглии. Клеточная оболочка состоит из двух электроноплотных слоев, разделенных бесструктурной промежуточной зоной. Следовательно, в определенном смысле это трехслойная оболочка, общая толщина которой равна примерно 90– 100 А. Оказалось, что эта оболочка геометрически асимметрична и что на ее внутренней, цитоплазматической стороне расположен более толстый и темный электроноплотный слой, а на наружной – более тонкий. Подобные же сдвоенные электроноплотные мембраны можно видеть и в клетке. Ядерная оболочка, эндоплазматическая сеть, комплекс Гольджи и митохондрии также образованы двойными мембранами. Мембраны комплекса Гольджи и митохондрии более симметричны, чем наружная плазматическая мембрана, и часто содержат окрашивающееся вещество в среднем "светлом" слое. Окружающие аксон мембраны шванновских клеток, мезаксон, связанный с миелиновой оболочкой, и синаптические мембраны также двухслойные (или трехслойные, если принимать светлую промежуточную зону за истинный слой). Термин "мезаксон" относится к тому отделу, где края цитоплазматической мембраны шванновской клетки смыкаются вокруг заключенного в них аксона и образуют дубликатуру. Аксон в известном смысле подвешен в складке цитоплазматической мембраны наподобие того, как в брюшной полости позвоночных кишка подвешена на дубликатуре брюшины – брыжейке (mesenterium) <...>. В области концевой двигательной пластинки, где плазматическая мембрана нейрона находится между аксоплазмой нервного волокна и саркоплазмой мышечного, мембрана эта несколько видоизменена. Здесь центральный участок между оболочками занят плотным веществом, увеличивающим общую толщину аксосаркоплазматической мембранной структуры до 500–700 А. Робертсон <...> обозначает это образование как синаптический мембранный комплекс, поскольку точно не ясно, какие слои следует обозначить в данном случае термином "клеточная оболочка".
На раннем этапе развития электронной микроскопии была выдвинута концепция "элементарной мембраны". Эта концепция исходила из допущения, что все клеточные мембраны имеют единый план строения, и на этом основании все внутриклеточные мембранные структуры можно было представить происходящими из наружной клеточной мембраны, как это показано на рис. 2.4. Эта концепция была основана на представлении о том, что все двухслойные мембраны имеют равную толщину и симметрию. Поскольку многочисленные исследования выявили различия в строении мембран митохондрий, аппарата Гольджи и -цитомембран <...>, в настоящее время гипотеза "элементарной мембраны" представляет, по-видимому, лишь исторический интерес. Несомненно, что отказ от этой гипотезы должен повлечь за собой дальнейшие исследования, призванные выяснить вопрос об источниках и процессах формирования внутриклеточных мембранных структур. Хотя происхождение таких мембранных систем неясно, наличие каналов эндоплазматической сети, которые, как полагают, сообщаются с внеклеточным пространством, общепризнано. Можно полагать, что эти каналы представляют "циркуляторную систему" клетки, которая облегчает поступление в нее питательных веществ и выход секретируемых продуктов и конечных продуктов обмена. Есть также наблюдения, показывающие, что эндоплазматическая сеть соединена с наружным слоем ядерной мембраны. Помимо этого, отверстия, или поры, в ядерной мембране служат тем путем, по которому идет обмен между нуклеоплазмой и цитоплазмой. Комбинация эндоллазматической сети и рибосом представлена в нейронах веществом Ниссля и является эквивалентом гранулярной эндоплазматической сети, описанной в других клетках. Кроме рибосом, связанных с эндоплазматической сетью, для нейронов характерно также и огромное число свободных рибосом, которые часто образуют скопления, или "розетки". Они особенно многочисленны в дендритах и перикарионе.
Ядро
Рис. 2.4. Ядро (1) нейрона имеет большие размеры и по сравнению с ядрами других клеток окрашивается слабо. Поскольку количество ДНК в нем такое же, как и в ядрах клеток печени, селезенки, мышц и поджелудочной железы (2,3 10-2 г), слабую базофилию можно объяснить дисперсией ДНК в относительно большом объеме. Ни световой, ни электронный микроскопы не выявляют в ядрах зрелых нейронов никаких признаков присутствия хромосом.

Рис. 2.4. Схема, иллюстрирующая концепцию Робертсона, согласно которой все цитоплазматические органеллы образуются из наружной клеточной мембраны:
1 – ядро; 2 – ядрышко; 3 и 4 – ямка; 5 – эндоплазматическая сеть; 6 – внутриклеточное пространство нейрона, сообщающееся с внеклеточным пространством; 7 – секреторная гранула; 8 – рибосомы; 9 – аппарат Гольджи с капельками секрета; 10 – митохондрия
Электронная микроскопия выявляет в двухслойной ядерной мембране множество отверстий, или пор, которые, по-видимому, обеспечивают обмен между нуклеоплазмой и цитоплазмой. Возможно, эти поры служат для выхода новообразованной РНК из ядра в цитоплазму, где она включается в состав вещества Ниссля (5).
В ядре нейрона обычно находится ядрышко (2), которое характеризуется высокой степенью базофилии. Ядрышко содержит большое количество РНК и покрыто тонким слоем ДНК. У человека ядрышко интенсивно окрашивается люксолевым синим прочным, который выявляет холинсодержащие липиды. Многочисленные исследования выявили связь ядрышка с синтезом рибонуклеопротеидов в те периоды, когда в нейроне осуществляется синтез белка. Значение реакции с люксолевым синим прочным пока не выяснено.
Хиден <...> показал, что ядрышко играет ведущую роль в жизни клетки, особенно в синтезе нуклеиновых кислот и белков. Наблюдения Тьюэри и Бурне <... > также показывают, что ядрышки клеток спинномозговых узлов (у крысы) являются центрами высокой метаболической активности и, возможно, участвуют в синтезе разнообразных ферментных белков. С помощью гистохимических реакций эти авторы обнаружили в ядрышке АТФазу, глюкозо-6-фосфатазу, сукцинатдегидрогеназу, щелочную фосфатазу, глюкозофосфорилазу, 5-нуклеотидазу и специфическую холинэстеразу <...>. Интенсивность этих гистохимических реакций, различная у разных клеток, по-видимому, зависит от активности ядрышка. Подобное обилие ферментов связано с дыхательной, энергетической и синтетической функциями нейрона. Конечно, выявляются и другие ферменты, но именно эти указывают на связь ядрышка с функциональными проявлениями нейронов, активное участие в которых принимают также аппарат Гольджи (9) и митохондрии (10).
Известно также, что ядрышки бывают разного размера – от небольших телец до крупных сложных образований, почти целиком заполняющих ядро. Электронно-микроскопические исследования позволяют предположить, что эти различия в размере ядрышка связаны с физиологическим состоянием клетки <...>. В то же время многие исследования показали, что размер ядрышка биохимически связан с его синтетической активностью. Наблюдения Тьюэри свидетельствуют о том, что существует связь между синтезом РНК, белков и липидов в ядрышке и переносом этих веществ в цитоплазму нервной клетки в тот момент, когда ядрышко оказывается вблизи ядерной мембраны. Эти наблюдения подтверждают более ранние данные Эйнарсона <...>, свидетельствующие о том, что вещество Ниссля (5) в нейроне исходит из ядрышка.
Структурно ядрышко представляет собой плотное внутриядерное скопление, состоящее из РНК, белков и липидов, а также некоторого количества ДНК. Является ли оно дискретной структурой или нет – вопрос спорный, поскольку у ядрышка нет выраженной пограничной мембраны. Постоянные изменения его размеров и положения, его гистохимических реакций, связанные с изменениями физиологического состояния нейрона, свидетельствуют об исключительно высокой пластичности этой органеллы и ее важном значении для синтеза РНК и различных ферментов.
В ряде электронно-микроскопических работ были описаны фибриллярные внутриядерные включения, имеющие решетчатую структуру и форму дисковидной пластинки диаметром 1,8 мкм и толщиной 0,1 мкм. Функция этих включений неизвестна.
Половой хроматин
В 1950 г. Барр обнаружил в ряде крупных нейронов скопление хроматина в форме небольшого овального тельца диаметром 0,5–2 мкм, которое располагалось вблизи ядрышка или примыкало к нему. Из-за почти постоянной связи этого образования с ядрышком оно было названо сателлитом ядрышка(рис. 2.1, 3). У особей женского пола оно было обычно крупнее, что послужило толчком к появлению ряда работ, в которых наличие или отсутствие этого образования было использовано для установления пола. Лучше всего сателлит ядрышка виден в клетках коры мозга и симпатических узлов. Это скопление хроматина, которое имеет отношение к инактивации одной из Х-хромосом самок, не надо путать с аргирофильным тельцем, которое было описано Кахалом и также находится в нуклеоплазме.
Одно из интересных наблюдений, сделанных Барром, состоит в том, что описанный им сателлит покидает свое место около ядрышка при раздражении клетки и движется по направлению к ядерной мембране. Было установлено также, что при этом сателлит увеличивается в размере. Это наблюдение совпадает с предположением о том, что ядрышко и его сателлит имеют важное значение для процессов синтеза рибонуклеопротеидов, количество которых возрастает в период раздражения клетки <...>.
Комплекс Гольджи
По электронно-микроскопическим описаниям эта структура расположена сбоку от ядра или вокруг него и состоит из системы довольно плотно упакованных двухслойных мембран и пузырьков. В световом микроскопе это образование имеет вид грубых волокнистых или пузырчатых телец. Подобно ядрышку, комплекс Гольджи испытывает циклические изменения, отражающие его функциональную активность. Он может занимать положение возле ядра или распределяться по цитоплазме, волнообразно распространяясь от ядра к периферии <...>. Некоторые исследователи полагают, что существует связь между комплексом Гольджи и эндоплазматической сетью. Так, Малатра <...> выявил в нейронах млекопитающих базофильные скопления неправильной формы вблизи комплекса Гольджи. При окрашивании по Нисслю скопления занимают положение, характерное для вещества Ниссля в тех же нейронах. Это позволяет предположить, что комплекс Гольджи и вещество Ниссля определенным образом связаны друг с другом.
Часто в состав комплекса Гольджи входят округлые тельца, образованные частично липидами или фосфатидами, что дало основание обозначать эту структуру термином "липохондрии". Гистохимические исследования указывают также на присутствие в комплексе Гольджи мукополисахаридов.
Митохондрии
При световой микроскопии эти небольшие цитоплазматические структуры обычно имеют форму палочек. В нервной клетке они находятся вблизи ядра или рассеяны по цитоплазме, образуя скопления в концевых синаптических расширениях. Митохондрии обнаруживаются в дендритах и часто находятся в близком соседстве с эндоплазматической сетью. В аксонах они имеют форму сильно удлиненных палочек, расположенных параллельно длинной оси аксона. В периоды активного синтеза, которые могут наступать после перерезки аксона, число митохондрий возрастает. В этих небольших тельцах обнаруживаются цитохромоксидаза и сукцинатдегидрогеназа, а также и другие дыхательные ферменты.
Рис. 2.5. и 2.6. По-иному выглядят митохондрии при электронно-микроскопическом исследовании. Палад <...> и Шестранд <...> показали, что митохондрии окружены двойной мембраной и содержат поперечные перемычки – кристы, образованные такой же мембраной. Палад считал, что кристы образованы внутренним листком мембраны митохондрии, тогда как Шестранд полагал, что они представляют собой обособленные структуры (рис. 2.6). Мембраны митохондрий сходны с поверхностной мембраной клетки, однако они значительно тоньше; их толщина, по данным Шестранда, составляет всего 50А. До сих пор не выяснено, каким образом формируются митохондрии, мембраны которых сходны с поверхностной клеточной мембраной, мембраной комплекса Гольджи и другими. Поскольку существуют различия между разными мембранными системами, что предполагает существование различий в их молекулярной архитектуре, концепция единого происхождения всех мембранных структур (гипотеза "элементарной мембраны") представляется сомнительной.

Рис. 2.5. Многочисленные митохондрии и синаптические окончания с синаптическими пузырьками в коре мозга; х 25000:
1 – митохондрии; 2 – синаптические пузырьки

Рис. 2.6. Реконструкция небольшого участка цитоплазмы нейрона, содержащего митохондрию и часть эндоплазматической сети; х 500000
Считается, что митохондрии играют важнейшую роль в клеточном дыхании. Особо чистые фракции митохондрий отличаются высокой интенсивностью окисления глутамата, сукцината, -кетоглутарата, пирувата и оксалацетата. Меньшие скорости окисления зарегистрированы для глицерин-1-фосфата, фумарата, глюкозо-6-фосфата, -оксибутирата, изоцитрата, цитрата и -аминобутирата. Хотя существует единое мнение, согласно которому митохондрии обеспечивают цикл лимонной кислоты и окислительное фосфорилирование, их участие в гликолизе еще не выяснено отчасти из-за трудностей приготовления совершенно чистой фракции митохондрий. Так, если некоторые исследователи полагают, что существует несомненная связь между митохондриями мозга и гликолизом, то другие считают, что в ткани мозга лишь 10% гликолиза (или даже меньше) можно отнести за счет активности митохондрий. Если прежние представления о функции митохондрий мозга предполагали существование различий между ними и митохондриями других тканей, то исследования Левтрупа и Свеннерхолма <...>, напротив, подчеркивают их сходство.
Нейрофибриллы и нейротрубочки
С помощью различных гистологических методов в аксоне выявляются тонкие четко очерченные волоконца (нейрофибриллы), которые продолжаются в тело клетки и дендриты. Их наблюдали и в живых клетках и при электронно-микроскопических исследованиях. Эти волоконца часто перекрещиваются или сливаются и образуют густую сеть. Дэвид и сотр. <...> представили данные, которые свидетельствуют о том, что нейрофибриллы, обнаруживаемые при световой микроскопии, являются компонентами эндоплазматической сети нервных клеток после ее обработки гистологическими фиксаторами и импрегнации серебром. Однако эти данные требуют подтверждения. Несомненно лишь то, что нейрофибриллы обычно обнаруживаются во всех частях нервной клетки; функция их остается совершенно неизвестной. Есть данные, показывающие, что у ящериц в период зимней спячки и у млекопитающих при гипотермии нейрофибриллы объединяются в пучки. С помощью электронного микроскопа в нейронах были обнаружены нервные трубочки диаметром около 200А, функция которых также неизвестна.
Вещество Ниссля
Для нейронов характерно присутствие в цитоплазме скоплений базофильного вещества, которое было названо веществом Ниссля в честь открывшего их гистолога. Гистохимические и электронно-микроскопические методы позволили показать, что эти образования состоят из скоплений узких трубчатых структур, поверхность которых часто (но не всегда) покрыта мелкими зернышками, или гранулами, диаметром 100–300А. Эти трубчатые структуры образуют уплощенные цистерны, трубочки или пузырьки эндоплазматической сети (рис. 2.1 и 2.4). Зернышки, одиночные, собранные в ряды или розетки, сходны с рибосомами (базофильными частицами), которые удается выделить из разных клеток, например, из клеток печени. Они могут прилегать к трубочкам эндоплазматической сети или располагаться поблизости от них. Эти гранулы состоят из рибонуклеиновой кислоты, соединенной с белком (РНК-Б). Количество РНК в нейронах разного типа различно и колеблется от 40 до 1550 пг. Все существующие данные свидетельствуют о том, что эндоплазматическая сеть и связанная с ней РНК имеет отношение к синтезу белка, происходящему под контролем ядра. Вероятно, синтезируемые здесь ферменты и другие белки передвигаются по аксону, даже если длина его достигает 1 м и более. Как это происходит, неясно, но наблюдения показывают, что меченые аминокислоты захватываются нейроном и затем медленно следуют вдоль аксона. Это явление "аксоплазматического тока" веществ, по-видимому, дополняется существованием локального синтеза белков в участках аксона, расположенных дистальнее перикариона <...>. Активное передвижение веществ по аксону наблюдали также и в культуре ткани. Характерные свойства вещества Ниссля можно наблюдать после перерезки аксона. При этом периферическая часть перерезанного волокна дегенерирует, и в то же время в телах изолированных нейронов можно в течение нескольких часов наблюдать движение вещества Ниссля по направлению к аксону. In vivo в веществе Ниссля происходят изменения, свидетельствующие об усилении белкового синтеза, и уже вскоре на проксимальном конце перерезанного аксона можно видеть появление отростков. Однако необходимо заметить, что в аксоне обнаружить вещество Ниссля не удавалось, хотя участки "голой" эндоплазматической сети в нем обнаруживаются.
Рис 2.7. При световой микроскопии вещество Ниссля можно видеть в дендритах и теле клетки. Оно никогда не встречается в области аксонного холмика и в самом аксоне <...>. Однако в аксоне можно видеть фрагменты "голой" эндоплазматической сети, подобной той, к которой в теле клетки прикреплены рибосомы и которая составляет вещество Ниссля. Не вполне ясно, действительно ли "голые" мембраны эндоплазматической сети составляют каркас вещества Ниссля.

Рис. 2.7. Окрашенное вещество Ниссля в двигательной нервной клетке:
А – толуидиновый синий (время окрашивания – 3 дня); Б – толуидиновый синий – 7 дней; В – крезиловый фиолетовый прочный – 3 дня; Г – крезиловый прочный – 7 дней
Размер телец Ниссля и их распределение в нейронах разных типов различны. Так, в мотонейронах находятся очень крупные скопления вещества Ниссля, а в клетках сенсорных ганглиев оно представлено небольшими частицами. В клетках дорсального ядра, лежащего в медиальном отделе заднего рога спинного мозга, а также в нейросекреторных нейронах мозга глыбки вещества Ниссля рассеяны по периферии перикариона, а в телах пирамидных клеток коры мозга они распределены более равномерно. Было отмечено, что вещество Ниссля, расположенное возле ядра, окрашивается более интенсивно. Существуют также различия в строении вещества Ниссля у разных животных. Кроме того, это вещество и его способность окрашиваться основными красителями меняются при изменении активности клетки. Эйнарсон и Крог <...> предложили классификацию функциональных состояний нейронов в связи со степенью базофилии, которая в свою очередь определяется состоянием вещества Ниссля.
Во-первых, существуют хромонейтральные клетки, или клетки в "нормальном" состоянии, в которых, как, например, в мотонейронах, вещество Ниссля выражено контрастно. Это соответствует состоянию покоя или умеренной активности. Гиперхромные или умеренно хромофильные клетки окрашиваются интенсивнее. Несколько телец Ниссля находится обычно возле ядра, ядрышко окрашивается интенсивно и часто несколько увеличено, в ядре обнаруживается множество окрашенных частиц. Такие нейроны можно характеризовать как клетки в состоянии несколько повышенной активности. Подобная гистологическая картина соответствует определяемому биохимически увеличению количества РНК-Б в клетках, раздражение которых сопровождается их умеренной активностью. В умеренно хромофобных клетках наблюдается снижение количества вещества Ниссля и уменьшение интенсивности окраски на фоне увеличения количества ядерного хроматипа. При этом ядерная мембрана окрашивается интенсивно и ядрышко увеличено. В таких клетках видны "перинуклеарные шапочки" из базофильного вещества, но иногда при этом вещество Ниссля также обнаруживается в краевых отделах цитоплазмы. Полагают, что такая картина характерна для состояния усиленной импульсной активности, что, несомненно, должно сопровождаться повышением интенсивности обмена клетки. Наличие перинуклеарных шапочек и увеличение количества хроматина в ядре свидетельствуют об усиленном образовании нуклеиновых кислот, покидающих ядро. Эта и следующая за ней стадия, по-видимому, совпадают со снижением общего количества РНК-Б, которое наблюдали Хиден и Пиджон <...> при длительном раздражении нервных клеток. Резко хромофобные клетки окрашиваются бледно, в их цитоплазме и ядре почти нет окрашивающихся веществ. Ядро этих клеток бывает расположено эксцентрично и находится в состоянии хроматолиза. Контуры ядра зачастую неровные, сморщенные. В крайних случаях ядрышко теряет способность окрашиваться. Такое состояние близко к "хромофобии истощения". Резко хромофильные клетки окрашиваются интенсивно и содержат плотно упакованные темные тельца Ниссля наряду с уменьшением содержания небазофильного вещества. Контуры этих клеток очень четкие и часто окрашиваются на значительном протяжении вдоль отходящих от тела отростков. Ядро окрашивается интенсивно, ядерная мембрана подчас неразличима, по ядрышко можно видеть. Все это характерно для клеток, которые, по-видимому, физиологически неактивны. Можно сказать, что в таких клетках синтез нуклеиновых кислот, белков, ферментов превышает потребность в них. Необходимо отметить, что клетки в состоянии крайней базофилии способны накапливать значительно меньшие количества меченых веществ после внутривенного введения 3Н-лизина, чем расположенные рядом "нормальные" клетки. Объяснение этого явления подтверждает точку зрения Эйнарсона, согласно которой резко базофильные клетки в момент инъекции находились по сравнению с другими клетками в состоянии пониженной физиологической активности. Другие исследователи полагают, что подобные интенсивно окрашенные и сморщенные клетки являются артефактом. В условиях патологии резко хромофобные клетки затем подвергаются полному лизису, а резко хромофильные – склерозу и атрофии. Следовательно, мы видим широкий ряд базофильных состояний нейрона, которые нужно принимать во внимание, поскольку степень базофилии дает представление о физиологическом состоянии клетки. Такого же мнения о связи базофилии с функциональным состоянием нейрона придерживается и ряд других исследователей <...>. Фактически эти данные уже позволили получить анатомические подтверждения представления о том, что не все клетки "нейронного пула" одновременно находятся в состоянии функциональной активности.
Плотное тельце
В течение многих лет электронные микроскописты описывали в цитоплазме нейрона "плотное" тельце, которое отличается очень высокой степенью электронной плотности и, как теперь установлено, состоит из плотно упакованных пластин. Теперь считают, что эта структура соответствует тому образованию, которое де Дюв (1969) называл лизосомой. Эти плотные частицы богаты кислой фосфатазой, -глюкоронидазой, кислыми нуклеазами, катепсином и целым рядом растворимых гидролитических ферментов, для активности которых оптимальной является кислая среда. Было высказано предположение, что в поврежденной клетке эти плотные тельца разрушаются и высвобождают содержащиеся в них ферменты, которые участвуют в растворении тела клетки.
Синапс
Рис. 2.8. Хотя можно сказать, что электронная микроскопия способствовала углублению наших знаний в области структуры нервной системы вообще, это особенно справедливо в отношении тонкого строения синапса < ...>. Успехи в изучении большого числа физиологических процессов во многом обусловлены успехами в изучении нейрональных мембран в области синапса. Шеррингтон <...>, который создал термин "синапс", произведя его от греческого слова "соединять", еще в 1897 г. высказал предположение, что явления, характерные для рефлекторной дуги, можно достаточно полно объяснить свойствами прилежащих друг к другу мембран двух нервных клеток.

Рис. 2.8. Синапс в стволе мозга рыбы. Обращает на себя внимание скопление синаптических пузырьков (1) в пресинаптической части возле синаптической щели (2)
В области синапса пресинаптическое волокно оканчивается расширением – синаптической пуговкой. Пуговка тесно примыкает к участку постсинаптического нейрона; этот участок называется субсинаптической мембраной. Между двумя мембранами имеется синаптическая щель (2) шириной 150–250 А.
Рис. 2.9, 2.10 и 2.11. Для синапса характерны следующие структуры.

Рис.2.9. Электронная микрофотография нервной ткани:
Стрелками показаны синаптические структуры, сверху – пресинаптические элементы, снизу – постсинаптические
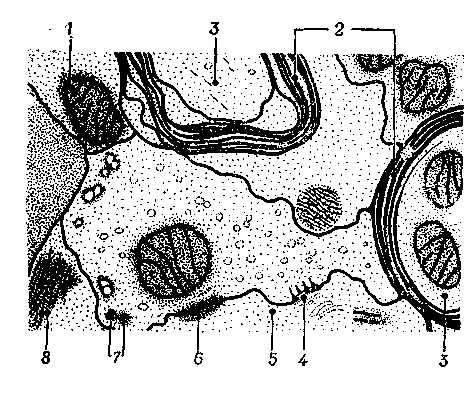
Рис. 2.10. Схема, основанная на данных электронно-микроскопических исследований Грея, показывающая отношение митохондрий к различным структурам синапса: 1 – митохондрия; 2 –миелин; 3 – аксон; 4 – пресинаптические уплотнения; 5 – дендрит; 6 – пластинка межклеточного соединения; 7 – синаптические пузырьки; 8 – глиофибриллы

Рис. 2.11. Реконструкция молекулярной конфигурации пресинаптического окончания.
Хорошо видны митохондрия и синаптические пузырьки. Весь комплекс назван везикулярной пресинаптической решеткой
1. Синаптические пузырьки диаметром 300–600А присутствуют в большом количестве в концевом пресинаптическом расширении <...>. В постсинаптической цитоплазме их, как правило, нет. Эти пузырьки содержат, вероятно, запасы медиатора, выделяющегося на месте синаптичeского контакта <...>. Было высказано предположение, что синаптические пузырьки открываются и их содержимое изливается в синаптичeскую щель, что обеспечивает выделение порций ацетилхолина <...> или других медиаторов <...>. Некоторые пузырьки бывают крупнее остальных, а иногда в нейронах одновременно содержатся пузырьки круглой и овальной формы. Другой разновидностью синаптических пузырьков являются пузырьки, содержащие электроноплотное вещество. Полагают, что в мелких пузырьках таким веществом является ацетилхолин.
2. Относительно большое число митохондрий, находящихся в пресинаптическом отделе синапса.
3. Уплотнение и утолщение пре- и постсинаптических мембран (особенно последней) на месте синаптического контакта.
Дополнительно были описаны еще две структуры синаптического соединения <...>:
4. Небольшие межмембранные элементы, расположенные в синаптической щели и ориентированные перпендикулярно обращенным друг к другу мембранам. Отдельные участки этих структур целиком пересекают синаптическую щель, другие доходят лишь до ее середины. Толщина этих нитевидных структур в среднем 70 А, расстояние между ними 165 А.
5. Субсинаптическая органелла. Полагают, что эта органелла образована скоплением зернистых и нитевидных электроноплотных структур, выходящих из субсинаптической мембраны па 200–670 А в цитоплазму постсинаптического нейрона. Это послужило основанием считать, что так называемое постсинаптическое утолщение мембраны на самом деле лишь кажущееся.
Ряд авторов описывает непостоянные шиповидные структуры синаптической мембраны, разделенные расстояниями примерно 1000 А. Грей <...> считал, что эти выросты, подобно синаптическим пузырькам, участвуют в выработке сипаптических медиаторов. Паппас <...> обнаружил в ядре уздечки другую разновидность синаптических органелл: в субсинаптической области видны гексагональные участки электроноплотных частиц. Значение всех этих субсинаптических органелл до сих пор неизвестно.
В центральной нервной системе обычно различают 3 основных типа синапсов: аксо-дендритные, аксо-соматические и аксо-аксонные. Четвертый тип межнейронных контактов – это дендродендритное соединение. Сравнительно недавно было описано так называемое "плотное соединение" ("tight-junction").
1. Аксо-дендритный синапс. Этот тип синаптического контакта легко различать на электронных микрофотографиях, так как ему присущи все типичные признаки синапса, описанные выше.
2. Аксо-соматический синапс. В этом случае также не возникает трудностей в распознавании синаптического контакта. Тело клетки отличается присутствием телец Ниссля, гранул РНК-Б и эндоплазматической сети. Однако в этих синапсах нет субсинаптических органелл, но в ряде случаев можно видеть межмембранные элементы.
3. Аксо-аксонный синапс. Грей <...> и ряд других исследователей описали в спинном мозге контакты, в которых аксон оканчивается на другом аксоне в том месте, где последний образует контакты с несколькими дендритами. Это аксо-аксонный синапс, подобный тем, которые были описаны также в коре мозжечка. Открытие подобного рода синапсов, накладывающихся на пресинаптическое окончание, в значительной степени способствовало объяснению явления пресинаптического торможения. В коре мозжечка аксоны корзинчатых клеток образуют синаптические контакты на аксонах или аксонных холмиках клеток Пуркинье и обеспечивают пресинаптическое торможение аксона в месте его начала.
4. Дендро-дендритное соединение. При распознавании этого типа межнейронного контакта возникают значительные трудности. Ван дер Лоос <...>, исследуя серийные срезы с помощью светового и электронного микроскопов, описал характерные признаки этого типа соединения. Возле области контакта отсутствуют синаптические пузырьки, и количество митохондрий не превышает нормального их числа в данном участке дендрита. Иногда можно видеть межмембранные элементы, диаметр и периодичность которых такие же, как и в аксо-дендритном синапсе. Измерения показали, что площадь дендро-дендритного контакта может варьировать от 0,5 до 10 мкм2. Функциональное значение дендро-дендритных соединений остается неясным.
5. "Плотные соединения", которые бывают аксо-дендритными и аксо-соматическими, представляют собой "безмедиаторный" тип синапса, в котором нет синаптических пузырьков. Смыкающиеся мембраны по существу сливаются друг с другом, образуя довольно толстую мембранную структуру, лишенную синаптической щели. Предполагают, что этот тип синапса обеспечивает прямое электрическое раздражение одного нейрона другим и "распространение" возбуждения.
Исследования Грея <...> и Хэмлина <...> показали, что аксо-дендритные и аксо-соматические синапсы бывают двух типов – 1-го и2-го. Отличие синапса 1-го типа от синапса 2-го типа состоит в следующем: синаптическая щель его шире (300 А против 200А у синапса 2-го типа); постсинаптическая мембрана плотнее и толще, в межсинаптической щели вблизи субсинаптической мембраны находится зона, содержащая внеклеточное вещество. Синапсы на небольших дендритных шипиках пирамидных клеток коры большого мозга всегда принадлежат к 1-му типу, тогда как синапсы на телах пирамидных клеток всегда 2-го типа. Было сделано предположение, что синапсы 2-го типа служат гистологическим субстратом торможения. Многие из описанных выше типов синаптических контактов могут находиться на одном и том же нейроне, как это можно видеть на пирамидных клетках гиппокампа.
Отношение отростков клеток глии к синапсам остается неясным. Грей <...> установил, что между двумя отделами синаптической мембраны глиальных отростков нет. Палей <...> между тем представил доказательства того, что такие отростки могут внедряться между синаптическими поверхностями.
Расстояния между концевым расширением аксона и краем миелиновой оболочки, окружающей аксон, бывают различными. Эти расстояния очень невелики, и, как показали электронно-микроскопические исследования, край миелиновой оболочки и синаптическую мембрану могут разделять 2 мкм.
Пигменты
Рис 2.12,А. Среди различных цитоплазматических включений (вакуоли, гликоген, кристаллоиды, железосодержащие гранулы в substantia nigra) есть и некоторые пигменты. Эти пигментные гранулы имеют черный или темно-коричневый цвет и содержат вещество, подобное меланину. Такие гранулы обычно можно видеть в клетках черного вещаcmвa (substantia nigra), голубого пятна (locus coeruleus) и иногда в клетках дорсального двигательного ядра блуждающего нерва, в нейронах спинномозговых и симпатических узлов. Какую роль эти гранулы играют в нормально функционирующем нейроне, не ясно, однако было установлено, что при таком заболевании, как синдром Паркинсона, уменьшается число клеток в substantia nigraи других областях мозга, где находятся пигментированные клетки. Это еще не означает, что в патологический процесс вовлекается сам пигмент, но, по-видимому, при этом поражаются именно те клетки, которые содержат меланиноподобный пигмент.


Рис. 2.12. Пигменты и секреты:
А – клетки substantia nigra под световым микроскопом. Видны крупные скопления пигмента, сходного с меланином; Б – локализация 35S-1-цистина в мозге крысы, выявляемая радиоавтографическим методом: 1 – кора; 2 – белое вещество; 3 – паравентрикулярное ядро; 4 – супраоптическое ядро; 5 – сосудистое сплетение. Обратите внимание на то, что супраоптическая и паравентрикулярная области содержат больше метки, чем любая другая область мозга; В – нейро секреторные клетки в супраоптическом ядре собаки. Видно, что многие клетки и их аксоны заполнены нейросекреторным веществом; Г – ножка гипофиза собаки, в которой видны многочисленные аксоны (стрелки), заполненные нейросекретом (В и Г–окрашивание альдегид-фуксином по Гомори)
Уменьшение числа пигментированных клеток в substantia nigra в последнее время связывают со снижением содержания дофамина в этом ядре, а также в хвостатом ядре. Поскольку и меланиноподобный пигмент и дофамины образуются из тирозина, исследователи склонны связывать эти три вещества между собой, а снижение содержания дофамина – с синдромом Паркинсона.
В нервных клетках также наблюдали лппохромные и липофусциновые гранулы желто-зеленого, серого, темно-оранжевого и орехово-красного цвета. Хиден <...> показал, что желтоватые пигментные гранулы впервые появляются в нейронах спинного и продолговатого мозга в 7–8-летнем возрасте. С возрастом число этих гранул увеличивается без явного нарушения функции нервных клеток, хотя количество вещества Ниссля в них уменьшается.
Нейросекреция
Рис 2.12, Б, В, Г. Некоторые нейроны претерпевают изменения, в результате которых секреция становится их основной функцией. Так, в клетках супраоптичсского и паравентрикулярного ядер находятся секреторные гранулы, которые содержат гормоны задней доли гипофиза (антидиуретический гормон, вазопрессин, окситоцин). Эти секреторные гранулы, сливаясь, образуют в теле клетки и аксоне капельки, которые избирательно окрашиваются хромовым гематоксилином и флоксином по методу Гомори и альдегид-фуксином. Окрашивающийся при этом материал не является собственно гормоном, а представляет собой крупную гликоли-попротеидную молекулу-носитель. Сам гормон содержит много цистина, который можно обнаружить в ядрах мозга с помощью радиоавтографии после введения35S-цистина(рис. 2.12, Б).
В ядрах клеток супраоптического ядра содержится множество мелких флоксинофильных гранул, количество которых в ядрах клеток паравентрикулярного ядра невелико; в последних преобладают небольшие базофильные гранулы. Помимо этого, в супраоптическом ядре более отчетливо, чем в паравентрикулярном, выражена периферическая локализация вещества Ниссля в телах нервных клеток. Данные, показывающие, что клетки этих ядер имеют определенные морфологические различия, можно сопоставить с наблюдениями, свидетельствующими о том, что перивентрикулярные нейроны, по-видимому, в первую очередь связаны с выработкой окситоцина, тогда как супраоптические нейроны осуществляют главным образом синтез антидиуретического гормона и вазопрессина.
Образование миелина
Рис. 2.13. Аксоны нервных клеток заключены в липопротеидную оболочку, которая начинается несколько отступя от тела клетки и заканчивается на расстоянии 2 мкм от синаптического окончания. Эта оболочка находится снаружи от пограничной мембраны аксона (аксолеммы); последняя, как и оболочка тела клетки, продолжением которой она является, состоит из двух электроноплотных слоев, разделенных менее плотным слоем. Нервные волокна, окруженные такими липопротеидными оболочками, называются миелинизированными. В прошлом с помощью светового микроскопа не всегда удавалось видеть такой "изолирующий" слой вокруг многих периферических нервных волокон, которые из-за этого были отнесены к немиелинизированным. Однако электронно-микроскопические исследования показали, что и эти волокна также заключены в тонкую липопротеидную оболочку.

Рис. 2.13. Схема образования миелиновой оболочки:
А – представлены четыре стадии "обволакивания" аксона (2) шванновской клеткой (1) и его обертывания несколькими сдвоенными слоями мембраны, которые после сжатия образуют плотную миелиновую оболочку; Б – образование складки поверхностной мембраны шванновской клетки, формирующей плотный миелин, согласно теории Герен. Обратите внимание на различие между внутренней и наружной поверхностями собирающейся в складку мембраны; в сдвоенной мембране вступает в силу "фактор различия " Финеана, и становится понятным, почему повторяющиеся в радиальном направлении периоды миелиновой оболочки включают два бимолекулярных липопротеидных листка (две мембраны)
Микрохимическими исследованиями установлено, что эти оболочки содержат холестерин, фосфолипиды, некоторые цереброзиды и жирные кислоты, а также белковые вещества, которые сохраняются после извлечения липидных компонентов. Белковые вещества миелиновой оболочки при световой микроскопии имеют вид переплетающейся сети и, по-видимому, являются тем, что обозначается термином "нейрокератин". Химическая природа миелина периферических нервных волокон и миелина центральной нервной системы несколько различна. Это, возможно, связано с тем, что в центральной нервной системе миелин образуется клетками олигодендроглии, а в периферической – шванновскими клетками.
Липопротеидные оболочки нервных волокон не сплошные, а прерываются вдоль волокна промежутками, которые называются перехватами Ранвье (рис. 2.14 и 2.15). Эти перехваты существуют и в центральной, и в периферической нервной системе (в последней они встречаются чаще), хотя их строение и периодичность в этих двух отделах нервной системы различны. Отхождение ветвей от нервного волокна приходится нередко на место перехвата Ранвье, которое соответствует месту смыкания двух шванновских клеток, образующих миелиновую оболочку периферического нервного волокна.

Рис. 2.14. Электронно-микроскопическая картина перехвата Ранвье:
Стрелкой указаны пластины миелина. Обратите внимание на то, что в области перехвата
каждая последующая пластина миелина перекрывает предыдущую

Рис. 2.15. Схема, показывающая, что в центральной нервной системе один олигодендроцит может участвовать в образовании миелиновых оболочек нескольких аксонов:
1 – олигодендроцит; 2 – аксон; 3 – связь между телом клетки глии и миелиновой оболочкой; 4 – цитоплазма; 5 – плазматическая мембрана; 6 – перехват Ранвье; 7 – петля плазматической мембраны; 8 – мезаксон; 9 – гребешок
У места окончания миелиновой оболочки на уровне перехвата Ранвье наблюдается небольшое сужение аксона, диаметр которого уменьшается примерно на одну треть. Это наблюдение было сделано преимущественно на крупных аксонах. В том месте перехвата, где аксон обнажен, его диаметр несколько увеличивается. Такой "голый "участок бывает различной длины: примерно от 0,5 мкм у толстых (10–15 мкм в диаметре) волокон до 2,5 мкм у тонких (3–10 мкм в диаметре) волокон. Однако в области перехвата аксон обнажен не полностью, так как его окружают небольшие пальцевидные отростки, образуемые двумя сходящимися в перехвате шванновскими клетками. Эти пальцевидные отростки шванновских клеток в действительности не контактируют с поверхностью аксона.
Миелинизация периферического нервного волокна
Рис. 2.16 и 2.17. За формирование миелина вокруг периферических нервных волокон ответственны шванновские клетки. В ранних описаниях процесса миелинизации высказывалось предположение, что шванновская клетка обертывается вокруг аксона, а затем в образовавшемся футляре вырабатывается миелин. Наружный слой шванновской клетки сохраняется как поверхностная структура, которая окружает миелин, а в области перехвата Ранвье приближается к аксону и вступает с ним в контакт <...>. Считалось также, что наружная мембрана шванновской клетки образует неврилемму.

Рис.2.16. Седалищный нерв крысы:
А – поперечное сечение седалищного нерва крысы; крупный миелинизированный аксон, содержащий немногочисленные органеллы, окружен цитоплазмой интернодальной шванновской клетки; видны наружный и внутренний мезаксоны; х 29 000; Б – поперечный срез миелиновой оболочки седалищного нерва крысы; пластинчатая структура миелина образована плотными и менее плотными линиями, чередующимися с периодом 120–130 А; х 195000
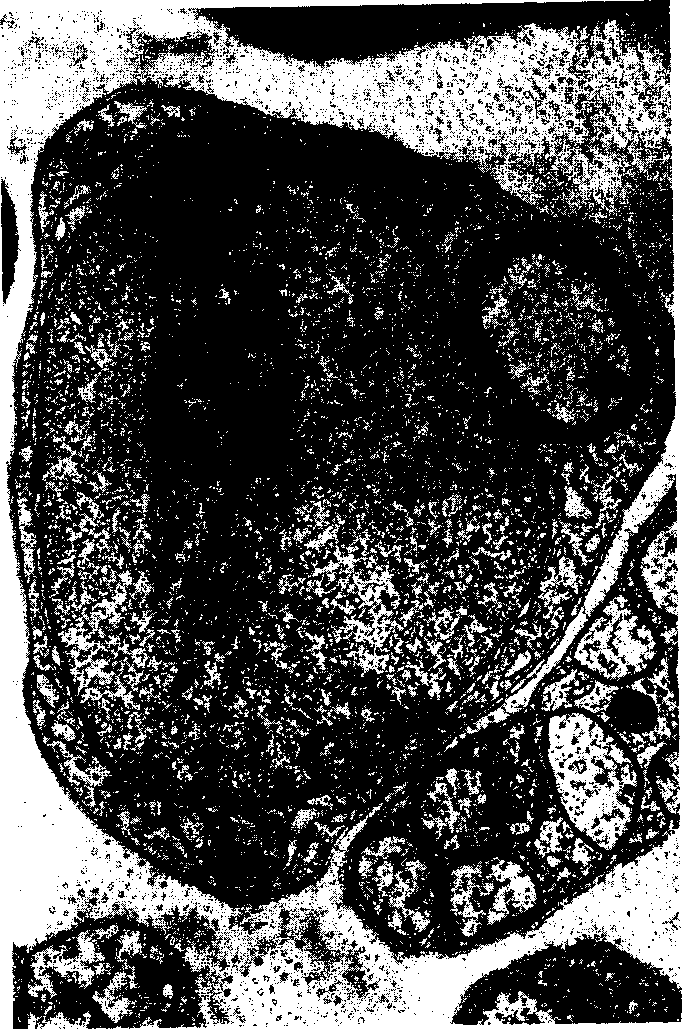
Рис. 2.17. Поперечное сечение седалищного нерва морской свинки:
Небольшой миелинизированный аксон находится внутри шванновской клетки, которая содержит, кроме того, митохондрии, эндоплазматическую сеть и ядро. Расположенные в нижнем правом углу снимка поперечно срезанные волокна – это немиелинизированные аксоны автономной нервной системы, вокруг которых находится только один слой оболочки шванновской клетки; х 36 000
Многие электронные микроскописты подтвердили, что миелин периферического нерва действительно образуется шванновской клеткой <...>. Однако теперь уже не считают, что это происходит вследствие внутриклеточного накопления липидов в шванновской клетке. Было показано, что миелин состоит из серии клеточных мембран, которые смыкаются друг с другом по мере того, как напоминающие псевдоподии отростки шванновской клетки обертываются вокруг аксона. В целом эти мембраны сходны с цитоплазматическими мембранами других клеток млекопитающих, птиц, амфибий и т. д. Следовательно, эти мембраны имеют три отчетливо выраженных молекулярных слоя: центральный бимолекулярный липидный слой, наружный мономолекулярный белковый слой и внутренний монослой белка, или, возможно, углеводов. Шванновская клетка, образно говоря, сама себя обертывает вокруг аксона.
После того как такое спиральное "обертывание" началось, может сформироваться более 100 спиральных слоев, образующих в высшей степени правильную пластинчатую структуру нормального миелина (рис. 2.16). Цитоплазма, содержащаяся в отростках шванновской клетки, почти полностью выдавливается из них в процессе "обертывания" вокруг аксона, так что вес цитоплазматические органеллы в конечной стадии формирования миелиновой оболочки сосредоточиваются вблизи ядра шванновской клетки, а также в дистальном и проксимальном концах пластинчатой оболочки. Этот процесс обеспечивает сближение и тесный контакт смежных мембран. Кроме того, в процессе спирального обертывания пластин каждая последующая пластина перекрывает предыдущую дистально и проксимально. Протяженность такого перекрытия можно видеть в перехватах Ранвье, где встречаются смежные шванновские клетки (рис. 2.14).
Как показывают электронно-микроскопические данные, миелин полностью сформированной оболочки состоит из плотных линий толщиной около 25 А, которые повторяются в радиальном направлении с периодом приблизительно 120А. Между плотными линиями находится светлая зона, разделенная надвое менее плотной промежуточной линией, имеющей неправильные очертания. Главная плотная линия образуется там, где сливаются смежные слои внутренней поверхности мезаксона, происходящего из шванновской клетки. Менее плотная промежуточная линия представляет собой место слияния наружных поверхностей мембран шванновской клетки, после того как из спирального отростка, обернутого вокруг аксона, выдавливается цитоплазма (рис. 2.13, А,Б). Обычно считалось, что светлая зона миелиновой оболочки содержит липиды. Однако, как показал Робертсон, липиды занимают лишь небольшую часть светлой зоны, а оставшаяся часть представляет собой сильно насыщенное водой пространство между двумя компонентами бимолекулярного липидного слоя <...>. По-видимому, это пространство доступно для циркуляции ионов. Было установлено, что миелин состоит из многих слоев клеточной мембраны шванновской клетки, спирально обернутых вокруг аксона (рис. 2.16,Б). Так как в конечном итоге вся цитоплазма шванновской клетки выдавливается, в результате остается пласт сомкнутых клеточных мембран с электроноплотными линиями, образованными белковыми слоями этих мембран, и светлыми промежуточными зонами, состоящими из богатых водой липидов клеточной мембраны.
Рис. 2.18 и 2.19. При исследовании с помощью светового микроскопа, помимо перехватов Ранвье, был описан еще один вид "дефектов" миелиновой оболочки – насечки Шмидта-Лантермана, которым приписывалась функция каналов для обмена между аксоном и периневрональными пространствами. Существование таких щелей в миелиновой оболочке было подтверждено данными электронной микроскопии, которые, однако, показали, что это не каналы, а скорее участки, в которых миелиновые пластины "отклеились" друг от друга и разошлись в стороны, возможно, как предположил Робертсон <...>, в результате гистологической обработки. Поскольку Робертсон обнаружил, что при значительном растяжении нервов насечки не образуются и что в препаратах волокон, для выделения которых применяли раствор Рингера или другие солевые растворы, число насечек увеличивается, точка зрения этого исследователя, считающего насечки артефактом, представляется правдоподобной, хотя в литературе имеются сообщения о том, что эти насечки выявляются в нефиксированных нервных волокнах при фазовоконтрастной микроскопии.

Рис. 2.18, А – схема ультраструктуры насечки Шмидта – Лантермана: 1 – цитоплазма шванновской клетки; 2 – мембрана шванновской клетки; 3 – мембрана аксона; 4 – основная мембрана; 5 – промежуток между мембранами аксона и шванновской клетки; 6 – аксоплазма; 7 – щель между пластинами миелина; 8– пластина миелина;
Б – схема молекулярной структуры мембраны шванновской клетки. Согласно существующей теории, клеточная мембрана состоит из бимолекулярного липидного слоя; полярные поверхности слоя покрыты монослоями нелипидного вещества; кружками обозначены полярные концы липидных молекул; нелипидные слои указаны ломаными линиями

Рис. 2.19. Часть продольного среза насечки Шмидта–Лантермана:
А. х 67000; Б. х 100000
Как уже указывалось, не все волокна периферических нервов можно отнести к миелинизированным. В частности, это касается так называемых постганглионарных волокон автономной нервной системы, которые долгое время считались немиелинизированными. Тем не менее эти волокна, как и другие периферические "немиелинизированные" волокна, связаны, подобно "миелинизированным", со шванновскими клетками. При электронно-микроскопическом исследовании видно, что эти волокна погружены во вдавление шванновской клетки, клеточная оболочка которой образует одиночный спиральный слой вокруг каждого аксона. Следовательно, аксон оказывается как бы "подвешенным" в складке оболочки шванновской клетки, на дубликатуре оболочки – мезаксоне. В этом случае одна шванновская клетка образует оболочку вокруг одного или нескольких аксонов (рис. 2.17).
Миелинизация в центральной нервной системе
Рис. 2.20. Процессы образования миелиновых оболочек вокруг аксонов в центральной нервной системе менее понятны. Хотя перехваты миелиновой оболочки, подобные перехватам Ранвье периферических нервных волокон, не столь часто встречаются в центральной нервной системе, их со всей отчетливостью показал Питерс <...> в зрительном нерве (это не нерв в обычном понимании, а периферическое "продолжение" головного мозга), а также повсеместно в ЦНС.

Рис. 2.20. Электронная микрофотография, показывающая прямые связи между клеткой глии и формирующейся миелиновой оболочкой:
В спинном мозге новорожденных происходит активное образование миелиновых оболочек, и в этот период такие связи хорошо видны. Показать их в мозге взрослого пока еще не удалось. Отросток (1) олигодендроцита (2) тянется к миелиновой оболочке, формирующейся вокруг аксона (3). Тот же самый отросток, по на другом уровне показан на вставке. Здесь можно видеть, что плазматическая мембрана глиалъного отростка непосредственно переходит в миелиновую пластину оболочки. Следовательно, оболочка формируется как уложенная в спираль плазматическая мембрана олигодендроцита, которая заканчивается внутренним мезаксоном (показан стрелкой). Наблюдается также связь одного олигодендроцита с двумя миелиновыми оболочками. Видна часть ядра (4) олигодендроцита. В отростке, идущем к миелиновой оболочке, содержатся те же самые цитоплазматические компоненты, что и в теле олигодендроцита. В миелиновой оболочке вокруг аксона (3) можно видеть внутренний мезаксон (показан стрелкой) и наружную петлю (5), типичные для конфигурации миелиновой оболочки. Спинной мозг 5-дневного котенка. Фиксация четырехокисью осмия. Заливка в эпон. Окраска цитратом свинца и уранилацетатом; х 26000. Вставка: х 34500
Миелиновые оболочки в ЦНС также многослойны и образованы отростками клеток глии. Бунге и др. <...> считают, что одна клетка глии способна участвовать в формировании миелиновых оболочек вокруг нескольких соседних аксонов (рис. 2.15 и 2.20). Люз <...> также считает, что центральный миелин образуется отростками клеток глии, прежде всего олигодендроцитов. Эти исследователи наблюдали лишь единичные миелиновые пластины, окружающие аксон на ранних стадиях процесса миелинизации мозга мыши и крысы. Позднее аксон окружает большое число уплощенных глиальных отростков. Цитоплазма клеток глии остается между некоторыми мембранами, окружающими аксон, и количество таких мембран по ходу аксона варьирует. Кроме того, поскольку отростки одной клетки глии могут участвовать в формировании оболочек нескольких расположенных рядом аксонов, очевидно, что для формирования полной многослойной миелиновой оболочки аксона в данном участке необходимо несколько глиальных клеток.
Нейроно-глиальные взаимоотношения
Рис. 2.21, 2.22, 2.23. В прошлом считали, что нейроны независимы от окружающих и поддерживающих их клеток глии. В то же время полагали, что в ЦНС существует обширное межклеточное пространство, заполненное водой, электролитами и другими веществами. Следовательно, предполагалось, что питательные вещества способны выходить из капилляров в это "пространство" и затем поступать в нейроны <...>. Электронно-микроскопические исследования, проведенные многими авторами, показали, что такого "обширного межклеточного пространства" не существует. Единственное "свободное" пространство в ткани мозга – это щели между плазматическими мембранами шириной 100 –200 А<...>. Таким образом, на долю межклеточного пространства приходится около 21 % объема мозга. Все участки паренхимы мозга заполнены нервными клетками, их отростками, клетками глии и элементами сосудистой системы. Наблюдения показывают, что астроциты лежат между капиллярами и нейронами, а также между капиллярами и клетками эпендимы. Возможно, что астроциты могут служить коллекторами воды, которая, как полагали, находится в межклеточном пространстве. Очевидно, что если эта жидкость содержится внутри клеток, то астроциты играют роль некоего вненейронного пространства, способного накапливать воду и растворенные в ней вещества, которые обычно рассматривались как внеклеточные компоненты <...>. Тот факт, что внеклеточный отек наступает редко и что при экспериментальном отеке вода локализуется в глиальных клетках <...>, также свидетельствует о том, что "внеклеточная" вода в ЦНС находится частично в глиальных клетках. Однако в то время как большинство электронных микроскопистов согласны с тем, что внеклеточное "водное пространство" мозга ограничено щелями между плазматическими мембранами шириной 100–200 А, ван Гарревельд <...>, основываясь на данных электронной микроскопии быстро замороженных срезов коры, считает, что в мозге между клетками могут существовать пространства, ширина которых значительно превосходит200 А. Кроме того, электронно-микроскопические исследования, проведенные на той же модели, выявили тесные структурные взаимоотношения между нейронами и глией, показав, что нейроны редко контактируют с кровеносными сосудами и что между этими структурами находятся клетки глии. Клетки глии могут служить связующим звеном между нейроном и капиллярами, обеспечивающими поступление питательных веществ и удаление конечных продуктов обмена, что дополняет обмен, идущий через внеклеточное пространство. Однако использование таких пространств ограничивается, по-видимому, многочисленными "плотными соединениями" между клетками. Кроме того, клетки глии, соединяющие нейроны и капилляры, возможно, способны выполнять несколько более сложные функции, чем пассивный перенос различных веществ <...>.

Рис. 2.21. Электронная микрофотография коры мозга крысы:
Видны взаимоотношения капилляров, клеток глин и нейронов. На вставке показан эндотелий капилляра; при большем увеличении видно, что края эндотелиальпых клеток капилляров мозга перекрывают друг друга (показано стрелками). 1 – ножка астроцита; 2 – базалъная мембрана; 3 – капилляр; 4 – ядро небольшой нервной клетки
Перед обсуждением некоторых иных взаимоотношений нейронов и глии, существующих наряду со структурными связями между этими клетками, необходимо упомянуть о некоторых данных, касающихся процессов синтеза в нервных клетках.
Было показано, что в нервных клетках образуется огромное количество РНК, причем количество это зависит от активности нейрона.

Рис. 2.22. Нейрон, выделенный из ядра Дейтерса кролика:
Клетка помещена в изотопический раствор сахарозы и снята в фазово-контрастном микроскопе; х 320. Клетка слегка подкрашена метиленовым синим, чтобы показать плотность синаптических окончаний, которые видны на поверхности клетки как небольшие темные пуговки

Рис. 2.23. Живые изолированные нейроны Дейтерса и окружавшие их клетки глии:
Слева от каждого нейрона расположена группа клеток глии, которые были отделены от этого нейрона. Объем этой группы соответствует объему нейрона; группы клеток глии слегка уплощены и прижаты к стеклу; х 24
Очевидно, что образование РНК и синтез белка происходят в нейронах таким же образом, как и в других клетках. Так, существует зависимость процессов синтеза белка от ДНК, которая играет роль носителя генетического материала. Хотя у взрослых млекопитающих деление нейронов, сопровождающееся удвоением ДНК, - происходит крайне редко <...>, все же существуют достоверные данные, свидетельствующие об обновлении некоторых пуриновых и пиримидиновых оснований ДНК в нервной клетке <...>. Было отмечено также интенсивное обновление низкомолекулярной РНК.
Синтез нового белка в нервной клетке происходит, по-видимому, так же, как и в других клетках. Аминокислоты активируются ферментами, а необходимая энергия поступает от АТФ. Затем активированные аминокислоты связываются с транспортной РНК с образованием комплекса аминоацил-РНК. Каждая участвующая в этом процессе ферментная система специфична для одной аминокислоты.
Однако в одной из последних работ сообщается о возможности взаимного перекрывания этих систем <...>. Транспортная РНК переносит активированную аминокислоту к матричной, или информационной, РНК, которая передает закодированную информацию о синтезе белка от ядерной ДНК к рибосомной РНК. Итак, существуют по меньшей мере три класса РНК: рибосомная РНК, непосредственно участвующая в синтезе белка, транспортная РНК, которая обладает уникальным свойством связываться с аминокислотами, и, наконец, матричная РНК, роль которой заключается, по-видимому, в передаче рибосомам закодированной информации, касающейся синтеза белка. Согласно большинству опубликованных данных, новый белок синтезируется в нейроне и в других клетках в виде одной полной белковой молекулы, а не посредством добавления друг к другу пептидов и полипептидов. Однако другие данные указывают на то, что различные аминокислоты в белках нервной клетки имеют различные "периоды полураспада", т. е. различные скорости обмена, и могут замещаться в составе белка по отдельности. Следовательно, активированная аминокислота может попросту заместить аминокислоту, уже имеющуюся в белковой молекуле. Независимо от того, как это происходит, несомненно, что существует динамическое состояние белковой молекулы. Интересно отметить, что в нервной клетке, изолированной в критический период развития от обычных для нее стимулов, нарушаются биохимические процессы. Так, в клетках сетчатки новорожденных крольчат при световой депривации содержится очень мало РНК и белка и функции этих клеток нарушаются.
Рис. 2.24. Уже известны некоторые формы нейроно-глиальных взаимоотношений. Так, была показана реакция клеток глии на повреждение мозга (нейронов) <...>. Клетки глии, окружающие нейрон, реагируют на повышение функциональной активности этого нейрона, а также на его раздражение <...>. Эти и некоторые другие наблюдения можно рассматривать как свидетельство того, что клетки глии участвуют по крайней мере в поддержании активности нервной клетки.

Рис. 2.24. Раздражение вестибулярного аппарата по 25 мин в день в течение 7 дней:
На графиках показаны изменения, происходящие одновременно в клетках Дейтерса и окружающих их (олигодендро-) глиалъных клетках в ответ на раздражение вестибулярного аппарата. Количество РНК и белка в клетке выражено в пикограммах. Активность ферментов выражена в микролитрах О210-4 в 1 ч на 1 клетку; I – нейрон; II – глия; А – РНК; Б – белок; В – цитохромоксидаза; Г – сукциноксидаза
Микрохимические методы выявили и некоторые другие стороны взаимоотношений нейронов и клеток глии <...>. Вот некоторые из этих наблюдений: а) на долю глии приходится всего 10% того количества РНК, которое содержится в нейронах (при расчете на сухой вес). Это объясняется, по-видимому, менее интенсивным синтезом и более диффузным распределением РНК в крупных астроцитах с их многочисленными длинными отростками или возможной передачей РНК соседним нейронам; б) раздражение нейронов в течение короткого времени ведет к увеличению содержания в них РНК, белка и активности дыхательных ферментов и к снижению содержания этих компонентов в окружающих клетках глии. Это свидетельствует о возможности обмена между нейронами и клетками глии. Длительное раздражение ведет к снижению содержания РНК как в нейронах, так и в клетках глии; в) при раздражении нейронов активность дыхательных ферментов в них возрастает, а анаэробный гликолиз подавляется; в окружающих же клетках глии отмечается значительное повышение интенсивности анаэробного гликолиза. В то же время в нейронах возрастает эффективность цитохромоксидазной системы. Поскольку утилизация глюкозы в цикле Кребса (аэробный гликолиз) составляет 55%, а путем анаэробного гликолиза – лишь 3%, очевидно, что нейроны при раздражении потребляют большую часть освобождающейся энергии.
Активность АТФазы в клетках глии выше, чем в нейронах. Кроме того, оптимум рН и ионной силы для клеток глии и нейронов различны, что свидетельствует о различиях в их биохимических параметрах. Отмечены также различия в основаниях РНК, содержащихся в клетках глии и нейронах. Так, в нейронах содержится больше гуанина и меньше цитозина, а в соседних с ними клетках глии, наоборот, больше цитозина и меньше гуанина. Существуют также наблюдения над изменениями РНК в клетках глии и нейронах одного из вестибулярных ядер у крыс при обучении животных сложным двигательным актам.
При введении химических соединений, стимулирующих синтез белка, содержание РНК и белка в нейронах возрастает, а в клетках глии падает. В этих условиях в нейронах и клетках глии происходят также прямо противоположные изменения в составе оснований РНК, касающиеся содержания в них гуанина и цитозина.
Дальнейшие исследования показали, что общую массу клеток глии можно разделить на клетки, преимущественно локализованные вокруг капилляров (где обычно больше астроцитов), и клетки, расположенные главным образом вокруг нейронов <...>. Хотя астроцита, по-видимому, имеют связь и с нейронами, и с капиллярами, олигодендроциты как клетки-сателлиты в большей степени связаны с нейронами. Так, среди клеток глии, окружающих нейроны, обнаружено около 90% олигодендроцитов и 10% астроцитов. Капиллярная глия содержит 70% олигодендроцитов и 30% астроцитов. Эти данные были получены с помощью светового микроскопа. Исследования структурных взаимоотношений глии и нейронов с помощью электронного микроскопа показали, что в областях, где преобладают тела олигодендроцитов, находится множество отростков астроцитов, которые в значительном проценте случаев "вклиниваются" между олигодендроцитами и нейронами. Хамбергер <...> изучал влияние вращения кролика в центрифуге на окисление цитохрома с, сукцината, -кетоглутарата и глутамата в телах "нейронной" и "капиллярной" глии одного из вестибулярных ядер (рис. 2.25). Было показано, что под влиянием вращения возникают различия в характере ферментативной активности между этими двумя популяциями глиальных клеток; полученные данные позволили сделать вывод, что нейронная глия находится преимущественно в метаболических взаимоотношениях с нейронами, а капиллярная вместе с эндотелием сосудов, по-видимому, участвует в транспорте веществ между кровью и нервной тканью. Какова связь этих двух типов взаимоотношений с типами клеток глии – сказать трудно. Вполне возможно, что функция астроцитов главным образом транспортная, а олигодендроглия в большей степени связана с механизмами синтеза.

Рис. 2.25. Влияние раздражения вестибулярного аппарата на биохимические параметры:
А – активность цитохромоксидазы; Б – окисление а-кетоглутарата; I – нейроны; II – "нейронная " глия; III – "капиллярная " глия
Представленные выше данные и предположения никак нельзя считать окончательными доказательствами наличия своеобразных метаболических взаимоотношений между нейронами и глией. Вместе с тем вполне возможно, что существуют какие-то важные связи между нейронами и глией, которые освобождают нейрон от необходимости быть полностью самостоятельной метаболической единицей, целиком обеспечивающей поддержание своей структуры. Полученные к настоящему времени данные о метаболических взаимоотношениях нейронов и глии наиболее убедительны в отношении синтеза белка и нуклеиновых кислот.
Сходную ситуацию мы находим и у клеток чувствительных узлов. Давно было показано, что эти клетки окружены перисоматическими клетками-сателлитами и наружной капсулой, состоящей из соединительнотканных элементов. Однако лишь недавно было выяснено, в катан степени клетки-сателлиты "окутывают" нейроны чувствительных узлов. Оказалось, что эти клетки образуют сплошную, непрерывную оболочку вокруг сенсорных нейронов, которая вплетается между ними и капиллярами. Следовательно, такая "периферическая глия" находится в тех же самых отношениях с нейронами чувствительных узлов, как и олигодендроциты и астроциты с нейронами ЦНС. Клетки-сателлиты аксона образуют слоистую структуру и окружают отдельные сегменты нервного волокна, формируя его трубчатую оболочку. Эти клетки образуют вокруг аксона различное количество спиральных витков и контактируют друг с другом аналогично тому, как шванновские клетки формируют миелиновую оболочку аксона. И действительно, Паннезе <...> считает, что перисоматические и периаксонные клетки-сателлиты и шванновские клетки не являются, по всей вероятности, различными типами клеток, а отличаются лишь морфологическими признаками, зависящими от их локализации. Возможно, что это связано с их общим происхождением из нервного гребня.
Пиноцитоз в нервной ткани
Явление пиноцитоза впервые описал Льюис <...> в 1931 г. Сам термин "пиноцитоз", образованный из двух греческих слов "пить" и "клетка", был использован для обозначения процесса, наблюдавшегося в культуре ткани, в ходе которого листки ундулирующих мембран захватывали жидкость, что вело к образованию вакуолей, мигрировавших в цитоплазму. Пиноцитозную активность наблюдали in vitro у астроцитов <...>, а также у клеток олигодендроглии и микроглии <...>. Дальнейшие исследования также показали, что глия в культуре ткани захватывает белковые вещества. Не удалось, однако, получить доказательств того, что клетки межпозвоночных узлов в культуре ткани способны к пиноцитозу белков или жидкости. Кроме того, еще нет прямых доказательств существования механизмов пиноцитоза в живом неповрежденном мозге. Тем не менее данные, полученные на культуре ткани, убедительно свидетельствуют в пользу существования активного пиноцитоза у нормальных глиальных элементов, поддерживающих нервные клетки. Предположение о том, что в переносе веществ из крови к нейронам через клетки глии наряду с биохимическими транспортными механизмами участвует также пиноцитоз воды и растворенных в ней соединений, вызвало значительный интерес. Наблюдения, показывающие, что пиноцитоз свойствен только клеткам глии, служат дальнейшим подтверждением концепции, утверждающей, что глия играет очень важную роль в поддержании метаболизма нервных клеток.
Дегенерация нейронов
Повреждение периферических нервных волокон – одна из насущных проблем современной медицинской практики. Многочисленные несчастные случаи на производстве и транспорте сопровождаются повреждением периферических нервов. В результате размозжения и разрывов в нервных волокнах возникают разнообразные патологические изменения. Как показывают различные исследования <...>, скорость дегенерации нервных волокон зависит от их размеров и степени миелинизации; при этом толстые миелинизированные волокна перерождаются быстрее безмякотных <...>.
Изменения дистальных участков волокна (уоллеровская дегенерация)
Рис. 2.26, 2.27 и 2.28. После разрыва нервного волокна его дистальная часть подвергается полной дегенерации. В участке аксона, расположенном проксимальное места повреждения, наблюдаются ретроградные изменения, которые распространяются в центральном направлении на расстояние 2 – 3 см. Дальнейшие дегенеративные изменения аксона незначительны, если место его повреждения не находится слишком близко к телу клетки. Резкие дегенеративные изменения развиваются в волокнах незрелых нервных клеток у новорожденных животных <...>. Такие не полностью созревшие клетки могут погибнуть после повреждения аксона. Периферический участок волокна в первые 3– 5 дней после перерезки еще отвечает на химическое или электрическое раздражение. Однако, несмотря на такую сохранность некоторых физиологических функций, в аксоне уже через 12 ч после повреждения развиваются изменения, которые предвещают его окончательную дегенерацию: в течение короткого времени наступает гипертрофия нейрофибрилл и отек осевого цилиндра <...>.

Рис. 2.26. Термины, применяемые для "пространственного" обозначения процессов дегенерации клеток и волокон

Рис. 2.27. Два дегенерирующих аксонных окончания в латеральном коленчатом теле обезьяны на 5-й день после удаления глаза:
В окончаниях видна обширная сеть нейрофиламентов (1), которые оттеснили синаптические пузырьки в сторону; в левом окончании пузырьки находятся вблизи синаптического утолщения (2); 3 – дендрит; 4 – синаптические пузырьки

Рис. 2.28. Дегенерация аксонов:
А – дегенерирующее окончание через 5 дней после операции; обратите внимание на аксон (1); Б – в дегенерирующем окончании видно кольцо нейрофиламентов, сходное с теми нейрофибриллярными колечками, которые можно обнаружить с помощью светового микроскопа; 2 – нейрофиламенты; 3 – синаптические пузырьки; 4 – синаптические утолщения
Ли <...> наблюдал острый отек митохондрий и эндоплазматической сети в аксоне через 19 ч после его перерезки. В конечном итоге эндоплазматическая сеть распадается на фрагменты неправильной формы, нейрофибриллы склеиваются, в аксоне увеличивается число митохондрий и плотных телец. За счет чего увеличивается число митохондрий в периферическом участке перерезанного нерва, объяснить трудно. Поскольку первые признаки распада аксона на фрагменты появляются уже на 2-й день после его перерезки, а ответы волокна на раздражение сохраняются иногда до 5 дней, возникает вопрос о возможном участии шванновских клеток в проведении импульсов.
Спустя 12–19 ч после перерезки волокна происходит разрыхление пластин миелина. Еще более четко эти изменения миелина проявляются через 24 ч. Помимо этого, проксимальнее места перерезки миелиновая оболочка образует сложные складки и в ней увеличивается число насечек Шмидта–Лантермана, что происходит в результате расщепления пластин миелиновой оболочки вдоль промежуточных плотных линий. Такое наблюдение не противоречит данным Робертсона, который считает насечки Шмидта – Лантермана артефактом гистологической обработки, так как физиологическое состояние дистального и проксимального участков перерезанногонерва неодинаково и покрывающая их миелиновая оболочка может по-разному реагировать на процесс фиксации. О различном механизме образования насечек Шмидта – Лантермана в дегенерирующем и нормальном нерве свидетельствует то, что в нормальном нерве насечки являются результатом расщепления миелина вдоль главной плотной линии, а не вдоль промежуточной. Изменения в наружной (поверхностной) части шванновских клеток начинаются позднее и протекают медленнее, чем в миелиновой оболочке, образованной мембранами шванновской клетки, и в аксоне. Шванновские клетки, расположенные вокруг дегенерирующих волокон, содержат больше цитоплазмы, чем в норме. В их цитоплазме встречаются вакуоли и многочисленные гранулы диаметром около 100А. Объем цитоплазмы шванновских клеток нарастает в первые 3–4 дня после перерезки нервного волокна, а затем к 6–8-му дню уменьшается.
Клетки, образующие миелиновую оболочку, становятся при дегенерации аксона сильно метахроматическими (метахромазия – это такое состояние клеток, при котором изменяются тинкториальные свойства); хроматин их ядер окрашивается интенсивно. Увеличение числа цитоплазматических органелл становится заметным у шванновских клеток миелинизированных и немиелинизированных волокон в течение первых двух суток. Примерно на 4-й день эти клетки начинают митотически делиться и образуют полосу многоядерного синцития, которая располагается в эндоневральной трубке, на месте поврежденного нервного волокна. По-видимому, коллагеновые волокна эндоневральных трубок частично образуются шванновскими клетками. Возможно, что этот синцитиальный тяж образует "контактный направляющий" путь, по которому должны расти регенерирующие нервные волокна и который сольется с таким же тяжем пролиферирующих шванновских клеток, начинающимся от проксимального конца перерезанного нервного волокна.
Аксоплазма дегенерирующего волокна местами отделяется от миелиновой оболочки и сокращается. Эта аксоплазма содержит зернистые или волокнистые включения, лежащие на фоне светлого матрикса иногда вместе с митохондриями, плотными частицами и пузырьками. На 7– 12-й день после перерезки волокна аксоплазматические органеллы миелинизированных волокон постепенно исчезают, оставляя внутри миелиновой оболочки промежутки разных размеров. У крысы такие аксоплазматические органеллы полностью не исчезают до 28-го дня, когда все еще сохраняется некоторое число плотных частиц. К 35-му дню аксон дегенерирует полностью, и на его месте обнаруживаются лишь частицы свободного или фагоцитированного миелина <...>. В то время, когда происходят описанные изменения аксона, миелин в целом также подвергается дальнейшим дегенеративным изменениям, образует в первые 2–3 дня каплевидные вздутия и в дальнейшем распадается на отдельные глыбки. Процесс распада миелина в той или иной мере завершается в течение двух недель. Шванновские клетки приобретают способность фагоцитировать образованные ими распавшиеся миелиновые мембраны. Процесс фагоцитоза миелина протекает в течение 2-й и 3-й недель после перерезки волокна. Шванновские клетки обладают способностью "переваривать" фагоцитированный миелин; процесс этот протекает очень медленно: липопротеидные фрагменты удается обнаружить в клетках спустя три месяца после перерезки нервного волокна. В фагоцитозе распавшегося миелина, очевидно, участвуют также и макрофаги соединительной ткани.
Новые нейрофибриллы появляются из проксимального ствола нервного волокна спустя 7 дней после раздавливания нерва или через 14 дней после его перерезки. Вначале они имеют вид небольших аксоплазматических выростов диаметром 0,5 мкм, а к 8-й неделе приобретают вид немиелинизированных нервных волокон, лежащих внутри шванновских клеток, что в определенном смысле можно считать первой фазой миелинизации. Полная ремиелинизация наступает вслед за увеличением размеров регенерирующих волокон по достижении ими своих структур-мишеней и может оставаться незавершенной даже в течение года.
Приведенное выше описание представляет собой попытку связать воедино результаты, полученные рядом исследователей, наблюдения которых не во всем согласуются. Следовательно, мы еще не располагаем окончательными данными о тех изменениях, которые происходят в дегенерирующем периферическом нерве. Наиболее спорным остается вопрос о роли шванновских клеток в процессе дегенерации. Ли <...>, исходя из своих наблюдений, считает, что шванновские клетки обладают фагоцитарной активностью, но не способны к митотическому делению. Он не упоминает о синцитиальном тяже, описанном Бартоном <...>.

Рис. 2.29. Поперечный срез шванновской клетки при метахроматической лейкодистрофии; х 38000 <...>
Видны несколько пластин миелина, местами разделенных узкими участками цитоплазмы шванновской клетки. Эти пластины продолжаются в наружный и внутренний мезаксоны и образуют вокруг аксона простую спираль
Ретроградная дегенерация
Дегенеративные изменения в проксимальном участке поврежденного нервного волокна довольно сходны с теми, которые наблюдаются в его дистальном участке, но они в зависимости от протяженности и характера повреждения нерва могут ограничиваться несколькими сантиметрами его длины. В ходе этих изменений происходит отек аксонов, увеличение объема содержащейся в них аксоплазмы и числа нейрофибрилл (рис. 2.30). Увеличивается объем цитоплазмы шванновских клеток, которые в месте повреждения пролиферируют и образуют синцитиальный тяж, идущий в направлении аналогичного тяжа дистального ствола перерезанного нерва. При световой микроскопии определяются четко видные утолщения и распад миелиновой оболочки на фрагменты, которые в дальнейшем фагоцитируются шванновскими клетками или тканевыми макрофагами. При электронно-микроскопическом исследовании миелиновой оболочки несколько проксимальнее места перерезки (но не раздавливания) нерва можно видеть увеличение числа насечек Шмидта – Лантермана. Тот факт, что в дистальном отделе поврежденного нерва, где развиваются более тяжелые изменения шванновских клеток, число этих насечек не увеличивается, показывает, что для формирования этих дополнительных щелей между пластинами необходимы "нормальные" шванновские клетки.

Рис. 2.30. Поперечный срез миелинизированного волокна при метахроматической лейкодистрофии; х 29000:
В циркулярной полоске плотно упакованных миелиновых пластин, прилежащей к аксону, наблюдается общее увеличение плотности и уменьшение периодов между плотными линиями примерно до 100 А. Промежутки между пластинами, лежащими кнаружи от этой полосы, слегка увеличиваются (130–140 А), и между ними видны два небольших включения цитоплазмы шванновской клетки
Изменения в телах нейронов после перерезки нерва
Перерезка нерва почти немедленно вызывает изменения в нейронах, которые часто трактовали как реакцию, связанную с попыткой клетки восстановить свой периферический отросток. При этом происходит резкое увеличение объема клетки и хроматолиз базофильных веществ. Отчасти такой хроматолиз можно связать с дисперсией базофильного вещества в резко отечной клетке, а не с подлинным растворением нуклеиновых кислот. В течение первых 4–6 дней ядро смещается к периферии тела клетки. В опытах с перерезкой лицевого нерва кошки на уровне шило-сосцевидного отверстия было показано, что у животных в возрасте 15 дней и старше большинство клеток в ядре сохраняется. Следовательно, хроматолиз и увеличение клетки и ее ядра у таких животных служат, по-видимому, нормальной физиологической реакцией, направленной на синтез новых веществ, необходимых для роста аксона. Исследования Хидена <...>, а также Роде и Форда <...> показали, что при перерезке XII пары черепномозговых нервов вначале происходит заметное увеличение клетки. При этом концентрация белка и РНК резко снижается, хотя количество РНК в клетке уменьшается лишь незначительно. Следовательно, хроматолиз вещества Ниссля в фазе цитоплазматического отека не просто указывает на утрату комплекса РНК-Б, а свидетельствует о его перераспределении в большем объеме и, возможно, вне связи с эндоплазматической сетью. Затем количество РНК в клетке быстро возрастает, достигая максимума приблизительно к 40-му дню после перерезки. Концентрация белка в клетке возрастает параллельно увеличению количества РНК. Увеличение количества РНК начинается спустя примерно 8 дней после перерезки нерва, а увеличение общего содержания белка – спустя 1 –2 дня. Таким образом, в перикарионе поврежденного нейрона почти сразу же начинаются процессы, обеспечивающие регенерацию аксона: утилизация части комплекса РНК-Б, образование нового комплекса РНК-Б и синтез белка.
Ранние работы Эйнарсона <...>, посвященные изучению утомления нервных клеток, показали, что при длительном раздражении нейрона истощаются запасы вещества Ниссля. Группа Хидена подтвердила эти данные биогистохимически, обнаружив снижение содержания РНК-Б после длительного раздражения нервных клеток. В последующих регенеративных фазах базофильные вещества (РНК и простой белок) появлялись сначала вокруг ядрышка, а затем мигрировали к ядерной мембране, проходили через нее и в конечном итоге обнаруживались в цитоплазме в виде околоядерного скопления, которое в последующем приобретало форму частиц вещества Ниссля. Опыты по регенерации лицевого нерва показали, что через 14 дней после перерезки нерва 14С-лизин располагается вблизи ядра. Поскольку РНК нейронов и других клеток связана с процессом белкового синтеза, локализация меченой аминокислоты в той же области, где была обнаружена новосинтезированная РНК, свидетельствует о том, что лизин был включен в белки нервных клеток.
Максимальный рост тела нейрона наблюдается примерно через месяц после повреждения нерва. В это время количество РНК, белка и липидов в теле нейрона более чем вдвое превышает их количество в нормальном нейроне. Возврат к нормальному уровню содержания этих веществ в клетке происходит примерно через90 дней после повреждения нерва. Окончательное созревание регенерирующего нейрона зависит от того, восстановится ли связь с "мишенью". По подсчетам Кахала, скорость роста нервного волокна в раневом рубце составляет примерно 0,25 мм в день. Однако, если волокно растет в синцитиальном тяже, образованном шванновскими клетками, эта скорость может увеличиваться до 4,84 мм в день, так что скорость, равную 3–4 мм, в этом случае можно считать вполне нормальной. Вырастающие волокна, которые можно видеть на 7-й день после раздавливания в проксимальном стволе мислинизированного нерва и на 14-й день в стволе немиелинизированного, вначале лишены миелиновой оболочки. Путь, по которому растет регенерирующий аксон, выбирается главным образом случайно. Так, двигательные волокна могут с успехом врастать в неврилемму чувствительного волокна и наоборот. Следовательно, в денервированную мышцу заново врастает значительно меньше двигательных волокон, чем их было до повреждения. Однако потеря функции при этом не пропорциональна уменьшению числа волокон, поскольку было обнаружено, что лежащие рядом неповрежденные нейроны образуют коллатерали, которые врастают в синцитиальный тяж из старых оболочек и участвуют в иннервации мышцы. Возможно, позднее восстановление двигательных функций после полиомиелита отчасти объясняется описанным выше явлением.
