
- •Комплексні сполуки
- •Алкаметрія Ацидіментрія
- •Кослотно-основна рівновага в організмі. Водневий показние біологічних рідин.
- •13. Кислотно-основні індикатори — це речовини, які змінюють забарвлення в залежності від pH речовину.
- •Буферні системи. Буфера ємкість
- •Колігативні властивості розчинів. Осмос. Кріометрія.
Буферні системи. Буфера ємкість
16. Буферними називають системи, які достатньо стійко зберігають
величину рН під час додавання невеликої кількості сильної кислоти або
лугу, а також під час розведення(або концентрування).
17.Існує два типи буферних систем:
а) кислотні - складаються із слабкої кислоти та її солі, утвореної
сильною основою. Наприклад, ацетатний буфер: СН3СООН + СН3COONa.
б) оснóвні - складаються із слабкої основи та її солі, утвореної
сильною кислотою. Наприклад, аміачний буфер: NH4OH + NH4Cl.
19.Основні рівняння буферних систем
кислотний тип оснóвний тип
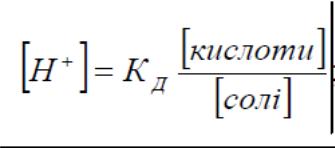
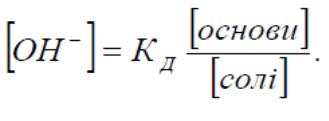
Рівняння Гендерсона – Гассельбаха
кислотний тип оснóвний тип
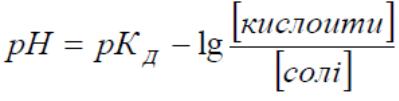
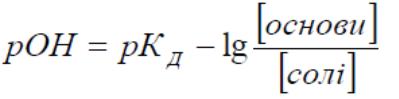
![]()
21. Буферна ємкість – це число моль еквівалентів сильної кислоти або
сильної основи, яку потрібно додати до 1л буферної системи, щоб
змістити рН на 1.
Буферну ємкість визначають титруванням.

Буферна ємність залежить від співвідношення компонентів та їх концентрації.
Практичне визначення буферної ємкості за кислотою, або лугум:
????
20.Серед кислотних буферних систем найбільше значення в організмі мають слідуючі: Гідрокарбонатна: Н2СО3 + NaHCO3
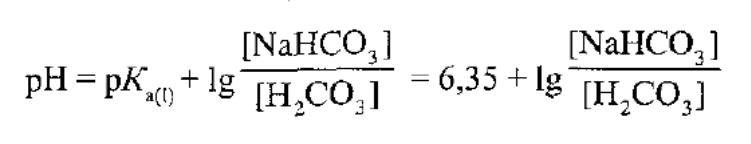
Хімічну рівновану між кислотою і сіллю у цій буферній системі визначають за рівнянням:
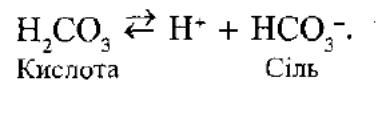
Співвідношення компонентів буферу : 20:1 Ацетатна: СН3СООН + СН3СООNa
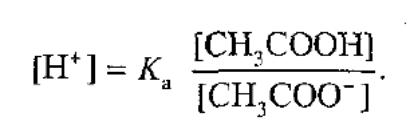
Механізм буферної дії ацетатного буферного розчину на основі теорії електролітичної дисоціації пояснюється так:
За рахунок часткової дисоціації кислоти і повної дисоціацаї солі в розчині будуть знаходитись одночасно йони СН3СОО- ,Na+, Н+
Якщо до нього добавити сильної кислоти, то йони гідрогену реагуватимуть а аніонами солі, утворюючи слабку ацетатну кислоту.
При добавлянні до цієї буферної суміші розчинулугу гідроксид-іони взаємодіятимуть з йонами Н+ ацетатної кислоти з утворенням малодисоційованих молекул води.. Фосфатна: NaH2PO4 + Na2HPO4 Значення фосфотного буферуобчислюють за рівнянням:
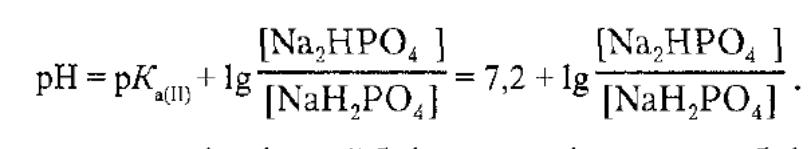
Співвідношення компонентів буферу 4:1
Білкова: білок-кислота + білок-сіль, Механізм буферної дії цієї системи пояснюється наявністю в молекулах білків залишків амінокислот, які виявляють амфотерні властивості.
Гемоглобінова:
![]()
Механізм дії :
Вуглекислий газ, що потрапляє в еритроцити, під дією ферменту карбоангідрашвидко перетворюється на карбонатну кислоту. Проте значна частина кислоти дисоціює на йони Н+ і НСО3- , що може призвести до зниження рН крові, а за підвищенної її кислотності зменшується ефективність зв»язування кисню гемоглобіном. Тому оксигемоглобін віддає кисень і перетворюється на гемоглобін, який належить до слабкіших кислот, ніж оксигемоглобін.Внаслідок цих процесів концентрація гемоглобіну, йонів Н+ і НСО3 збільшується, а йонів Нbо2- зменшиється.
а серед основних Амонійна: NH4OH + NH4CI .
При розведенні чи концентруванні буферних розчинів, буферна дія зберігається, змінюється лише буферна ємність: при розведенні вона зменшується, при концентруванні– збільшується.
23
Лужний резерв крові це- показник функціональних можливостей буферної системи крові; являє собою кількість двоокису вуглецю (в мол), яке може бути зв`язано 100 мл плазми крові,
Органи, що підтримують кислотно – лужну рівновагу:
Легені, нирки, шлунково-кишковий тракт, кров
