
- •Тема 3. Ферменты. Лекция 2.
- •Кофакторы
- •Механизм действия ферментов
- •Классификация ферментов
- •3.4. Ферменты, действующие на пептидные связи.
- •Применение ферментных препаратов
- •Иммобилизованные ферменты
- •Наиболее распространенным вариантом иммобилизации является связывание ферментов с нерастворимым носителем.
Тема 3. Ферменты. Лекция 2.
Аллостерические ферменты.
Не все ферменты подчиняются кинетике Михаэлиса-Ментен.
Например, большая группа аллостерических ферментов имеет сигмоидную зависимость скорости реакции от концентрации субстрата. (Рис. 1)
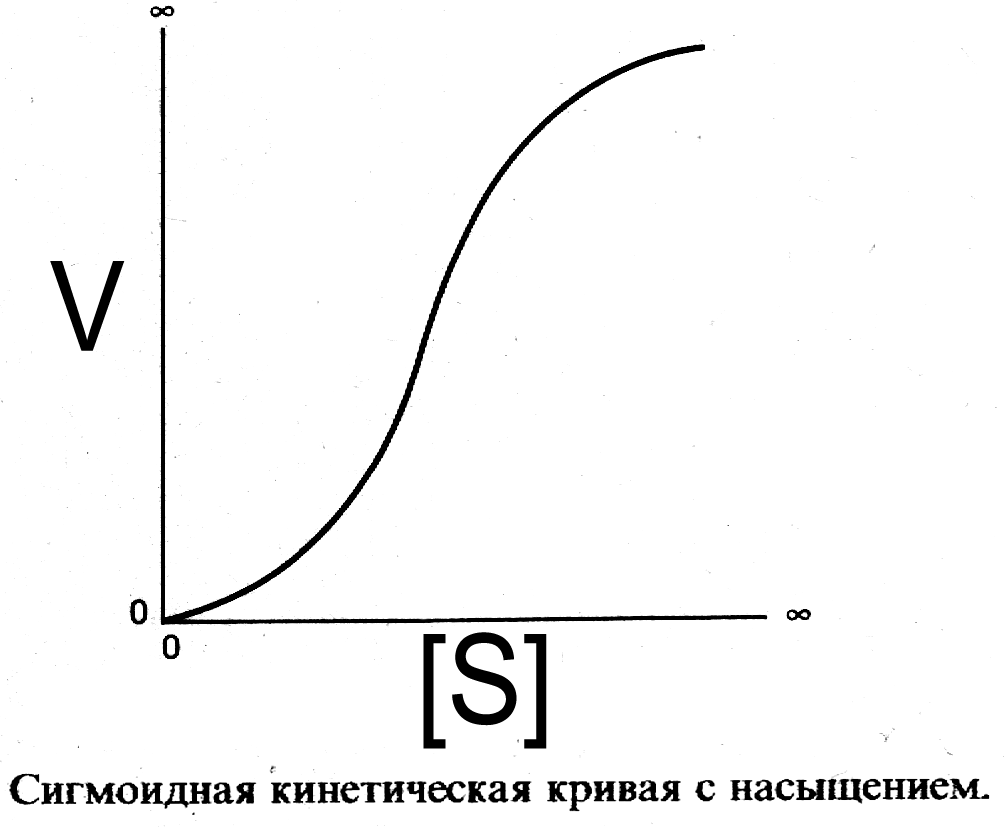
Рис. 1.
Сигмоидная форма зависимости скорости реакции аллостерического фермента от [S] может быть объяснена моделью согласованного механизма кооперативного связывания субстрата.
Рассмотрим эту модель на примере аллостерического фермента, состоящего из 2 идентичных субъединиц. Модель базируется на предположении, что для субъединиц фермента существует 2 возможные конформации – с высоким сродством к субстрату (R-форма) и с низким сродством к субстрату (T-форма). Также постулируется, что для сохранения симметричности димера обе субъединицы должны находиться в одном и том же конформационном состоянии. (Рис . 2)
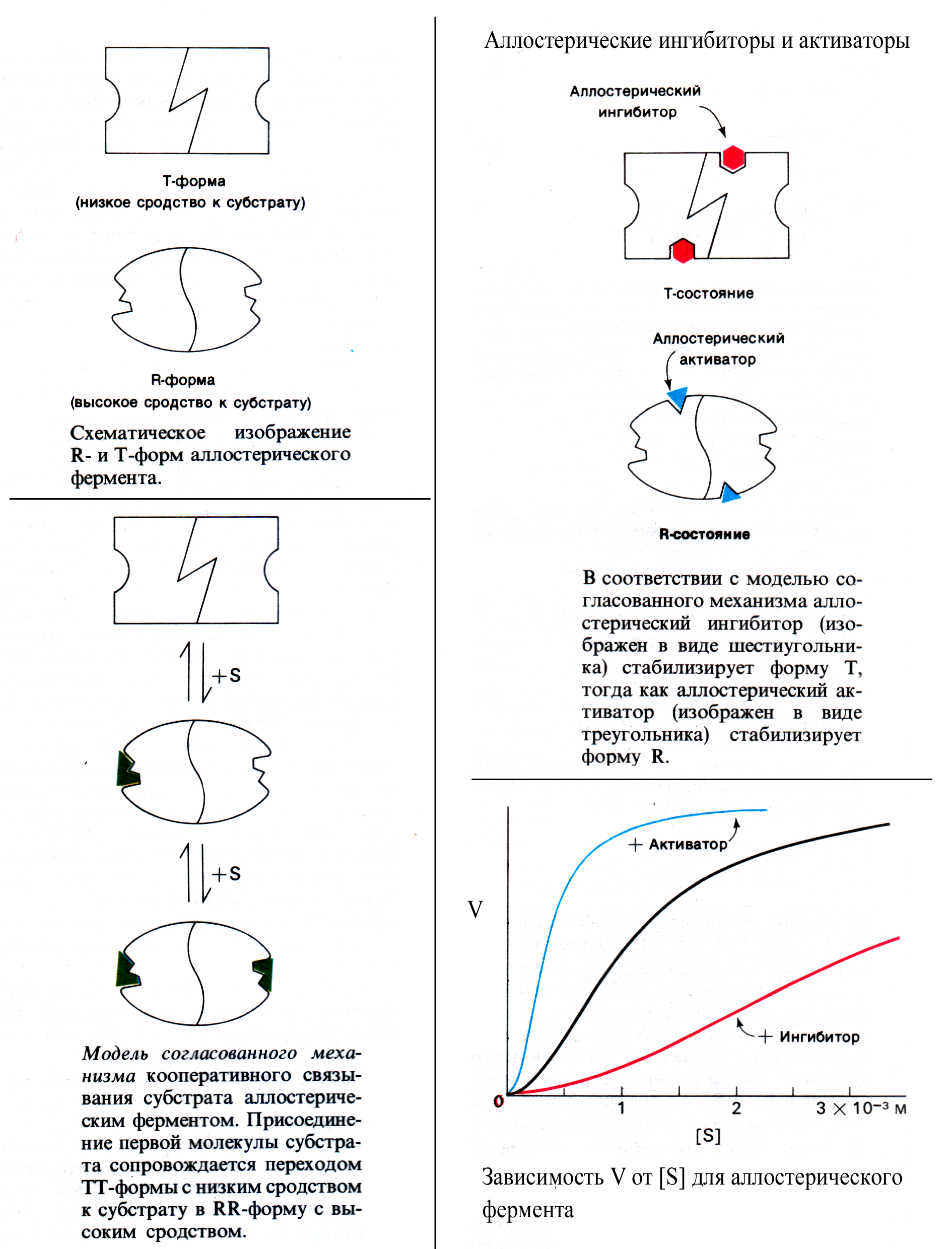
Рис. 2
Существуют и другие модели, объясняющие кинетику аллостерических ферментов. Модель согласованного механизма кооперативного связывания субстрата хорошо объясняет кинетику многих аллостерических ферментов.
Кофакторы
Многие ферменты кроме белковой части включают в свой состав небелковый компонент - кофактор. Кофакторы могут иметь различную природу. Это могут быть неорганические ионы и органические молекулы. Если кофактором является органическая молекула, то она называется коферментом.
Кофермент может быть связан с белковой частью фермента ковалентно или нековалентно.
Если кофермент связан с белком ковалентно, то он называется простетической группой.
Белковая часть таких ферментов называется апоферментом.
Апофермент + кофермент = холофермент (каталитически активный)
Кофермент можно рассматривать как второй субстрат или косубстрат.
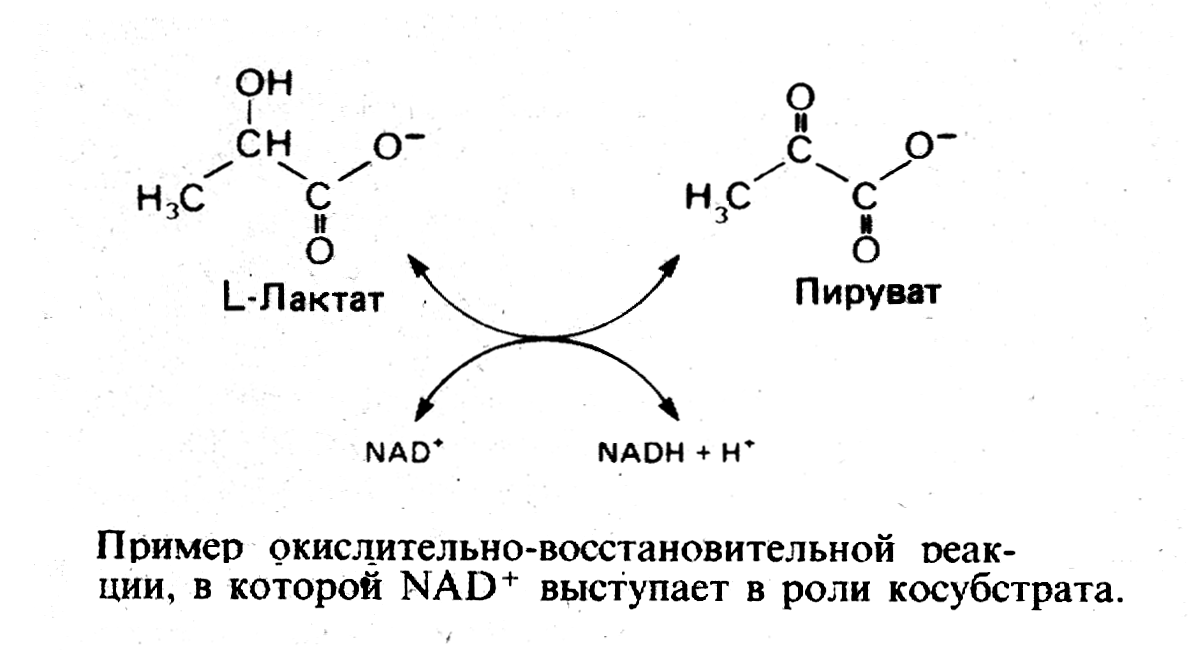
Коферменты участвуют в метаболизме как переносчики различных химических групп (в том числе и водорода).
Например в реакциях переаминирования пиридоскальфосфат выступает как переносчик аминогруппы от одной аминокислоты к другой. NAD+ и NADP+ выступают как переносчики водорода.
Многие витамины выступают в организме в роли коферментов.
Механизм действия ферментов
Снижение свободной энергии реакции.
Теория переходного состояния. Переходное состояние – структура с наиболее высоким уровнем свободной энергии. Фермент снижает энергию переходного состояния за счет сродства к нему.
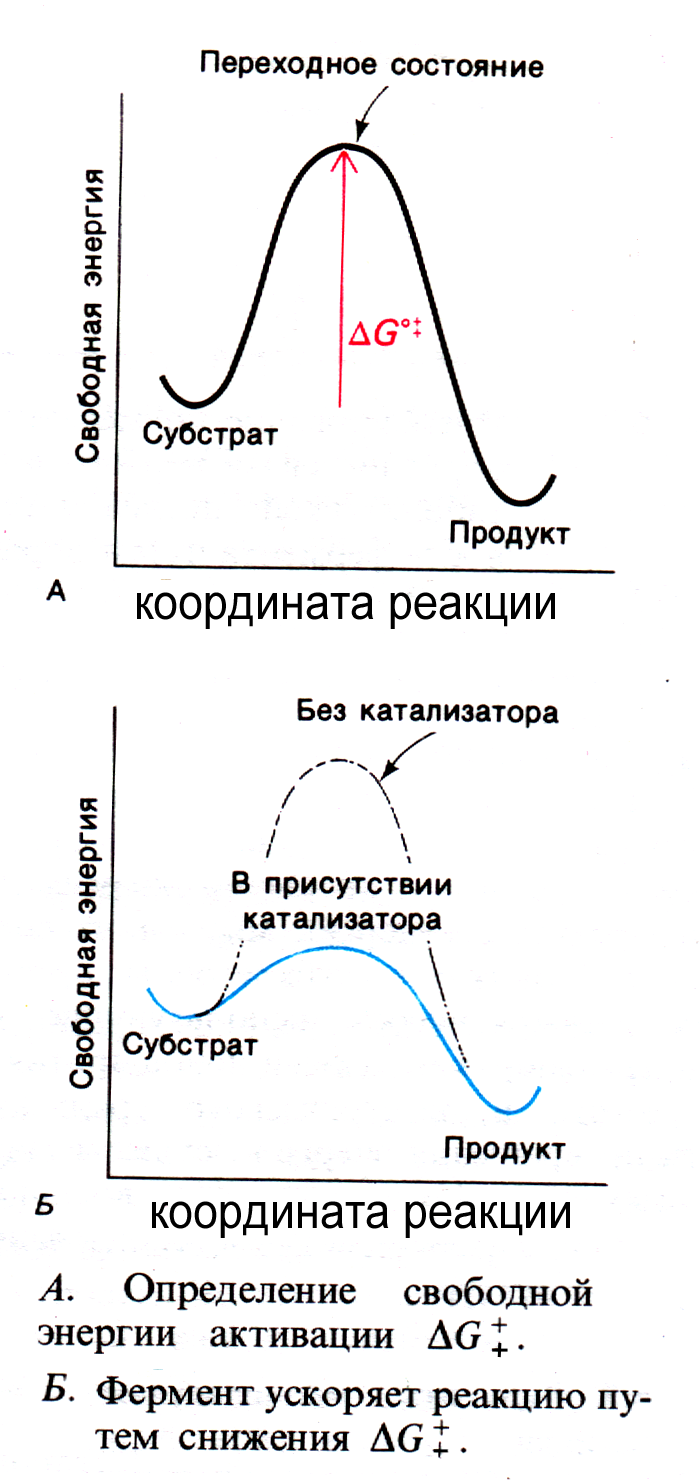
Рис. 3
Факторы, обеспечивающие высокую каталитическую активность ферментов:
Фактор сближения;
Фактор фиксации;
Фактор ориентации;
Классификация ферментов
Номенклатура введенная Международным биохимическим союзом.
Ферменты классифицируют в соответствии с типом реакции, который они катализируют.
Реакции и ферменты, которые их катализируют, подразделяются на 6 классов, в каждом из которых имеется несколько подклассов.
Каждый фермент имеет кодовый номер по классификации ферментов (КФ); первая цифра характеризует класс реакции, вторая — подкласс и третья — подподкласс. Четвертая цифра указывает порядковый номер фермента в его подподклассе. Таким образом, КФ 2.7.1.1 означает, что фермент относится к классу 2 (трансфераза), подклассу 7 (перенос фосфата) и подподклассу 1 (акцептором фосфата является спирт). Последняя цифра обозначает фермент гексокиназу, или АТР: D-гексозо-6-фосфотрансферазу, -т.е. фермент, катализирующий перенос фосфата с АТР на гидроксильную группу атома углерода в шестом положении глюкозы.
Ниже представлены все шесть классов ферментов и некоторые конкретные примеры. В скобках указано рекомендуемое название.
1. Оксидоредуктазы. Ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов, S и S':
Sвосст + S’окисл = Sокисл + S’восст
Катализируют реакции, в которых участвуют такие группы, как СН—ОН, СН—СН, С = О, СН— NH2, и —СН—NH—. Некоторые подклассы:
1.1. Ферменты, действующие на группу СН— ОН (донор электронов). Например:
1.1.1.1. Алкоголь: NAD+ оксидоредуктаза [алкогольдегидрогеназа]
Спирт + NAD+ = Альдегид или кетон + NADH + H+.
1.4. Ферменты, действующие на группу СН—NH2 (донор электронов). Например:
1.4.1.3. L-Глутамат: NAD(P)+ оксидоредуктаза (дезаминирующая) [глутаматдегидрогеназа из печени животных]. Запись NAD(P)+ означает, что акцептором электронов может служить либо NAD+, либо NADP+.
L-Глутамат + Н,О + NAD(P)+ = а-Кетоглутарат + NH+4 + NAD(P)H + Н+.
2. Трансферазы. Ферменты, катализирующие перенос группы G (отличной от атома водорода) с субстрата S на субстрат S':
S—G + S' = S'—G + S.
Катализируют перенос одноуглеродных групп, альдегидных или
кетонных остатков, а также ацильных,
алкильных, гликозильных групп и групп, содержащих фосфор и серу.
Некоторые подклассы:
2.3. Ацилтрансферазы. Например:
2.3.1.6. Ацетил-СоА:холин О-ацетилтрансфераза [холин-ацетилтрансфераза]
Ацетил-СоА + Холин = СоА + О-Ацетилхолин.
2.7. Ферменты, катализирующие перенос группы, содержащей фосфор. Например:
2.7.1.1. АТР: D-гексоза 6-фосфотрансфераза [гексокиназа]
АТР + D-Гексоза = ADP + D-Гексозо-б-фосфат.
3. Гидролазы. Ферменты, катализирующие гидролиз эфирных, сложноэфирных, пептидных и гликозильных связей, кислотных ангидридов, связей С— С, С-галоида и Р—N. Например:
3.1. Ферменты, действующие на сложноэфирные связи. Например:
3.1.1.8. Ацилхолин — ацилгидролаза [псевдохолинэстераза]
Ацилхолин + Н2О = Холин + Кислота.
3.2. Ферменты, действующие на гликозилъные соединения. Например:
3.2.1.23. -D-Галактозид — галактогидролаза [(-галактозидаза]
-D-Галактозид + Н2О = Спирт + D-Галактоза.
