
- •Молекулярная физика и термодинамика
- •Лабораторная работа 2–1 определение коэффициента поверхностного натяжения жидкости
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–2 определение вязкости жидкости методом стокса
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–3 определение отношения для воздуха
- •Краткая теория
- •Описание лабораторной установки
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–4 определение удельной теплоёмкости воздуха при постоянном давлении методом протока
- •Краткая теория
- •Описание лабораторного модуля установки
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–5 определение коэффициента теплопроводности воздуха методом нагретой нити
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–6
- •Краткая теория
- •Описание установки
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–7 определение удельной теплоты плавления и изменения энтропии олова
- •Краткая теория
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа 2–8 изучение распределения термоэлектронов по энергиям, определение эффективной температуры электронного пучка
- •Краткая теория
- •Описание установки
- •Порядок выполнения лабораторной работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Библиографический список
Контрольные вопросы
Межмолекулярное взаимодействие в реальных газах.
Уравнение Ван-дер-Ваальса. Физический смысл поправок на давление и обьём.
Эффект Джоуля–Томсона. Его качественное объяснение.
Экспериментальная установка. Порядок выполнения работы.
Обработка результатов измерений, их сравнение с теоретическими данными.
Лабораторная работа 2–7 определение удельной теплоты плавления и изменения энтропии олова
Цель работы: определение удельной теплоты плавления олова и изменения энтропии в процессе его кристаллизации.
Приборы и принадлежности: лабораторная установка, секундомер (часы).
Краткая теория
Известно,
что у кристаллических тел как плавление,
так и кристаллизация происходят при
одной и той же постоянной температуре
Tк.
При этом для плавления тела массы
![]() ему необходимо сообщить количество
теплоты:
ему необходимо сообщить количество
теплоты:
![]() .
.
Параметр λn называется удельной теплотой плавления.
При
обратном процессе кристаллизации тело
отдаёт в окружающую среду такое же
количество тепла, что равносильно
получению им отрицательного количества
теплоты:
![]()
Энтропией называют функцию состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты, сообщённой системе, к температуре последней:
![]() .
(1)
.
(1)
Энтропия служит мерой вероятности осуществления какого-либо макроскопического состояния. Чем большим количеством способов может быть реализовано данное состояние, тем больше энтропия.
Для
нахождения удельной теплоты плавления
олова λn
и изменения энтропии
![]() в процессе кристаллизации в данной
лабораторной работе используется
зависимость температуры олова,
находящегося в специальной ампуле, от
времени его охлаждения
в процессе кристаллизации в данной
лабораторной работе используется
зависимость температуры олова,
находящегося в специальной ампуле, от
времени его охлаждения
![]() .
.
Простейшей моделью охлаждения тела является его охлаждение в среде с постоянной температурой Tс, когда внутри тела, в течение всего процесса охлаждения, температура в любой точке тела одинакова в любой момент времени. Такой процесс состоит из непрерывно следующих друг за другом равновесных состояний и, следовательно, является обратимым.
Применяя к процессу кристаллизации олова закон сохранения энергии, можно записать уравнение:
![]() (2)
(2)
где
![]() количество
теплоты, полученное оловом (отданное
им) за время его кристаллизации (
количество
теплоты, полученное оловом (отданное
им) за время его кристаллизации (![]() – масса олова);
– масса олова);
![]() количество
теплоты, полученное окружающей средой
через поверхность ампулы
количество
теплоты, полученное окружающей средой
через поверхность ампулы
![]() за время кристаллизации
за время кристаллизации ![]() (
(![]() коэффициент теплопередачи с поверхности
ампулы в окружающую среду; эта величина
считается постоянной).
коэффициент теплопередачи с поверхности
ампулы в окружающую среду; эта величина
считается постоянной).
Закон
сохранения энергии, записанный для
процесса охлаждения твёрдого олова
после кристаллизации имеет вид:
34
![]() , (3)
, (3)
где
![]() – количество теплоты, полученное
(отданное:
– количество теплоты, полученное
(отданное:
![]() )
ампулой с оловом при ее охлаждении за
время
)
ампулой с оловом при ее охлаждении за
время
![]() (
(![]() – удельные теплоемкости олова и материала
ампулы;
– удельные теплоемкости олова и материала
ампулы;
![]() – масса олова и ампулы соответственно).
Величина
– масса олова и ампулы соответственно).
Величина
![]() –
количество теплоты, полученное окружающей
средой через поверхность ампулы
за время
(
температура
твердого олова в данный момент времени;
–
количество теплоты, полученное окружающей
средой через поверхность ампулы
за время
(
температура
твердого олова в данный момент времени;
![]() –
температура окружающей среды).
–
температура окружающей среды).
Из уравнений (2) и (3) следует:
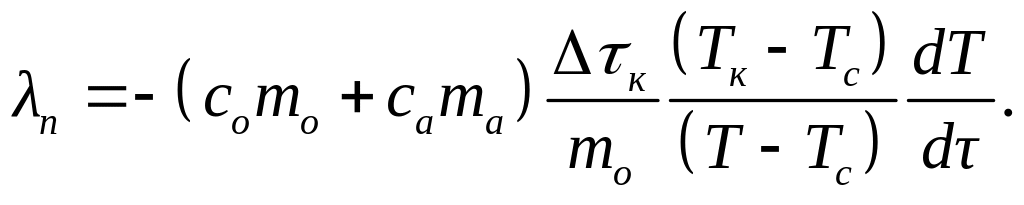 (4)
(4)
Изменение энтропии при кристаллизации олова согласно (1) можно найти по формуле:
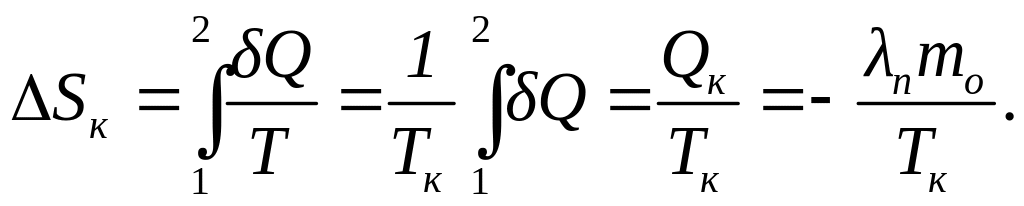 (5)
(5)
Когда
известна зависимость температуры
кристаллизующегося и остывающего олова
от времени, её типичный вид представлен
на рис. 1, для определения удельной
теплоты плавления олова
![]() и изменения энтропии
при его кристаллизации достаточно
измерить
и изменения энтропии
при его кристаллизации достаточно
измерить
![]() и найти значение производной функции
и найти значение производной функции
![]() по времени в произвольной точке,
соответствующей температуре твердого
олова
по времени в произвольной точке,
соответствующей температуре твердого
олова
![]() в процессе его охлаждения. Все эти
величины можно определить по графику,
построенному по экспериментальным
точкам (см. рис. 1).
в процессе его охлаждения. Все эти
величины можно определить по графику,
построенному по экспериментальным
точкам (см. рис. 1).
К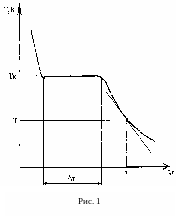 онструктивно
лабораторная установка состоит из двух
отдельных модулей − лабораторного
(рис. 2 и 3) и приборного.
онструктивно
лабораторная установка состоит из двух
отдельных модулей − лабораторного
(рис. 2 и 3) и приборного.
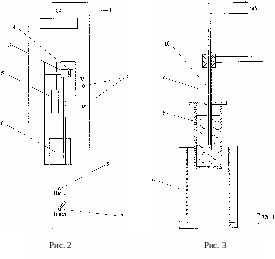
На передней панели лабораторного модуля расположены: крепёжный винт 1, табличка с названием работы, гнёзда 2 для подключения милливольтметра приборного модуля, устройство подъема 3 ампулы с оловом 5 из электрической печи 6, тумблер включения электропитания печи 7, сигнальная лампа включения электропитания 8 и сетевой шнур.
Ампула 5 с оловом (рис. 3) нагревается в электрической печи 6, питающейся переменным током. Для определения температуры олова внутри ампулы находится металлическая трубка-чехол 9 с дифференциальной хромель-копелевой термопарой 10, горячий спай которой находится в ампуле, а холодный − на воздухе. Концы термопары через гнёзда и медные провода соединяются с милливольтметром приборного модуля, измеряющим термоЭДС.
