
Химическое равновесие
1. Цель работы
Изучение состояния химического равновесия на примере гомогенной реакции в растворе, определение константы равновесия реакции, изучение влияния на константу равновесия температуры, определение теплового эффекта реакции.
2. Теоретическая часть.
Равновесное состояние – это термодинамическое состояние системы, при котором она не изменяется во времени.
Особенности состояния химического равновесия:
- неизменность состава системы (неизменность концентрации участников реакции);
- подвижность (самопроизвольное восстановление равновесия после прекращения внешнего воздействия);
- динамичность (равенство скорости прямого и обратного процессов);
- возможность достижения равновесия в результате самопроизвольного и несамопроизвольного процессов;
минимальное значение энергий Гиббса-Гельмгольца, максимальное значение энтропии и неизменность этих термодинамических функций (∆G=0, ∆S=0).
Состояние химического равновесия характеризуется константой равновесия
( Кр – если реакция проходит в газовой фазе, Кс – концентрационная константа, если реакция протекает в жидкой фазе).
В условиях равновесия, когда изменение свободной энергии Гиббса равно нулю, при данной температуре имеет место постоянное соотношение произведения равновесных концентраций (парциальных давлений) продуктов реакции к произведению концентраций (парциальных давлений) исходных веществ, взятых в степени, равные их стехиометрическим коэффициентам. Для химической реакции, протекающей по схеме:
аА + bB ↔ cC + dD (1)
константа равновесия рассчитывается по формулам:
Кр
= Кс
=
Кс
=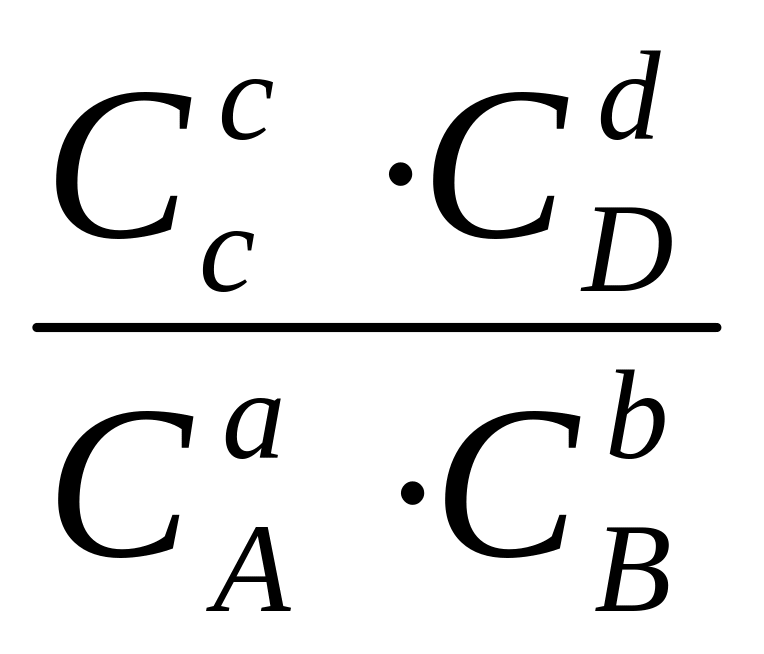 (2)
(2)
Между константами Кр и Кс существует связь, которая представляется в следующем виде:
Кp=Кc(RT), (3)
где ∆ν- изменение числа молей в процессе химической реакции, в которой хотя бы одно вещество находится в виде газа, для рассматриваемой реакции
∆ν = c+d-a-b.
Константа равновесия постоянна лишь при определенных условиях проведения химической реакции. Ее численное значение зависит от природы реагирующих веществ, для конкретной реакции – от температуры, давления, прочих факторов. Константа равновесия не зависит от концентрации реагирующих веществ.
Состояние равновесия описывается уравнением изотермы химической реакции:
∆Gр,T = RTln Пр – RTln Кр ; ∆Gр,T = RTln Пс – RTln Кс (4)
Пр= ; Пс= ,
где Пр – произведение давлений (фугитивностей), Пс – произведение концентраций (активностей), величина, определяемая в любой момент времени, кроме момента наступления состояния равновесия, чаще всего – в начале реакции.
Из уравнения изотермы химической реакции видно, что величина и знак энергии Гиббса реакции зависят от относительных величин Пр (с) и Кр (с) в изобарно-изотермических условиях:
а) при Пр (с)< Кр (с) ∆G<0;
б) при Пр (с) > Кр (с) ∆G>0;
в) при Пр (с) = Кр (с) ∆G=0
Для (а) процесс необратимый самопроизвольный и реакция пойдет слева направо – «прямая» реакция. Для (б) процесс необратимый несамопроизвольный, т.е. реакция пойдет в обратном направлении –«обратная» реакция. При условии (в) реакция достигает состояния химического равновесия.
Уравнение изотермы химической реакции можно записать и в другом виде: ∆Gр,T =∆GТ0 +RTln Пр – для реакции в газовой фазе; (5)
∆Gр,T =∆GТ0 +RTln Пс – для реакции в жидкой фазе;
где ∆GТ0 = - RTln К0 – стандартная энергия Гиббса, К0 – стандартная константа равновесия.
Стандартной энергией Гиббса химической реакции в газовой смеси (идеальной и реальной) называется энергия Гиббса реакции при стандартных парциальных давлениях (фугитивностях) всех компонентов (исходных веществ и продуктов реакции), равных 0,1013 МПа (1 атм).
Стандартная константа равновесия связана с константой равновесия Кр соотношением
Кр = К0(рi0)∆ν, (6)
где ∆ν- изменение числа молей в процессе химической реакции.
Если рi0(парциальные давления участников реакции) выражены в атмосферах (все рi0 = 1 атм), то константы равновесия Кр и К0 имеют одно и то же значение. Если рi0 выражены в Мпа, то Кр = К0∙0,1013∆ν. В этом случае у константы равновесия появляется размерность [Kр ] =Мпа∆ν .
Стандартной энергией Гиббса химической реакции в растворах ( идеальном и неидеальном) называется энергия Гиббса при стандартном состоянии раствора, за который принимают гипотетический раствор со свойствами предельно разбавленного раствора и с концентрацией (активностью) всех реагентов, равной единице.
Факторы, влияющие на константу и состояние равновесия.
Влияние различных факторов на состояние равновесие принято описывать принципом подвижного равновесия Ле-Шателье-Брауна: если на систему, находящуюся в состоянии подвижного равновесия, оказывается внешнее воздействие, то положение равновесия смещается в сторону, противодействующую этому воздействию. Более строго предсказать направление смешения равновесия и изменение константы равновесия можно исходя из уравнений, описывающих состояние равновесия.
1.Изменение содержания одного из компонентов.
Изменение содержания одного из компонентов приводит к нарушению состояния равновесия. При этом, как следует из уравнения изотермы химической реакции (4), добавление продуктов приводит к увеличению величины ∆G и, соответственно, смещению равновесия в сторону образования исходных веществ. Напротив, добавление одного из исходных веществ будет способствовать дополнительному образованию продуктов. При этом, изменение концентрации одного из компонентов не влияет не величину константы равновесия.
2. Изменение общего давления в системе.
В соответствии с принципом Ле - Шателье – Брауна при положительном изменении числа молей в реакции, идущей в газовой фазе (∆ν>0), повышение давления будет способствовать смещению равновесия в сторону образования исходных веществ, т.е. к снижению давления в системе.
Константа равновесия химической реакции в условиях изменившегося общего давления от р1 до р2 рассчитывается по следующему уравнению:
Кр2
= Кр1![]() (р2
/р1)
∆ν
(7)
(р2
/р1)
∆ν
(7)
где ∆ν- изменение числа молей в процессе химической реакции.
3. Изменение температуры в системе.
В общем случае зависимость константы равновесия от температуры выражается уравнениями изобары и изохоры:
при р-const
![]() уравнение изобары (8)
уравнение изобары (8)
при v-
const
![]() уравнение изохоры
(9)
уравнение изохоры
(9)
Уравнения изобары и изохоры позволяют количественно и качественно предвидеть и оценить зависимость константы равновесия от температуры:
1) если ∆Н>0, т.е.
реакция эндотермическая, то температурный
коэффициент константы равновесия
![]() >0, т.е. с
ростом температуры
константа
равновесия эндотермической реакции
всегда увеличивается и равновесие
сдвигается в сторону образования
продуктов реакции;
>0, т.е. с
ростом температуры
константа
равновесия эндотермической реакции
всегда увеличивается и равновесие
сдвигается в сторону образования
продуктов реакции;
2) если ∆Н<0, т.е. реакция экзотермическая, то температурный коэффициент константы равновесия < 0, т.е. с ростом температуры константа равновесия экзотермической реакции всегда уменьшается и равновесие сдвигается в сторону исходных веществ;
3) если ∆Н=0, то температурный коэффициент константы равновесия = 0, т.е. константа равновесия не зависит от температуры.
Чтобы определить численное значение константы равновесия при любой температуре необходимо дифференциальный вид уравнений изобары и изохоры (8,9) перевести в интегральный и решить их.
В частном случае, когда температура меняется незначительно, при этом
∆Н и ∆S можно приближенно считать постоянными величинами, не зависящими от температуры, константа равновесия увеличивается с увеличением температуры согласно уравнению:
ln Kр= - ∆G/RT= - (∆H - T∆S)/RT=∆S/R- ∆H/RT (10)
Способы определения термодинамических параметров равновесной химической реакции.
1. Необходимо поставить эксперимент по определению нескольких констант равновесия данной химической реакции при различных температурах. Построив графическую зависимость в координатах уравнения (10), по тангенсу угла наклона прямой можно определить значение теплового эффекта реакции ∆Н, по отсечению на оси ординат – изменение энтропии в реакции ∆S (рис. 1).
ln Кp


tg=
-![]()
S/R


1/T
Рис. 1. Зависимость Кр от температуры.
2. Тепловой эффект равновесного процесса можно определить и экспериментально – расчетным путем, предварительно определив при двух различных температурах Т1 и Т2 константы равновесия К1 и К2. Разделив переменные и проинтегрировав уравнение изобары (8) в пределах от К до К и от Т1 до Т2 , получим выражение для расчета теплового эффекта равновесной химической реакции:
![]() (11)
(11)
