
- •Теория металлургических процессов
- •Введение
- •Работа 1. Исследование реакции газификации углерода
- •Работа 2. Исследование процесса прямого восстановленя оксида железа
- •Работа 3. Исследование химичекой кинетики реакций диссоциации карбонатов
- •Работа 4. Исследование кинетики окислительного обжига сульфидного цинкового концентрата
- •Работа 5. Изучение реакций в системе Ме-s-о
- •Работа 6. Термодинамическая оценка процессов выщелачивания, сопровождающихся химическим взаимодействием
- •Варианты работы и условия опыта
- •Результаты анализа раствора
- •Работа 7. Исследование влияния пассивации поверхности минералов на процесс выщелачивания
- •Работа 8. Очистка раствора сульфата цинка от меди методом цементации
- •Приложение Определение концентрации меди.
- •Оглавление
Работа 6. Термодинамическая оценка процессов выщелачивания, сопровождающихся химическим взаимодействием
Цель – установить концентрационную константу равновесия, определить с использованием коэффициентов активностей термодинамическую константу, вычислить изменение свободной энергии Гиббса и оценить термодинамическую возможность или невозможность реализации конкретного процесса выщелачивания.
Общие сведения. Выщелачивание - это процесс избирательного извлечения ценного компонента в водный раствор.
Выщелачивание – процесс гетерогенный, в котором участвуют, по меньшей мере, две фазы – твердое вещество и раствор. В зависимости от характера физико-химических процессов различают два вида выщелачивания: простое выщелачивание и выщелачивание с химической реакцией.
Простое выщелачивание не сопровождается химическим взаимодействием и характеризуется тем, что элемент извлекается в раствор в форме соединения, в составе которого находятся в исходном сырье (сильвин – KCl, каменная соль – NaCl и др.). Поэтому простому растворению предшествуют подготовительные операции трансформации металла в растворимую форму – спекание, сплавление, сульфатизирующий или хлорирующий обжиг и др.
В простом растворении участвуют вещества, в твердом состоянии образующие ионную кристаллическую решетку, а в растворе они присутствуют в виде гидратированных ионов. Соответственно, изменение энергии Гиббса при растворении определяется энергией кристаллической решетки и энергией гидратации ионов
![]() . (1)
. (1)
При выщелачивании с химической реакцией металл, присутствующий в исходном сырье в виде мало растворимого в воде соединения, переводится под действием реагента в растворимую форму. Выщелачивание с химическим взаимодействием наиболее распространенный вид выщелачивания, часто требующий предварительной подготовки природного. При выщелачивании могут протекать реакции между оксидами и кислотами или щелочами, обменные или окислительно-восстановительные реакции.
Термодинамическое исследование физико-химических превращений заключается в изучении и сравнении термодинамических характеристик начального (исходного) и конечного (равновесного) состояния системы. Наиболее важными термодинамическими характеристиками физико-химических процессов являются изменения энергии Гиббса и изменение энтропии.
Изменение энергии Гиббса характеризует равновесное состояние системы и возможность самопроизвольного протекания изучаемого процесса при определенной температуре и давлении. До начала превращения энергия Гиббса (ΔGнач) представляет собой функцию исходного состояния систем при начальной температуре:
ΔGнач = RT ln П(ai±υi )+ ΔGi0, (2)
где ai – активность реагирующих веществ и продуктов реакции до начала процесса; υi – стехиометрические коэффициенты в уравнении химической реакции, для исходных веществ берутся со знаком (–), а для продуктов реакции - со знаком (+); ΔGi0 – стандартная энергия Гиббса.
Энергия Гиббса системы после протекания реакции и установления равновесия (Gр) представляет собой функция равновесного состава системы и является постоянной величиной для заданной температуры, характерной для каждой химической реакции:
ΔGp = RT ln Π(ai±υi )равн + ΔGi0 = RT ln Kp + ΔGi0, (3)
где Π(ai±υi )равн = Kp;
Kp – константа равновесия, характерная для исследуемого процесса, является величиной постоянной.
Изменение энергии Гиббса в результате осуществления взаимодействия определяется разностью уравнений (2) и (3):
ΔGp = ΔGнач + ΔGравн = RT[ln П(ai±υi ) – ln Kp]. (4)
Когда процесс осуществляется в стандартных условиях (Т = 298К, аi = 1), то ln П(ai±υi ) = 0, и уравнение (4) имеет вид:
ΔG0298 = –RT lnKp. (5)
Известно, что энтальпия системы характеризует тепловой эффект реакции, а также зависимость константы равновесия реакции от температуры:
ΔH = ΔHнач – ΔHравн . (6)
Значение энтальпии для начального и конечного (равновесного) состояния системы, имеет постоянную величину при заданных условиях, характерную для каждого физико-химического превращения.
Зависимость константы равновесия реакции от температуры выражает уравнение изобары Вант-Гоффа:
![]() (7)
(7)
Энергия Гиббса и энтальпия физико-химического превращения при заданной температуре связаны между собой уравнением Гиббса-Гельмгольца:
![]() (8)
(8)
Как видно из уравнения, выделение тепловой энергии в ходе взаимодействия способствует самопроизвольному протеканию процесса, что соответствует отрицательному значению энтальпии. К аналогичному явлению приводит рост энтропии системы. Однако известно, что величины энтальпии и энтропии могут иметь как отрицательные, так и положительные значения, поэтому предвидеть заранее направление протекания процесса затруднительно.
При низких температурах изменением энтропии при протекании реакции можно пренебречь, тогда энергия Гиббса и энтальпия процесса пропорциональны друг другу:
ΔGР = ΔH + const (9)
Это соотношение иногда используют для приближенной оценки изменения энергии Гиббса по тепловому эффекту реакции.
При высоких температурах (особенно в расплавленных средах) доля (ТΔS) в величине энергии Гиббса превалирует и определяет ее зависимость от температуры.
По уравнению (8) можно рассчитать величину константы равновесия реакции по стандартным значениям энтальпии и энтропии:
![]() (10)
(10)
Термодинамическая
константа равновесия (![]() )
для заданной температуры может быть
рассчитана с использованием уравнений
(5) и (8) по стандартному изменению энергии
Гиббса, энтальпии и энтропии веществ,
участвующих в реакции, которые приводятся
в справочной литературе.
)
для заданной температуры может быть
рассчитана с использованием уравнений
(5) и (8) по стандартному изменению энергии
Гиббса, энтальпии и энтропии веществ,
участвующих в реакции, которые приводятся
в справочной литературе.
Константу равновесия реакции можно также определить экспериментально. Однако прямой эксперимент позволяет определить концентрационную константу равновесия
![]() . (11)
. (11)
Последняя зависит от состава и ионной силы раствора:
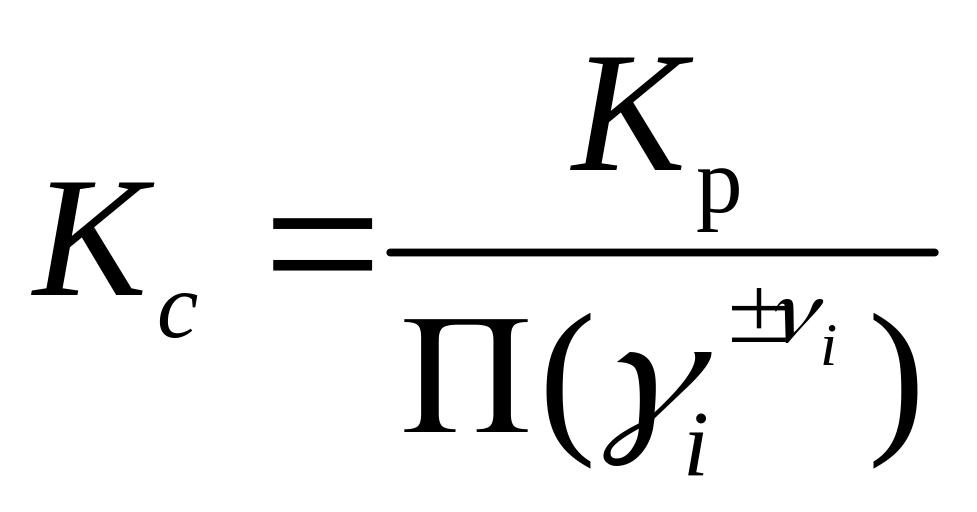 , (12)
, (12)
где:
-
коэффициенты активности реагирующих
веществ и продуктов реакции до начала
процесса;
![]() .
.
С

![]()
![]() .
Исходя из этого, определение
термодинамической константы равновесия
возможно осуществить путем графической
экстраполяции величины Кс
к бесконечному разведению раствора
(рис.1).
.
Исходя из этого, определение
термодинамической константы равновесия
возможно осуществить путем графической
экстраполяции величины Кс
к бесконечному разведению раствора
(рис.1).
К
Рис. 1. Графический
метод определения Кр
по зависимости Кс
от концентрации (ионной силы) раствора.
а) для двухосновной кислоты и двухвалентного металла:
МеО(т) + Н2А(р) = МеА(р) + Н2О, (13)
где А – анион кислоты.
Константа равновесия этой реакции:
![]() . (14)
. (14)
После достижения равновесия, когда металл практически растворится, в растворе должен остаться избыток растворителя (кислоты):
![]() (15)
(15)
или
![]() (16)
(16)
где ni – число молей вещества.
Кроме этого, для растворения оксида металла в соответствии с уравнением реакции (13) необходим 1 моль кислоты на 1 моль оксида. Таким образом, для полного растворения оксида металла необходимо взять кислоты в количестве на менее, чем
![]() ,
,
![]() . (17)
. (17)
Минимальная исходная концентрация кислоты в растворе составит:
![]() , (18)
, (18)
где V – объем раствора.
б) для одноосновной кислоты и двухвалентного металла уравнение реакции имеет вид:
МеО(т) + 2НА(р) = МеА2(р) + Н2О, (19)
Константа равновесия этой реакции:
![]() . (20)
. (20)
Избыточное количество кислоты в конце реакции:
![]() (21)
(21)
или
![]() (22)
(22)
Кроме того, для растворения оксида металла в соответствии с уравнением реакции (19) необходимо иметь 2 моля кислоты на 1 моль оксида. Таким образом, для полного растворения оксида необходимо использовать кислоту в количестве не менее, чем
![]() ,
, ![]() . (23)
. (23)
Исходная концентрация кислоты в растворе должна быть не менее, чем:
![]() (24)
(24)
Д
Рис.2.
Графическое определение Кс
1 – прямая реакция,
2 – обратная реакция
Величину
Кс
определяют графической экстраполяцией
(рис.2) при
![]() отношений
отношений
 или
или
 .
.
Порядок выполнения работы. Лабораторная установка включает: стакан с растворителем - 1; перемешивающее тело (магнитик) - 2; магнитную мешалку с подогревающим устройством - 3;
термометр - 4.
Необходимая посуда, материалы и реагенты: стеклянный стакан на 500 мл; мерный цилиндр на 500 мл; конические колбы на 250 мл; пипетки на 5 мл; оксид меди (порошок); раствор муравьиной кислоты (CH2O2) концентрацией 90 %; раствор уксусной кислоты (CH3COOH) концентрацией 99,5 %; раствор соляной кислоты концентрацией 2 N; раствор тиосульфата натрия (Na2S2O3) концентрацией 0,05 N; 20 %-ный раствор иодистого калия; раствор крахмала (индикатор).
Все опыты проводятся при постоянном перемешивании и при постоянной температуре.
1. Приготовить 300 мл раствора заданного состава и концентрации (табл.1), который затем слить в стеклянный стакан емкостью 500 мл.
Таблица 1
