
- •Теория металлургических процессов
- •Введение
- •Работа 1. Исследование реакции газификации углерода
- •Работа 2. Исследование процесса прямого восстановленя оксида железа
- •Работа 3. Исследование химичекой кинетики реакций диссоциации карбонатов
- •Работа 4. Исследование кинетики окислительного обжига сульфидного цинкового концентрата
- •Работа 5. Изучение реакций в системе Ме-s-о
- •Работа 6. Термодинамическая оценка процессов выщелачивания, сопровождающихся химическим взаимодействием
- •Варианты работы и условия опыта
- •Результаты анализа раствора
- •Работа 7. Исследование влияния пассивации поверхности минералов на процесс выщелачивания
- •Работа 8. Очистка раствора сульфата цинка от меди методом цементации
- •Приложение Определение концентрации меди.
- •Оглавление
Работа 5. Изучение реакций в системе Ме-s-о
Цель – установить температурные области окислительного и сульфатизирующего обжига системы Cu-S-О.
Общие сведения. В системе Ме-S-О возможен целый ряд химических реакций, которые имеют важное значение для практики переработки сульфидных руд и концентратов. При температурах 400-800°С протекают реакции с участием газообразной и твердой фаз различного состава. Закономерности этих реакций в рассматриваемой системе позволяют предвидеть условия так называемого полного или сульфатизирующего обжига.
Газовая фаза состоит из SО2, SО3, О2. Возможно также присутствие в ней N2 и, при определенных условиях, паров серы (S2). В зависимости от температурных условий и состава газовой фазы твердые фазы могут состоять из сульфидов, оксидов, сульфатов и оксисульфатов различной степени сложности.
При взаимодействии сульфида металла с кислородом при определенных условиях развивается реакция общего вида:
2
MeS
+ O2
↔ 2 MeO
+ 2SO2;
![]() <
0 (1)
<
0 (1)
В этом случае продуктами реакции являются оксид металла и сернистый газ. Под влиянием кислорода окислительной атмосферы и каталитическом воздействии оксида металла одновременно может протекать реакция окисления сернистого газа до серного ангидрида:
2
SO2
+ O2
↔ 2SO3;
![]() <
0 (2)
<
0 (2)
Образованию серного ангидрида, как это следует из принципа Ле-Шателье, способствуют температурный режим, повышенное общее давление и присутствие избыточного кислорода в газовой фазе.
Из формулы константы равновесия реакции образования серного ангидрида можно определить парциальное давление РSO3, которое для разных температур зависит от парциальных давлений РSO2 и РO2:
![]() ;
;
![]() (3)
(3)
При определенных условиях парциальное давление серного ангидрида может оказаться достаточным для образования сульфата МеSO4. Эти условия следуют из закономерностей термической диссоциации сульфата MeSO4 = MeO + SO3, для которой КР = РSO3
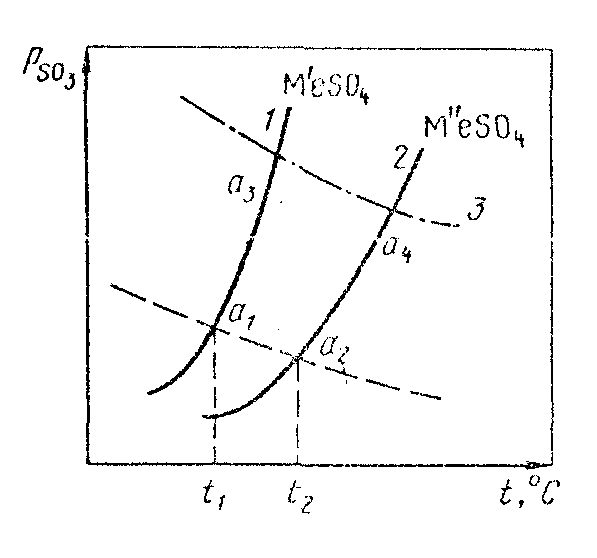
Мерой полноты разложения и показателем прочности сульфата является равновесное давление серного ангидрида. Если давление серного ангидрида РSO3(г.ф) в газовой фазе более высокое, чем давление диссоциации сульфата РSO3(равн.) (РSO3(г.ф) > РSO3(равн), то обеспечиваются благоприятные условия для образования сульфата. Если РSO3(г.ф) < РSO3(равн), то создаются благоприятные условия для разложения сульфата с образованием оксида металла. Эти условия образования и разложения сульфата иллюстрирует рис. 1, на котором представлены кривые давления диссоциации (1, 2) двух сульфатов Me’SO4 и Me”SO4, и пунктирная кривая 3 изменения парциального давления серного ангидрида РSO3, образующегося по реакции (2). Положение кривой 3 зависит от общего давления смеси, состоящей из SО2, SО3, и О2. Если взаимодействие сульфида с кислородом происходит в атмосфере воздуха, то кривая располагается значительно ниже, чем для взаимодействия с чистым кислородом (кривая 4). Повышение температуры, как это следует из знаков изменений энтальпии реакций, вызывает уменьшение давления серного ангидрида в газовой смеси и, соответственно, увеличение давления диссоциации сульфатов.
Т
Рис.
1. Температурные условия окислительного
и сульфатизирующего обжига сульфидов.
Взаимодействие сульфида с кислородом осуществляют в атмосфере воздуха при различных температурах. Для этого навеску сульфида выдерживают в течение определенного промежутка времени при постоянной температуре в потоке воздуха, проходящего с заданной скоростью. Газообразные продукты реакции удаляются из реакционной зоны в окружающую атмосферу, предварительно проходя через поглотительные склянки.
Твердые продукты обжига после охлаждения обрабатывают горячей дистиллированной водой и полученный раствор анализируют на содержание катионов соответствующего металла. По результатам анализа определяют температурные пределы, в которых происходит сульфатизирующий или полный обжиг.
Порядок выполнения работы. Установка для проведения опытов (рис. 2) состоит из электрической печи 1, реакционной трубки 2, контрольного устройства с термопарой 3,4, компрессора 5, реометра 6, при помощи которого задают скорость газового потока и поглотительной ячейки 7, заполненной раствором едкой щелочи (для улавливания SО2, SО3)
Рис.1. Схема установки
для изучения
окислительного
и сульфатизирующего обжига.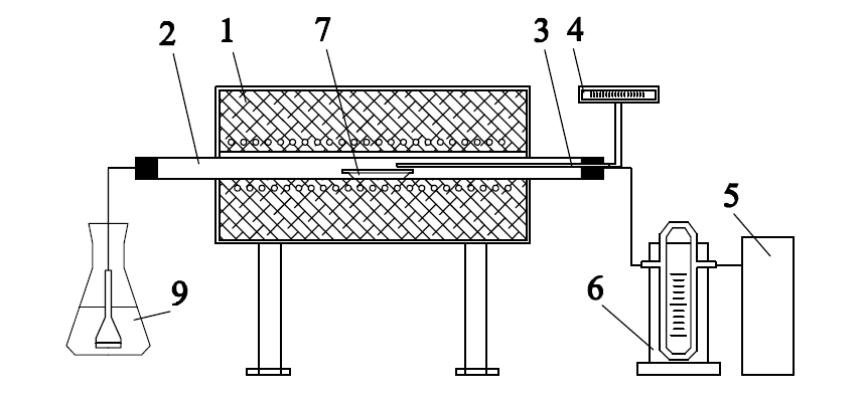
В реакционную трубку, предварительно нагретую до заданной температуры, помещают фарфоровую лодочку с навеской (1 г) исследуемого сульфида.
В качестве объекта исследования используют сульфиды железа или меди. Трубку при помощи шлифов присоединяют к остальным частям установки. Включают насос и по реометру устанавливают постоянную скорость окислительного газа (20 мл/мин). При пяти заданных значениях температуры в интервале 400-800°С навеску сульфида выдерживают в течение 15 мин. По окончании выдержки извлекают из реакционной трубки лодочку с навеской и помещают ее на асбестовую сетку. Затем содержимое лодочки помещают в стеклянную колбу, заливают 50 мл дистиллированной воды и кипятят в течение 5 мин. Полученный раствор фильтруют и анализируют на присутствие катионов меди.
Для сульфида меди в качестве индикатора используют водный раствор аммиака, который в присутствии катиона меди (Сu2+) окрашивает раствор в голубой цвет. Поскольку сульфиды и оксиды железа и меди практически не растворяются в воде, то окраска раствора изменяется в зависимости от температуры опытов, так как при этом изменяется количество сульфата в навеске. Отсутствие окраски раствора указывает на температуру полного обжига.
