
- •Теория металлургических процессов
- •Введение
- •Работа 1. Исследование реакции газификации углерода
- •Работа 2. Исследование процесса прямого восстановленя оксида железа
- •Работа 3. Исследование химичекой кинетики реакций диссоциации карбонатов
- •Работа 4. Исследование кинетики окислительного обжига сульфидного цинкового концентрата
- •Работа 5. Изучение реакций в системе Ме-s-о
- •Работа 6. Термодинамическая оценка процессов выщелачивания, сопровождающихся химическим взаимодействием
- •Варианты работы и условия опыта
- •Результаты анализа раствора
- •Работа 7. Исследование влияния пассивации поверхности минералов на процесс выщелачивания
- •Работа 8. Очистка раствора сульфата цинка от меди методом цементации
- •Приложение Определение концентрации меди.
- •Оглавление
Работа 4. Исследование кинетики окислительного обжига сульфидного цинкового концентрата
Цель – найти кинетические уравнения окислительного обжига сульфидного цинкового концентрата, определить лимитирующую стадию процесса и кажущуюся энергию активации.
Общие сведения. В общем виде взаимодействие сульфида двухвалентного металла может проходить по следующим реакциям:
MeS + 1½ O2 = MeO + SO2,
MeS + O2 = Me + SO2, MeS + 2O2 = MeSO4,
В газовой фазе возможна реакция 2SO2 + O2 2SO3, а образующийся SO3 может взаимодействовать с МеО с получением вторичных сульфатов по реакции МеО + SO3 MeSO4.
Вероятность осуществления окислительного обжига при данной температуре определяют термодинамическими расчетами изменения энергии Гиббса, т.е. химической термодинамикой, а скорость окисления – полуэмпирическими законами химической кинетики.
Процесс окисления твердых сульфидов является типичным гетерогенным процессом и включает в себя следующие элементарные стадии:
I – доставка О2 к внешней поверхности зерна (внешнедиффузионная область);
II – диффузия О2 в порах MeS (внутридиффузионная область);
III – адсорбция газа на поверхности твердого реагента (адсорбционная область);
IV – химическое взаимодействие MeS и адсорбированного О2 (кинетическая область);
V – десорбцию газообразных продуктов реакции (SO2, SO3) с поверхности реакции;
VI – диффузию газообразных продуктов реакции к поверхности частицы.
VII – диффузию газообразных продуктов реакции в центр газового потока.
Суммарную скорость процесса определяет самая медленная (лимитирующая) его стадия. В соответствии с этим процесс окисления сульфида может протекать в кинетическом, диффузионном или промежуточном режиме.
Одним из критериев для суждения о режиме протекания процесса является величина кажущейся энергии активации (ЕА). Если ЕА ~ 120-200 кДж/моль и более – кинетический режим, ЕА ~ 12-40 кДж/моль – диффузионный режим, ЕА ~ 60-100 кДж/моль – промежуточный режим.
Кажущуюся энергию активации рассчитывают если известны значения констант скорости k1 и k2 при двух температурах Т1 и Т2 по уравнению:
![]() .
.
Коэффициенты скорости химических реакций ki определяют экспериментально. В результате экспериментов получают кинетические зависимости степени превращения вещества от продолжительности реакции α = f (τ) или dα /dτ = f (τ).
Для описания кинетики гетерогенных процессов используют математические модели, частично представленные в таблице 1.
Таблица 1
Уравнения кинетики гетерогенных реакций и лимитирующие стадии процесса
№ |
Уравнение |
Лимитирующая стадия |
1 |
|
Кинетическая область. |
2 |
|
|
3 |
|
Внешнедиффузионная область. Уравнение Гистлинга. |
4 |
|
Внутридиффузионная область. Уравнение Яндера. |
5 |
|
Промежуточная область |
Достоверность приведенных в таблице 1 уравнений для описания механизма гетерогенного процесса определяют по максимальному коэффициенту корреляции r зависимостей k = f(α,τ) для каждого исследуемого формального кинетического уравнения.
Порядок выполнения работы. В исследовании используют цинковый концентрат крупностью -0,3+0,2 мм, содержащий 30% серы.
Для окислительного обжига применяется установка (рис. 1), состоящая из электропечи (1), в которую помещена кварцевая трубка (2) с хромель-алюмелевой термопарой (3) в комплекте с автоматическим потенциометром (4). С этой же стороны трубки осуществляется подвод воздуха компрессором (5). Расход воздуха устанавливают по реометру (6) 1 дм3/мин.
Навеску исследуемого образца 0,1 г помещают в фарфоровую лодочку (7) и ею заправляют печь, предварительно нагретую до заданной температуры. Второй конец трубки герметично закрывают пробкой, в которой имеется патрубок для отвода газа. Отводимый газ направляют в поглотительно-измерительную ячейку (8), заполненную 1% раствором пероксида водорода Н2О2 в дистиллированной воде. Объем раствора 1 л. Для диспергации газ пропускают через решетку Шотта (9). Процесс окисления сульфидов обжигаемого материала контролируют по количеству образующихся при этом сернистого и серного ангидридов (SO2 и SO3), улавливаемых поглотительной ячейкой. Количество уловленной серы определяют по показаниям кондуктометра (10), который калибруется до начала опыта. Калибровку кондуктометра делают по растворам серной кислоты разной концентрации с учетом влияния температуры на электропроводность раствора. На рисунке 2 приведен эталонный калибровочный график кондуктометра при температуре 22 °С.
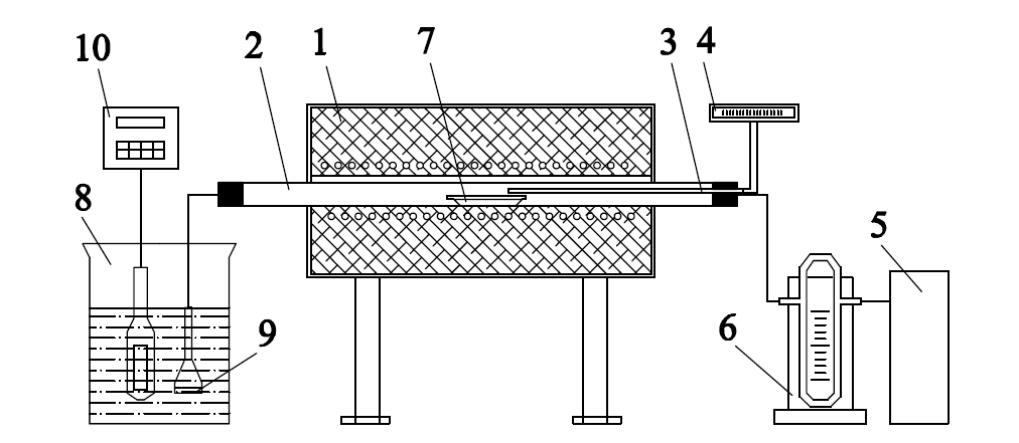
Рис.2. Схема установки для изучения кинетики окислительного обжига
сульфидного цинкового концентрата
Степень превращения вещества (в данном эксперименте называется степенью десульфуризации) вычисляют по формуле:
![]() ,
,
где
mS
– масса серы, установленной из
калибровочного графика, мг;
![]() –
масса серы в огарке, равная 0,03 мг с учетом
содержания серы в концентрате и
первоначальной навеской 0,1 г (100 мг).
–
масса серы в огарке, равная 0,03 мг с учетом
содержания серы в концентрате и
первоначальной навеской 0,1 г (100 мг).
Коэффициент скорости ki находят для пяти уравнений, приведенных в таблице 1. Затем выполняют регрессионный анализ, определяя наиболее вероятную лимитирующую стадию процесса на основе коэффициентов корреляции ri. Эксперимент повторяют при более высокой температуре Т2 и находят кажущуюся энергию активации.
Экспериментальные и расчетные сводят в таблицу.
Измерения при Т1 = …К |
Вычисления |
||||||||
τ, мин |
ρ, мкСм·см |
t, °С |
mS, мг |
α |
k1 |
k 2 |
k3 |
k4 |
k 5 |
|
|
|
|
|
|
|
|
|
|
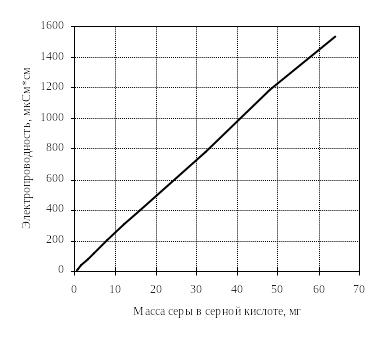
Рис. 2. Калибровочный график кондуктометра.
