
- •Теория металлургических процессов
- •Введение
- •Работа 1. Исследование реакции газификации углерода
- •Работа 2. Исследование процесса прямого восстановленя оксида железа
- •Работа 3. Исследование химичекой кинетики реакций диссоциации карбонатов
- •Работа 4. Исследование кинетики окислительного обжига сульфидного цинкового концентрата
- •Работа 5. Изучение реакций в системе Ме-s-о
- •Работа 6. Термодинамическая оценка процессов выщелачивания, сопровождающихся химическим взаимодействием
- •Варианты работы и условия опыта
- •Результаты анализа раствора
- •Работа 7. Исследование влияния пассивации поверхности минералов на процесс выщелачивания
- •Работа 8. Очистка раствора сульфата цинка от меди методом цементации
- •Приложение Определение концентрации меди.
- •Оглавление
Министерство по науке и образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт имени Г.В.Плеханова
(технический университет)
Теория металлургических процессов
Лабораторные работы
САНКТ-ПЕТЕРБУРГ
2010
УДК 669.01:53: 669.01:54
ББК
О
Лабораторные работы рассматривают основные сведения о химической термодинамике и химической кинетике, пиро и гидрометаллургических процессах, а также электрометаллургию.
Предназначены для студентов специальности 220301 «Автоматизация технологических процессов и производств (в металлургии)».
Научный редактор проф. В.М.Сизяков.
О 664: Теория металлургических процессов. Лабораторные работы / Е.В. Сизякова, г.в. коновалов, Г.И. Швачко. Санкт-Петербургский государственный горный институт (технический университет). СПб, 2010. с. 51.
ISBN
УДК 669.01:53: 669.01:54
ББК
ISBN |
Санкт-Петербургский горный институт им. Г.В.Плеханова, 2010 г. |
Введение
Лекционная часть курса "Теория металлургических процессов" включает в себя химическую термодинамику и кинетику, рассматривает пиро- и гидрометаллургические процессы, а также электрометаллургию.
В совокупности лабораторные работы дают представление о химической термодинамике, которая позволяет определить вероятность осуществления того или иного процесса и химическую кинетику, определяющую скорость процесса. Каждая из выполняемых работ содержит элементы исследования изучаемого процесса.
Перед началом работы в лаборатории следует детально ознакомиться с правилами техники безопасности и распорядком занятий.
Каждая лабораторная работа выполняется в четыре последовательных этапа: коллоквиум (собеседование), проведение эксперимента, составление отчета по работе и защита отчета.
При собеседовании выясняется цель работы и возможность ее осмысленного проведения. После сдачи коллоквиума студент получает задание на проведение работы и выполняет ее. Затем он должен показать полученные результаты преподавателю, после чего убрать свое рабочее место.
Отчет о работе должен содержать краткие сведения о теории процесса, описание методики исследования (в необходимых случаях приводится схема установки), задание, результаты расчетов, предшествующих проведению работы, экспериментальные данные в виде таблиц и графических зависимостей, выводы по работе.
При защите отчета студент должен показать знание теоретических основ исследованного процесса и уметь объяснить полученные экспериментальные результаты. Работа считается законченной при успешной защите отчета.
Работа 1. Исследование реакции газификации углерода
Цель – определить зависимость состава газовой фазы от температуры для реакции Будуара-Белла.
Общие сведения. Реакция газификации твердого углерода диоксидом углерода
С + СО2 = 2CO ∆Н0298 = -172580 Дж (1)
имеет большое практическое значение; она происходит при горении топлива, протекает в той или иной степени во всех металлургических агрегатах, содержащих уголь, кокс или графит. В обратном, экзотермическом превращении, монооксид углерода разлагается с выделением сажистого углерода, что наблюдается в восстановительных процессах (например, при доменной плавке).
2CO = С + СО2 ∆Н0298 = 172580 Дж (2)
Реакция газификации твердого углерода диоксидом углерода (1) сопровождается поглощением тепла и увеличением числа молей газообразных продуктов превращения1. Определение факторов, оказывающих влияние на рассматриваемое равновесие и качественная оценка этого влияния могут быть даны на основании принципа Ле-Шателье. В соответствии с этим принципом подвод к рассматриваемой системе тепла, повышение температуры и снижение давления в системе будут способствовать смещению равновесия в направлении, сопровождающемся поглощением тепла, т.е. газификации углерода. Таким образом, повышение температуры и снижение давления в системе увеличивают степень протекания газификации углерода и концентрацию монооксида углерода в газовой фазе. Повышение давления и снижение температуры в системе сопровождаются распадом монооксида углерода и повышением концентрации диоксида углерода в газовой фазе.
Рассматриваемая система состоит из двух фаз: твердого углерода и газа; число независимых компонентов также равно двум. Число степеней свободы (С), т.е. число независимых переменных, варьирование значений которых в определенных пределах не сопровождается изменением числа и природы фаз, находящихся в равновесии, определяется по правилу фаз Гиббса:
С = К + 2 – Ф (3)
где К - число независимых компонентов, определяемое как число веществ, участвующих в реакции, за вычетом числа реакций между ними (или как наименьшее число элементов, необходимое для выражения состава любой фазы); Ф - число фаз, т.е. число однородных по составу и свойствам частей системы, отделенных от остальных ее частей физической границей раздела.
В рассматриваемом случае между собой реагируют по одной реакции (1) три вещества, находящиеся в двух фазах (твердой и газообразной). Следовательно, число независимых компонентов равно n = 3 – 1 = 2, а число степеней свободы
С = (3-1) + 2 – 2 = 2 (4)
Таким образом, система двухвариантная, т.е. равновесные концентрации СО и СО2 являются функцией двух параметров (Р и Т) и не зависят от исходного состава газа
% СО(Р) = ƒ (Т, Р). (5)
Константа равновесия рассматриваемой реакции определяется из соотношения
КР
=
 .
(6)
.
(6)
При относительно небольших давлениях и достаточно высоких температурах, характерных для подавляющего большинства металлургических процессов, фугитивности газов близки к их парциальным давлениям.
На этом основании
аСО = ƒСО РСО (7)
аСО2 = ƒСО2 РСО2. (8)
Активность крупнокристаллического достаточно чистого графита близка к единице. С учетом этого и соотношений (7, 8) уравнение (6) может быть представлено в виде:
КР
=
![]() =
ƒ (Т) (9)
=
ƒ (Т) (9)
Так как реакция газификации идет с поглощением тепла (∆Н > 0), то из уравнения изобары следует, что производная положительна, следовательно, с ростом температуры константа равновесия увеличивается, а равновесие реакции смещается в сторону образования продуктов реакции (СО).
Величина константы равновесия зависит только от температуры, и ее значение может быть определено по одному из широко известных уравнений. Удобным в пользовании и достаточно точным является уравнение Темкина-Шварцмана
–RTln KР = ∆Н0298 – T ∆S0298 – T (M0∆a + M1∆b + M2∆c).
Значения логарифмов константы равновесия реакции (1) при различных температурах
Таблица 1.
Температура, К |
500 |
1000 |
1500 |
2000 |
ln Kp |
-20,04 |
0,46 |
7,35 |
10,27 |
В области высоких температур К >> 1 (табл.1) и реакция практически необратимо сдвинута в сторону образования монооксида углерода; вблизи 1000 К константа равновесия равна единице, т.е. в зоне умеренных температур (650 - 1150 К) реакция практически обратима, а при низких температурах (ниже 650 К) практически необратимо сдвинута в сторону разложения монооксида углерода.
В принципе, для многих превращений можно выделить три указанные температурные области, где реакция обратима или же протекает необратимо в прямом и противоположном направлениях. Особенностью данной реакции является то, что условные границы обратимости располагаются в сравнительно узком температурном интервале (700-1300 K), реализуемом в обычных металлургических агрегатах.
Поэтому все три случая имеют практическое значение. Выражая парциальные давления через концентрации газовых компонентов в объемных процентах и пользуясь уравнением (9), найдем зависимость равновесного состава газовой фазы от общего давления.
РСО = Роб %СО/100 РСО2 = Роб %СО2/100 (11)
КР = Роб (%СО)2/(%СО2 100) (12)
Если газовая фаза состоит из СО и СО2, то %СО + %СО2 = 100 (13)
РСО + РСО2 = Роб (14)
тогда
КР
=
![]() (15)
(15)
А также из (9) и (14)
РСО
= –
![]() +
+![]() (16)
(16)
РСО = Роб + – (17)
Из соотношений (12) и (15) отнюдь не следует, что константа равновесия зависит от общего давления. Изменение последнего при постоянной температуре оказывает влияние лишь на % СО и % СО2, а константа равновесия остается постоянной. Таким образом, из соотношения (12) и (15) следует, что равновесный состав газовой фазы зависит не только от температуры, но и от давления – с увеличением последнего равновесная концентрация СО уменьшается, а СО2 возрастает.
Эта зависимость может быть определена при использовании уравнений, приведенных выше (12, 15, 16, 17), и как функция трех переменных (РСО, Роб, Т) может быть представлена графически в пространственной системе координат в виде поверхности, что однако и затруднительно, и недостаточно наглядно.
По
этой причине предпочитают пользоваться
параметрическими кривыми на плоскости,
а именно изобарами (РСО,
Т) для фиксированных значений Роб
и изотермами (РСО,
Роб)
для заданных Т, получающимися при сечении
поверхности (РСО,
Роб,
Т) плоскостями Р =
соnst или Т
= соnst (рис.1 и 2 соответственно). Каждая
из таких кривых характеризует условия
равновесного сосуществования реагентов,
образующих рассматриваемую систему
(СО – С – C
Рис.
1. Изобары реакции С + СО2
= 2CO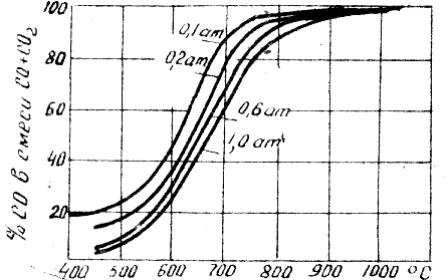
Если системе возникла в результате неполного горения углерода в воздухе или в результате взаимодействия смеси СО2 и N2 с углеродом, то газовая фаза кроме СО и СО2 содержит азот. В этом случае число независимых компонентов и степеней свободы возрастает на единицу, и для определения равновесного состава необходима еще одна связь между переменными. Такой связью может служить постоянство отношения количества атомов кислорода к количеству атомов азота в исходном и равновесном состоянии.2
Таким образом, если в системе содержатся инертные газы (например, азот), то для расчета и изображения ее параметрических кривых, в частности изобар, требуется задавать не только общее давление (Р), но и отношение О2 к N2. Разбавление газовой смеси инертным веществом (в частности, азотом) оказывает такое же действие на равновесные концентрации, как и уменьшение общего давления в системе.
Порядок проведения работы. В кварцевый реактор загружают уголь. Подачей газа из аппарата Киппа реактор заполняется СО2 и отключается от аппарата. Проводится анализ газов на СО и СО2. По равновесным составам газовой фазы для заданных температур необходимо вычислить константы равновесия КР реакции газификации углерода, сравнить их с данными, приведенными в разных источниках. Построить графики зависимости ln КР = ƒ(1/Т) по экспериментальным и литературным данным. Определить уравнение температурной зависимости ΔG0 = ƒ(Т) для реакции газификации углерода, сравнить с литературными данными.
Схема лабораторной установки по изучению реакции газификации приведена на рис.2.
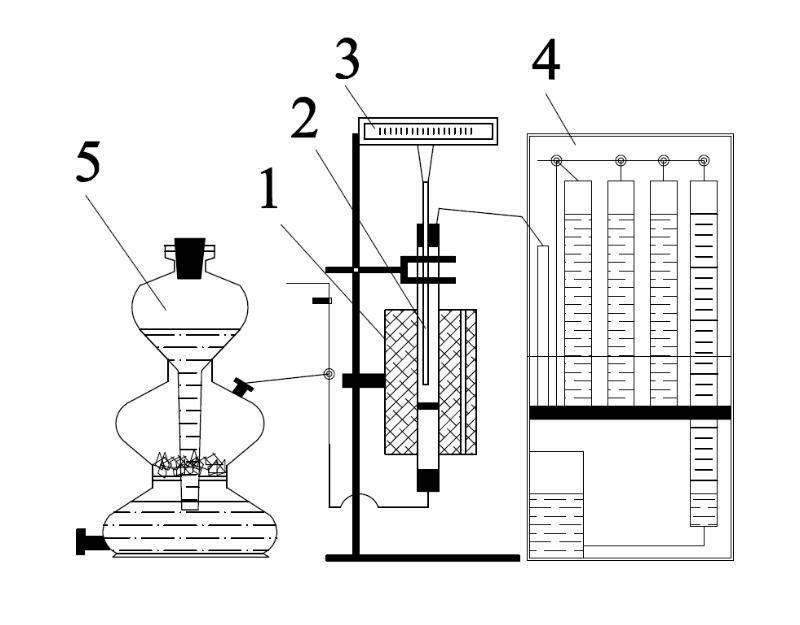
Рис.2. Схема установки по изучению реакции газификации угля.
1 – электрическая печь, 2 – кварцевый реактор, 3 – потенциометр в комплекте с термопарой, 4 – газоанализатор, 5 – прибор Киппа.
Прибор Киппа применяют для синтеза газовых реагентов. Газ получают путем взаимодействия жидкости с крупными кусками твердого вещества. В средний шар прибора кладут куски твердого вещества (мрамор), отверстие этого шара закрывают резиновой пробкой, в которую вставлена трубка с краном, и наливают через верхний шар жидкость. Если открыть кран, то жидкость поднимается вверх и достигает твердого вещества, при этом начинает выделяться газ. Если закрыть кран, то продолжающийся выделяться газ вытесняет жидкость вниз, и процесс прекращается.
Газоанализатор состоит из бюретки емкостью 100 см3, служащей для измерения первоначального объема газовой смеси и оставшихся объемов после поглощения, поглотительных сосудов, распределительной гребенки и уравнительного сосуда с затворной жидкостью. Газовый фильтр выполнен в виде U-образной трубки, заполненной стеклянной ватой.
Анализ газов производится следующим образом (табл. 2).
Таблица 2
Состав некоторых поглощающих растворов для химических газоанализаторов
Поглощаемые газы |
Раствор
|
Состав раствора
|
Реакции поглощения
|
СО2 |
Раствор едкого кали (КОН) |
100 вес. ч. КОН; 200 вес. ч. дистиллированной воды |
СО2 + 2KОН = К2СО3 + H2O |
О2
|
Щелочной раствор пирогаллола [С3Н3 (ОН)3] |
18 г С3Н3 (ОН)3; 70 см3 50%-ного раствора едкого кали; 40 см3 горячей дистиллированной воды |
Точно не известно |
СО
|
Аммиачный раствор однохлористой меди (Сu2С12) |
200 г Сu2С12 250 г нашатыря (NH4С1); 750 г дистиллированной воды; 350 см3 аммиака ( = 0,91); немного медной стружки |
2СО + Сu2С12 = Сu2С122СО; Сu2С122СО + 4NH3 + 2Н2О = 2Сu + NH4С1+ 2СО NH4 |
Вначале исследуемый газ подсасывается к газоанализатору и для промывки газоподводящей линии несколько раз сбрасывается через трехходовой кран в атмосферу. Далее, соединив газоподводящую линию с газоанализатором соответствующим поворотом трехходового крана, опуская уравнительный сосуд, набирают исследуемый газ через распределительную гребенку в мерную бюретку. Для промывки газоанализатора эту операцию повторяют несколько раз, сбрасывая первые порции газа. После отбора окончательной пробы газа ее несколько раз перегоняют в первый поглотительный сосуд, наполненный раствором едкого кали, для поглощения СО2. Оставшийся после поглощения СО2 объем газа измеряют в бюретке, количество СО2 находят как разность первоначального и оставшегося объемов газа. После этого газ несколько раз перегоняют во второй поглотительный сосуд, наполненный щелочным раствором пирогаллола для поглощения О2. Количество О2 находят как разность объемов газа, оставшихся после поглощения СО2 и О2. Для определения содержания СО газ перегоняют в третий поглотительный сосуд, наполненный аммиачным раствором однохлористой меди. Азот определяют по разности, вычитая из 100% сумму содержания СО2, О2 и СО.
