
- •Введение
- •Основные понятия и определения
- •Физическое состояние вещества, фазовая диаграмма чистого вещества
- •Законы и уравнение состояния идеальных газов. Уравнения состояния реального газа
- •4. Первое начало термодинамики
- •5. Процессы изменения состояния термодинамических систем
- •6. Круговые процессы (циклы)
- •Второе начало термодинамики
- •8. Смеси жидкостей, паров и газов
- •9. Пары и парообразование
- •10. Истечение жидкостей, паров и газов. Дросселирование
- •11. Процессы сжатия в компрессорах
- •12. Циклы паросиловых установок и холодильных машин
- •13. Циклы двигателей внутреннего сгорания
- •Литература
5. Процессы изменения состояния термодинамических систем
Классификация термодинамических процессов
Термодинамический
процесс может быть задан либо графическим
способом в виде изображения процесса
в координатах p-v,
p-T,
Т-s,
либо в
аналитической форме в виде зависимости
![]() .
.
Уравнение
процесса может быть также задано исходным
условием о неизменном значении в этом
процессе какой - либо функции состояния
(![]() )
или условием о равенстве нулю какого –
либо эффекта термодинамического процесса
)
или условием о равенстве нулю какого –
либо эффекта термодинамического процесса
![]() ,
однако и в этом случае исходное условие
приводится к основной форме уравнения
процесса.
,
однако и в этом случае исходное условие
приводится к основной форме уравнения
процесса.
При изучении термодинамических процессов определяются:
1) закономерность изменения параметров состояния рабочего тела, то есть выводится уравнение процесса или дается его графическое изображение в координатах p-v, p-T, Т-s и т.д.;
2) параметры состояния системы в начальной и конечной точках процесса;
3) численные значения работы и теплообмена в процессе;
4) изменение значений внутренней энергии, энтальпии и энтропии рабочего тела.
Простейшие термодинамические процессы
Простейшими термодинамическими процессами обычно считают изобарный, изохорный и изопотенциальные процессы.
Изобарный
процесс (![]() )
– процесс в
котором давление в системе остается
постоянным.
)
– процесс в
котором давление в системе остается
постоянным.
Изобарный процесс (или изобара) графически представлен на рис. 5.
В изобарных процессах происходит увеличение (1-2) или уменьшение (1-3) удельного объема, что связано изменением температуры, обусловленным подводом или отводом теплоты.
Изобарные процессы подвода или отвода теплоты происходят в поршневых двигателях внутреннего сгорания, газотурбинных, паросиловых, холодильных установках и др.
Для
идеального газа в изобарном процессе
(1-2)
значение удельного объема прямо
пропорционально температуре рабочего
тела
![]() .
.
Удельная термодинамическая и потенциальная работы в изобарном процессе определяются из соотношений
![]() ,
(79)
,
(79)
![]() .
(80)
.
(80)
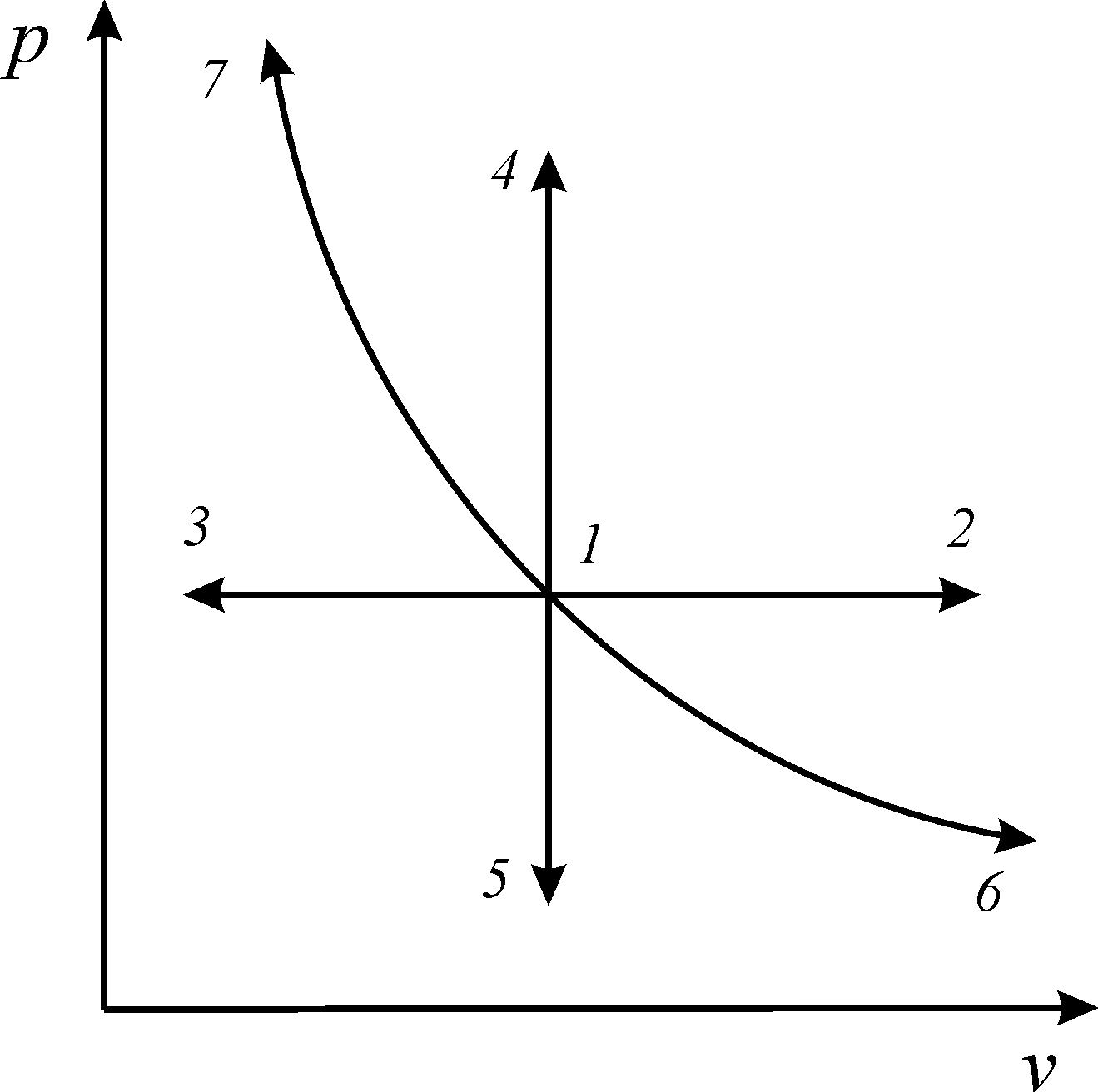
Рис.
5. Простейшие термодинамические процессы:
1-2,
1-3
–
изобары; 1-4,
1-5
–
изохоры;
1-6,
1-7
–
изопотенциальные процессы
Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе, определяется из выражения первого начала термодинамики
![]() .
(81)
.
(81)
Изохорный
процесс (![]() )
– процесс, при котором объем системы
или удельный объем рабочего тела остается
постоянным (рис. 5).
)
– процесс, при котором объем системы
или удельный объем рабочего тела остается
постоянным (рис. 5).
В изохорных процессах происходит увеличение (1-4) или уменьшение (1-5) давления, что связано с соответственным изменением температуры – подводом или отводом теплоты.
Изохорные процессы подвода или отвода теплоты происходят в поршневых двигателях внутреннего сгорания, газотурбинных, паросиловых установках и др.
Для
идеального газа в изохорном процессе
(1-4)
давление прямо пропорционально
температуре рабочего тела
![]() .
.
Удельная термодинамическая и потенциальная работы в изохорном процессе определяются из соотношений
![]() ,
(82)
,
(82)
![]() .
(83)
.
(83)
Количество теплоты, подведенной к рабочему телу или отведенной от него в изохорном процессе, определяется из выражения первого начала термодинамики
![]() .
(84)
.
(84)
Изопотенциальный
процесс –
термодинамический процесс изменения
состояния системы, при котором значение
потенциальной
функции (![]() )
сохраняет
неизменное значение
(процессы 1-6,
1-7)
(рис. 5).
)
сохраняет
неизменное значение
(процессы 1-6,
1-7)
(рис. 5).
Для
идеального газа, согласно уравнению
Клапейрона (![]() ),
изопотенциальный
процесс (
),
изопотенциальный
процесс (![]() )
является и изотермическим
(
)
является и изотермическим
(![]() ).
).
Удельная термодинамическая и потенциальная работы в изопотенциальном процессе (1-6) определяются из следующих соотношений:
![]() =
=
![]() =
=
![]() ;
(85)
;
(85)
![]() =
=
![]() =
=
![]() =
=
![]() .
(86)
.
(86)
Нетрудно
заметить, что постоянство потенциальной
функции (![]() )
приводит к равенству логарифмов в
выражениях (85) и (86) в силу того, что
соблюдается условие
)
приводит к равенству логарифмов в
выражениях (85) и (86) в силу того, что
соблюдается условие
![]() .
Поэтому, в изопотенциальном процессе
численные значения термодинамической
и потенциальной работ равны между собой.
.
Поэтому, в изопотенциальном процессе
численные значения термодинамической
и потенциальной работ равны между собой.
Количество теплоты, подведенной к рабочему телу или отведенной от него в изопотенциальном процессе определяется из выражения первого начала термодинамики по балансу рабочего тела
![]() .
(87)
.
(87)
Уравнения перечисленных простейших и любых других термодинамических процессов могут быть представлены одним уравнением. Это уравнение называется уравнением политропы, а термодинамические процессы, описываемые этим уравнением, называются политропными.
Политропные процессы
Термин «политропа» представляет собой сочетание двух греческих слов «поли» - много и «тропос» - путь, направление. Поэтому в политропном процессе предполагается многообразие путей изменения параметров состояния системы.
Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела, подчиняющийся уравнению, которое может быть представлено в следующих формах:
![]() ;
(88)
;
(88)
![]() ;
(89)
;
(89)
![]() =
=
![]() .
(90)
.
(90)
где п – показатель политропы, являющий в рассматриваемом процессе постоянной величиной, которая может иметь любые частные значения - положительные и отрицательные (- n +).
Физический смысл показателя политропы п определяется после дифференцирования выражения (88)
![]() .
(91)
.
(91)
Из соотношения непосредственно следует
![]() .
(92)
.
(92)
Это
значит, что постоянный
показатель политропы
определяется соотношением потенциальной
и термодинамической работ в элементарном
или конечном процессах. Значения этих
работ могут быть определены графически
в координатах
![]() (рис. 6а).
(рис. 6а).
В логарифмических координатах политропный процесс (политропа) с постоянным показателем представляет собой прямую линию (рис. 6б)
![]() .
(93)
.
(93)
При
этом, постоянный показатель политропы
определяется как тангенс угла наклона
линии процесса к оси абсцисс (![]() )
(рис. 6б)
)
(рис. 6б)
n
=
![]() =
=
![]() .
(94)
.
(94)
а б

Рис. 6. Политропа с постоянным показателем
Из соотношения (92) следует, что для изобарного процесса n = 0, для изохорного процесса - n = ± ∞, для изопотенциального процесса - n = 1 (рис. 7).
Рис.
7. Политропные процессы изменения
состояния
простого
тела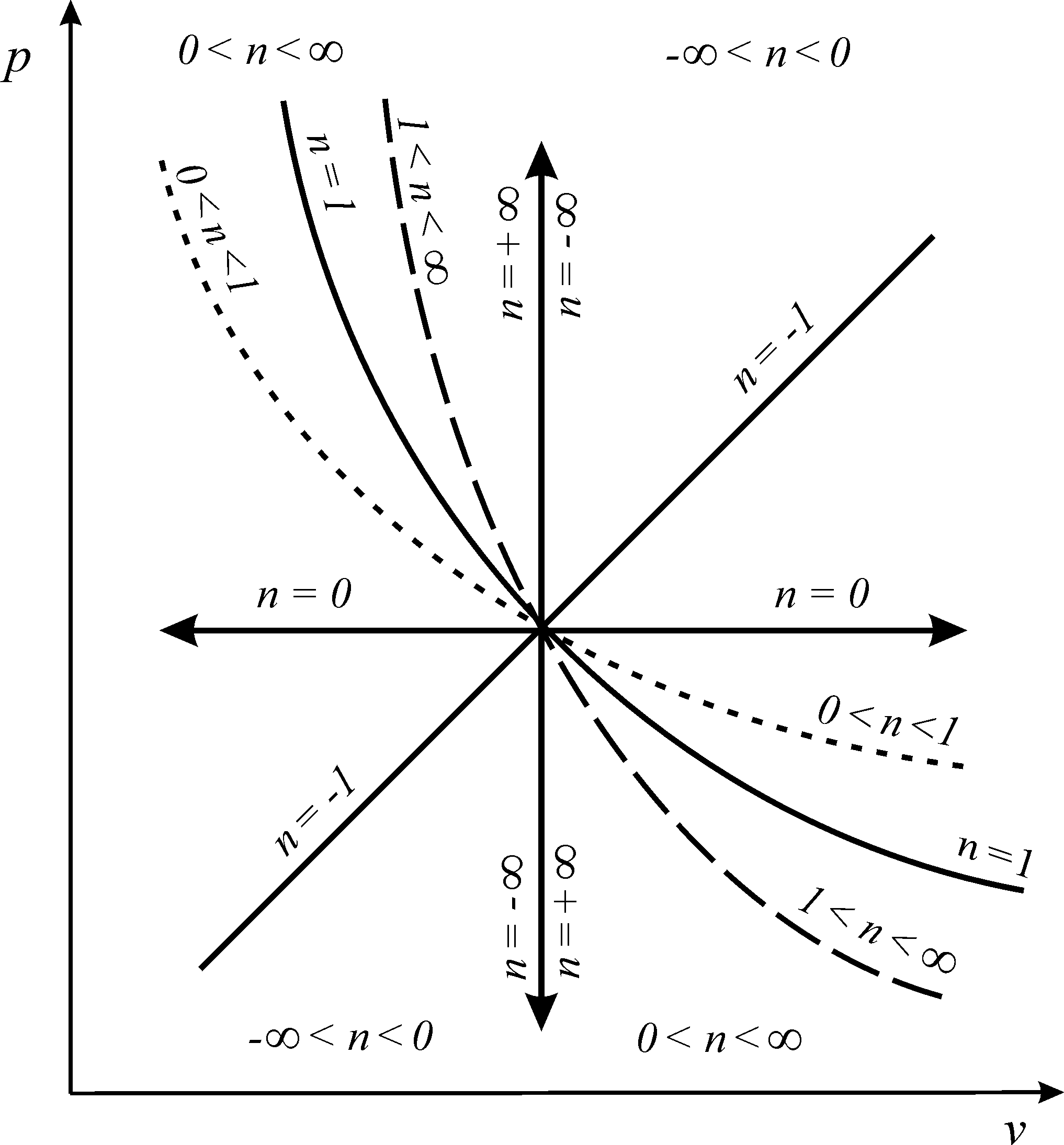
Следует отметить, что не все термодинамические процессы в координатах logv – logp описываются прямой линией, т.е. подчиняются уравнению политропы с постоянным показателем. Любой термодинамический процесс можно описать уравнением политропы с переменным показателем (рис. 8).
Расчет
политропного процесса с переменным
показателем вызывает
необходимость ввести в рассмотрение
три показателя процесса: истинный
показатель процесса (n);
первый средний показатель
![]() и второй средний показатель (m).
и второй средний показатель (m).
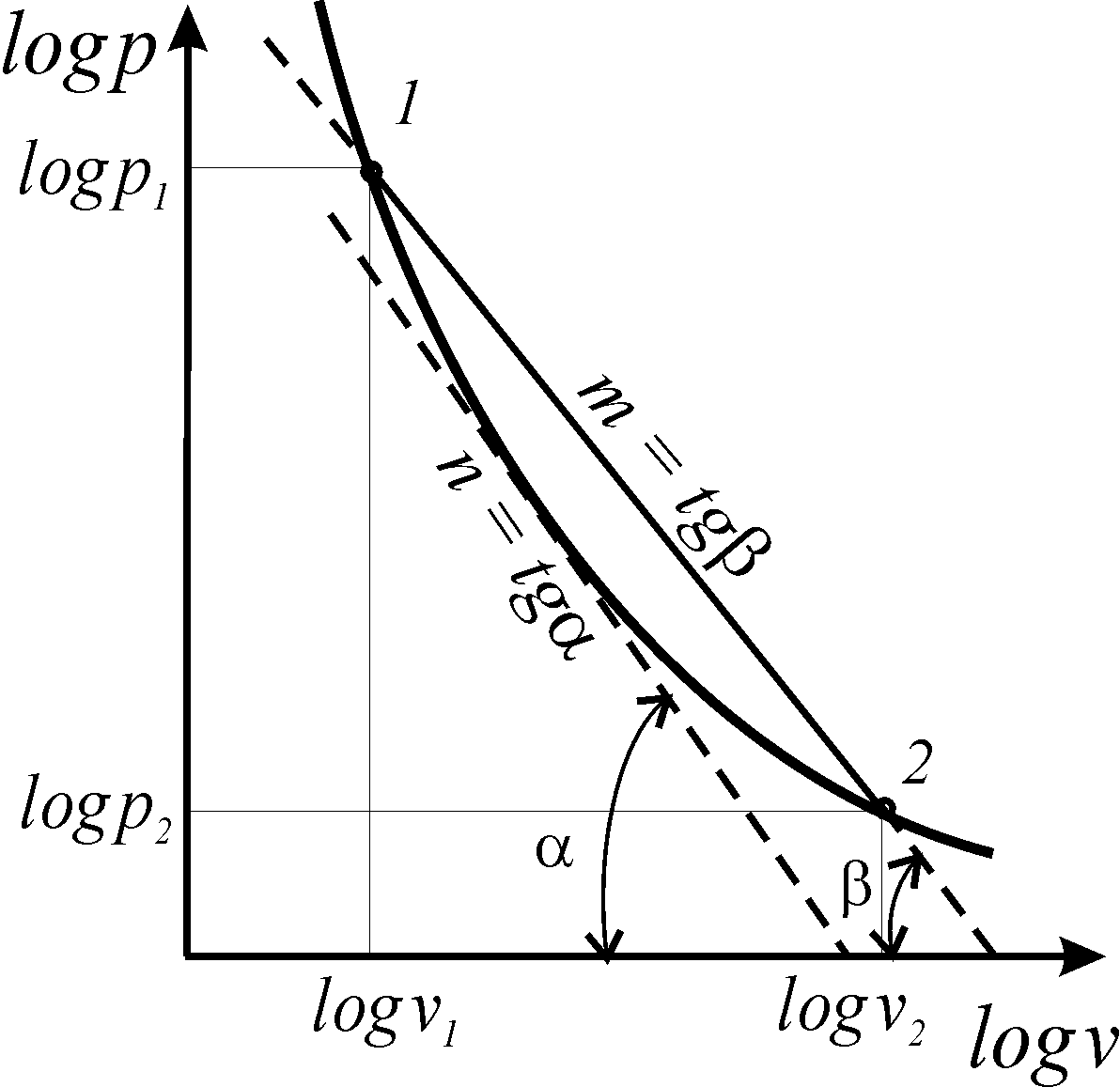
Рис.
8. Политропа с переменным показателем
Истинный показатель процесса (n) определяется как соотношение элементарной потенциальной работы к элементарной термодинамической работе , что соответствует тангенсу угла наклона касательной, проведенной к кривой процесса в точке процесса, к оси абсцисс ( ) в логарифмической сетке координат
n
=
![]() =
tg.
(95)
=
tg.
(95)
Для конкретных процессов, характеризующихся неизменным значением какой-либо функции или параметра состояния (z = p,v,T, u, h, s), истинный показатель политропы определяется соотношением
![]() .
(96)
.
(96)
Первый средний показатель политропы определяется как отношение конечных (интегральных) значений потенциальной и термодинамической работ в процессе
![]() .
(97)
.
(97)
Второй
средний показатель политропы численно
равен тангенсу угла наклона секущей
1-2
к оси абсцисс (![]() )
в логарифмической сетке
координат
(рис. 8)
)
в логарифмической сетке
координат
(рис. 8)
m
=
=
![]() .
(98)
.
(98)
Непосредственно из последнего выражения (98) следует уравнение политропы с переменным показателем
 .
(99)
.
(99)
При
проведении инженерных расчетов в ряде
случаев политропные процессы с переменным
показателем политропы приближенно
описываются уравнением политропы с
постоянным показателем (88), значение
которого принимается равным первому
среднему показателю политропы (![]() ).
).
Работа в политропных процессах простых тел
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах можно получить при сопоставлении их элементарных значений:
![]() ;
(100)
;
(100)
![]() .
(101)
.
(101)
После подстановки выражения для показателя политропы (92) в соотношение (101) получаем
![]() ,
(102)
,
(102)
или
![]() .
(103)
.
(103)
Интегрируя последнее выражение (103) с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), получаем следующее соотношение для определения удельной термодинамической работы в конечном процессе (1-2)
![]() .
(104)
.
(104)
Введем понятие характеристики процесса расширения или сжатия, определяемой соотношением
![]() .
(105)
.
(105)
С учетом соотношений (92), (105), зависимости для определения удельной термодинамической и потенциальной работы в конечном процессе примут следующий вид:
![]() ;
(106)
;
(106)
![]() .
(107)
.
(107)
Соотношение
для определения характеристики расширения
или сжатия в рассматриваемом процессе
![]() определяется с учетом зависимостей
(89), (90) и имеет следующий вид:
определяется с учетом зависимостей
(89), (90) и имеет следующий вид:
=
 =
=
 .
(108)
.
(108)
Теплообмен в термодинамических процессах простых тел
Теплообмен в любом термодинамическом процессе изменения состояния простых тел может быть выражен в зависимости от величины термодинамической или потенциальной работы процесса. При этом термодинамический процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики
![]() (109)
(109)
Удельная внутренняя энергия для простых тел может быть представлена в виде функции любых двух независимых параметров состояния. Примем, что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следующем виде:
![]() .
(110)
.
(110)
Последнее выражение (110) можно представить в виде
![]() .
(111)
.
(111)
Введем следующие обозначения:
![]() ;
;
![]() .
(112)
.
(112)
При этом выражение (111) примет вид:
![]() .
(113)
.
(113)
Сопоставляя соотношения (109) и (113), получим
![]() (114)
(114)
Для
определения величин (![]() и
и
![]() )
рассмотрим два термодинамических
процесса:
)
рассмотрим два термодинамических
процесса:
1. Изоэнергетический процесс (u = idem, du = 0). Для этого процесса показатель политропы принимает значение n = nu.
Так
как в изоэнергетическом процессе
![]() ,
из уравнения (113) следует, что
,
из уравнения (113) следует, что
![]() (115)
(115)
или
![]() .
(115а)
.
(115а)
2. Адиабатный процесс ( q = 0). В этом процессе показатель политропы принимает значение n = k и называется показателем адиабаты.
В адиабатном процессе элементарная термодинамическая работа также не равна нулю, поэтому из выражения (114) имеем
![]() .
(116)
.
(116)
Сопоставляя соотношения (115) и (116), получаем следующие выражения:
![]() ,
,
![]() .
(117)
.
(117)
С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:
![]() ,
(118)
,
(118)
![]() .
(119)
.
(119)
Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:
![]() ,
(120)
,
(120)
![]() .
(121)
.
(121)
Полученные соотношения (120), (121) позволяют в координатах p-v построить области подвода и отвода теплоты (рис. 9).

Рис.
9. Процессы изменения состояния идеального
газа
Некоторые характеристики важнейших термодинамических процессов приведены в табл. 1
Таблица 1
Термодинамические процессы изменения состояния простого тела
Название и уравнение процесса |
Показатель политропы |
Графическое изображение |
Работа |
Количество теплоты |
1 |
2 |
3 |
4 |
5 |
Политропный pvn = idem |
- n +,
n
=
|
|
l1,2
= w1,2 = n ,
1,2
=
=
|
q1,2 = u1,2 + l1,2 = = h1,2 + w1,2 ,
q1,2
=
|
Изобарный p = idem, dp = 0 |
n = 0 |
|
l1,2 = p(v2 - v1), w1,2 = 0,
1,2
= |
q1,2 = u1,2 + l1,2 = = h1,2 |
Продолжение табл. 1
1 |
2 |
3 |
4 |
5 |
Изохорный v = idem, dv = 0 |
n = ± ∞ |
|
l1,2 = 0, w1,2 = v(p1 - p2),
1,2
= |
q1,2 = u1,2 = = h1,2 + w1,2 |
Изопотенциаль-ный pv = idem |
n = 1 |
|
l1,2 = w1,2 =
=
pvln 1,2 = 1 |
q1,2 = u1,2 + l1,2 = = h1,2 + w1,2 |
Адиабатный δq = 0, pvk = idem |
n = k = ns =
|
|
l1,2
=
w1,2 = k ,
1,2
=
= |
q1,2 = 0 |
Процессы изменения состояния идеального газа
При изучении процессов изменения состояния идеальных газов, наряду с общими соотношениями по расчету термодинамических процессов (79) – (121), следует использовать уравнение Клапейрона (27) и закон Джоуля (33), в соответствии с которыми для идеального газа справедливы следующие выражения:
если
,
то
![]() ;
(122)
;
(122)
![]() ;
(123)
;
(123)
![]() ;
(124)
;
(124)
![]() .
(125)
.
(125)
Из уравнений (122)(125) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетический (u= idem) и изоэнталыпийный (h = idem) тождественны и, следовательно, показатели этих процеcсов равны
![]() .
(126)
.
(126)
Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур
=
![]() .
(127)
.
(127)
Изменения удельных значений внутренней энергии и энтальпии идеального газа в процессе в соответствии с законом Джоуля находится по следующим формулам:
![]() ;
(128)
;
(128)
![]() .
(129)
.
(129)
Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
k
=
ns
=
![]() =
=
![]() =
=
![]() =
=
![]() .
(130)
.
(130)
На
основании закона Майера (![]() )
показатель адиабаты для идеального
газа может быть определен из следующего
соотношения:
)
показатель адиабаты для идеального
газа может быть определен из следующего
соотношения:
k
=
![]() =
=![]() >1.
(131)
>1.
(131)
Для
идеального газа показатель изоэнергетического
процесса
![]() и поэтому удельное количество теплоты
в элементарном процессе может быть
определено по формуле
и поэтому удельное количество теплоты
в элементарном процессе может быть
определено по формуле
![]() .
(132)
.
(132)
На примере идеального газа произведем анализ термодинамических процессов (рис.9).
Адиабата
(![]() )
является линией перемены знака
теплообмена. При расширении газа
термодинамическая работа
)
является линией перемены знака
теплообмена. При расширении газа
термодинамическая работа
![]() и тогда любая политропа, расположенная
правее адиабаты (n
<
k),
находится в области подвода теплоты
(
и тогда любая политропа, расположенная
правее адиабаты (n
<
k),
находится в области подвода теплоты
(![]() q
>
0).
Если политропа расширения будет
находиться слева от адиабаты (n
>
k),
то этот процесс будет характеризоваться
отводом теплоты (
q
< 0).
q
>
0).
Если политропа расширения будет
находиться слева от адиабаты (n
>
k),
то этот процесс будет характеризоваться
отводом теплоты (
q
< 0).
Таким образом, все термодинамические процессы, проходящие выше адиабаты осуществляются с подводом теплоты и наоборот.



 =
= =
=
 =
=
 =
=

 =
= =
=