- •Введение
- •Основные понятия и определения
- •Физическое состояние вещества, фазовая диаграмма чистого вещества
- •Законы и уравнение состояния идеальных газов. Уравнения состояния реального газа
- •4. Первое начало термодинамики
- •5. Процессы изменения состояния термодинамических систем
- •6. Круговые процессы (циклы)
- •Второе начало термодинамики
- •8. Смеси жидкостей, паров и газов
- •9. Пары и парообразование
- •10. Истечение жидкостей, паров и газов. Дросселирование
- •11. Процессы сжатия в компрессорах
- •12. Циклы паросиловых установок и холодильных машин
- •13. Циклы двигателей внутреннего сгорания
- •Литература
Физическое состояние вещества, фазовая диаграмма чистого вещества
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое. Рассмотрим диаграмму фазовых состояний чистого вещества (рис.3).
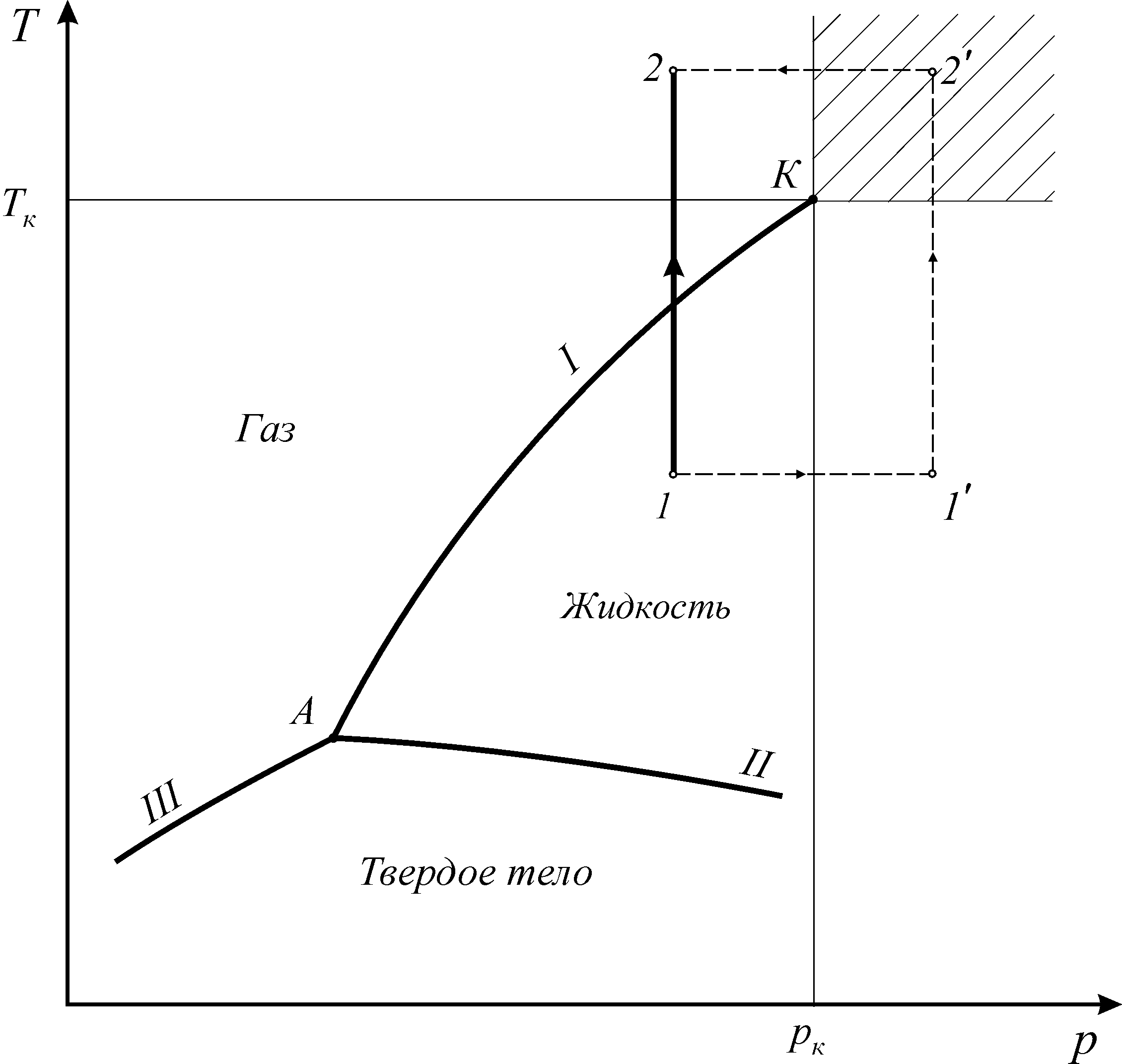
Рис. 3. Диаграмма фазовых состояний чистого вещества
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Фазами системы называются области, ограниченные поверхностями раздела. На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трех агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
Энергетической
границей между жидкостью и паром является
теплота
испарения,
а между твердым телом и жидкостью –
теплота
плавления.
Так как процессы испарения и плавления
протекают при постоянной температуре,
то теплоты испарения, плавления и
сублимации есть теплоты изотермических
превращений. Теплота
фазового перехода
обозначается символом
![]() .
.
Наибольший интерес для проведения технических расчетов в термодинамике представляют газ и жидкость. При увеличении давления термодинамическое различие в их свойствах заметно уменьшается и в критической точке исчезает полностью.
Критические
параметры являются важнейшими
термодинамическими постоянными вещества.
Понятие критической температуры
введено
Д. И. Менделеевым. Критическая
температура
![]() –
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
–
это температура, при которой и выше
которой газ никаким сжатием не может
быть переведен в жидкое состояние.
Критическое давление
![]() –
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние, а критический
объем
представляет
собой максимальный объем данного
количества вещества в жидком состоянии.
–
это такое давление, при котором и выше
которого жидкость невозможно перевести
в газообразное состояние, а критический
объем
представляет
собой максимальный объем данного
количества вещества в жидком состоянии.
В
закритической области (![]() )
вещество может находиться только в
однофазном состоянии. Переход из
состояния 1
в состояние 2
возможен кратчайшим путем по линии 1-2.
Можно этот переход осуществить через
закритическую область, то есть без
изменения агрегатного состояния,
например по линии
)
вещество может находиться только в
однофазном состоянии. Переход из
состояния 1
в состояние 2
возможен кратчайшим путем по линии 1-2.
Можно этот переход осуществить через
закритическую область, то есть без
изменения агрегатного состояния,
например по линии
![]() (рис. 3).
(рис. 3).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому
в принципе, для простых тел (однородных
систем) должно существовать единое
уравнение состояния
![]() ,
описывающее любое однофазное состояние
вещества. Такого уравнения пока еще не
получено. Ниже рассмотрим уравнения
состояния идеальных и реальных газов.
,
описывающее любое однофазное состояние
вещества. Такого уравнения пока еще не
получено. Ниже рассмотрим уравнения
состояния идеальных и реальных газов.
Законы и уравнение состояния идеальных газов. Уравнения состояния реального газа
Идеальные газы
Идеальными называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Законы идеальных газов были установлены в XVII - XIX столетиях исследователями, изучавшими экспериментальным путем поведение газов при давлениях, близких к атмосферному.
Закон Бойля (1662 г.) – Мариотта (1676 г.): произведение абсолютного давления на удельный объем идеального газа при неизменной температуре есть величина постоянная, т.е. произведение абсолютного давления на удельный объем идеального газа зависит только от температуры газа:
при t = idem рv= idem. (24)
Закон Гей Люссака (1802 г.) – относительное расширение идеальных газов при неизменном давлении (p=idem) пропорционально повышению температуры
![]() ,
(25)
,
(25)
при
![]()
![]() ;
;
![]() ,
(26)
,
(26)
где
v
– удельный объем газа при температуре
t
и давлении p;
v0
– удельный объем газа при температуре
t0
= 0 0C;
![]() –
температурный коэффициент объемного
расширения идеальных газов при t0
= 0 0C,
сохраняющий одно и то же значение при
всех давлениях и одинаковый для всех
идеальных газов.
–
температурный коэффициент объемного
расширения идеальных газов при t0
= 0 0C,
сохраняющий одно и то же значение при
всех давлениях и одинаковый для всех
идеальных газов.
Из сопоставления этих законов выводится уравнение состояния идеальных газов - уравнение Клапейрона (1834 г.):
для
1 кг газа
![]() ;
(27)
;
(27)
для
кг газа
![]() ,
(28)
,
(28)
где
![]() – характеристическая постоянная газа;
Т
– абсолютная температура газа
– характеристическая постоянная газа;
Т
– абсолютная температура газа
![]() .
(29)
.
(29)
Продифференцировав
уравнение Клапейрона при постоянном
давлении, получим:
![]()
![]() .
.
Отсюда
![]() .
(30)
.
(30)
Это значит, что характеристическая газовая постоянная (R) – это термодинамическая работа 1 кг газа в изобарном процессе (p= idem) при изменении температуры газа на один градус.
Закон
Авогадро
(1811
г.)
– объем одного киломоля идеального
газа не зависит от его природы и вполне
определяется параметрами состояния
газа
![]() .
.
Молярный объем идеального газа с использованием уравнения Клапейрона определяется из соотношения
![]() ,
(31)
,
(31)
где
![]() Дж/(кмольК)
– универсальная
газовая
постоянная.
Дж/(кмольК)
– универсальная
газовая
постоянная.
Уравнения
состояния для 1
кмоля и для
![]() кмолей идеального газа имеют следующий
вид:
кмолей идеального газа имеют следующий
вид:
для
1
кмоля газа
![]() ;
(32)
;
(32)
для
кмолей газа
![]() .
(32а)
.
(32а)
Эти уравнения называются уравнениями Клапейрона – Менделеева.
Закон Джоуля определяет, что внутренняя энергия идеального газа зависит только от температуры
![]() ;
;
![]() .
(33)
.
(33)
Реальные газы
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния.
Чем точнее уравнение, тем больше (как правило) оно содержит индивидуальных констант. Так, в известном уравнении состояния Ван-дер-Ваальса содержится две константы, а в более точных уравнениях число констант доходит до десяти и более.
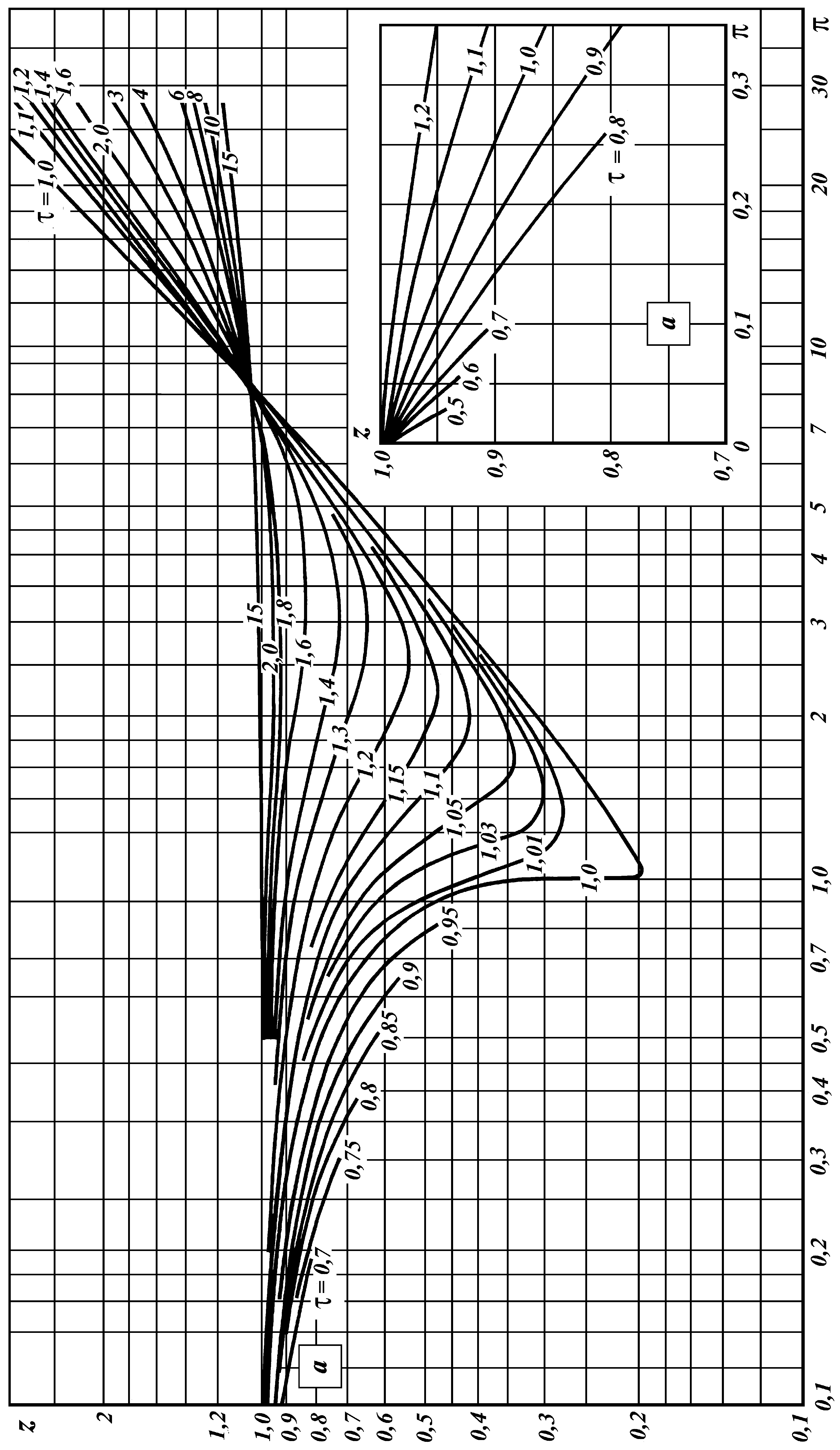
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в него поправочного коэффициента (z), называемого коэффициентом сжимаемости
![]() .
(34)
.
(34)
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Коэффициент сжимаемости является функцией давления, температуры и зависит от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В
критической точке для всех веществ r
= 0,
![]() ,
,
![]() ,
,
![]() .
Вещества находятся в соответственных
состояниях при одинаковом удалении от
критической точки.
.
Вещества находятся в соответственных
состояниях при одинаковом удалении от
критической точки.
Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления
 ;
;приведенной температуры
 ;
;приведенного объема
 .
.
Уравнение
состояния, записанное в виде F
(![]() )
= 0, называется приведенным
уравнением состояния.
Оно не содержит индивидуальных констант
вещества.
)
= 0, называется приведенным
уравнением состояния.
Оно не содержит индивидуальных констант
вещества.
Состояния
вещества, в которых они имеют одинаковые
![]() и
и
![]() называются соответственными. Зная
параметры
и
по данным рис. 4 определяется коэффициент
сжимаемости z.
называются соответственными. Зная
параметры
и
по данным рис. 4 определяется коэффициент
сжимаемости z.