
- •Глава 1. Общие вопросы отбора, консервирования и подготовки проб воды к анализу
- •Питьевая вода и вода для промышленных целей Требования, предъявляемые к воде
- •Питьевая вода
- •Вода для промышленных целей
- •Отбор проб воды и пробоподготовка их к анализу
- •Виды отбора проб
- •Виды проб
- •Оборудование для отбора проб воды
- •Отбор проб воды из различных источников
- •Консервирование проб
- •2.10. Определение цветности воды
- •1. Визуальное определение цветности
- •2. Фотоэлектроколориметрическое определение цветности
- •1. Приготовление растворов.
- •2. Приготовление имитационной шкалы цветности.
- •3. Выбор условий определения.
- •4. Построение градуировочного графика.
- •5. Определение цветности анализируемой воды.
- •2.12. Определение кислорода, растворенного в воде. Бпк
- •1. Калибрование кислородной склянки.
- •2. Определение растворенного кислорода.
- •3. Определение бпк
- •3.1. Определение нитритов в воде.
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2.
- •4. Приготовление серии стандартных растворов.
- •5. Подготовка пробы анализируемой воды.
- •6. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации нитритов в пробе
- •.6. Определение хлоридов в воде
- •1. Определение хлорид ионов в воде методом осаждения
- •2. Определение хлоридов в воде потенциометрическим методом анализа
- •1) Приготовление основного раствора.
- •2) Приготовление серии стандартных растворов.
- •3) Приготовление фонового раствора.
- •4) Измерение эдс стандартных растворов на приборе рН-340
- •5) Построение градуированного графика в координатах
- •6) Определение концентрации хлоридов в пробе воды.
- •7) Таблица результатов
- •3.7. Определение железа в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуировочного графика
- •7. Определение концентрации железа в пробе
- •3.8. Определение хрома в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2
- •4. Приготовление серии стандартных растворов
- •5. Подготовка пробы анализируемой воды
- •6. Выбор условий определения
- •7. Построение градуировочного графика
- •8. Определение концентрации хрома в воде
- •3.10. Определение алюминия в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов.
- •4. Подготовка пробы анализируемой воды.
- •5. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации алюминия в пробе
- •3.14. Определение кальция в воде
- •4.1. Определение фенолов в воде
- •Определение летучих с паром фенолов (определение относительно больших концентраций)
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуированного графика.
- •7. Определение концентрации фенола в воде
1. Калибрование кислородной склянки.
Склянку моют, ополаскивают дистиллированной водой, сушат в сушильном шкафу, охлаждают в эксикаторе и взвешивают на аналитических весах, затем вновь сушат в сушильном шкафу и взвешивают, так повторяют до тех пор, пока масса кислородной склянки не станет постоянной. Затем в кислородную склянку наливают дистиллированную воду, погружают ее в термостат и выдерживают при температуре 20С 15 минут. Кислородную склянку вынимают, вытирают снаружи и взвешивают, затем склянку вновь погружают в термостат. Операцию повторяют 5 раз. Вычисляют среднее значение массы кислородной склянки с дистиллированной водой.
Рассчитывают объем кислородной склянки в мл по формуле:
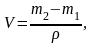
где m1 - масса пустой кислородной склянки, доведенная до постоянной массы, г;
m2 – среднее значение массы кислородной склянки с дистиллированной водой при температуре 20С, г;
– плотность воды при 20С, г/см3 (г/мл)
2. Определение растворенного кислорода.
Рабочий опыт.
В калиброванную кислородную склянку отбирают пробу анализируемой воды доверху, добавляют пипеткой 1 мл MnSO4 следующим способом: наполненную пипетку погружают до самого дна склянки, затем открывают верхний конец и пипетку медленно вынимают. Другой пипеткой прибавляют 3 мл щелочного раствора иодит-иодатной смеси. Кислородную склянку осторожно закрывают так, чтобы под пробкой не образовались пузырьки воздуха. Содержимое хорошо перемешивают, переворачиванием склянки до образования хлопьевидного хорошо выпадающего осадка.
После образования и отстаивания осадка третьей пипеткой прибавляют 5 мл концентрированной соляной кислоты. Кислородную склянку вновь закрывают и переворачиванием перемешивают. Содержимое кислородной склянки оставляют стоять 15 минут. Затем переливают в коническую колбу и ополаскивают склянку дистиллированной водой, сливая ее в ту же колбу.
Выделившийся йод титруют стандартным раствором Na2S2O3·5H2O 0,01н до светло-желтой окраски, затем добавляют 1 мл 1% раствора крахмала и продолжают титрование до обесцвечивание раствора. Записывают общий объем Na2S2O3·5H2O, израсходованный на титрование. Определение повторяют три раза.
Контрольный опыт.
В калиброванную кислородную склянку отбирают пробу анализированной воды доверху, добавляют пипеткой 5мл концентрированной HCl, другой пипеткой приливают 1 мл MnSO4 и третьей пипеткой 3 мл щелочного раствора иодид - иодатной смеси. Кислородную склянку осторожно закрывают так, чтобы под пробкой не образовались пузырьки воздуха. Содержимое хорошо перемешивают переворачиванием склянки и оставляют стоять 15 минут. Затем содержимое кислородной склянки переливают в коническую колбу и ополаскивают склянку дистиллированной водой, сливая ее в ту же колбу.
Выделившийся иод титруют стандартным раствором Na2S2O3·5H2O 0,01н до светло-желтой окраски, затем добавляют 1 мл 1% раствора крахмала и продолжают титрование до обесцвечивания раствора. Записывают общий раствора Na2S2O3·5H2O, израсходованный на титрование. Определение повторяют три раза.
Содержание растворенного кислорода в мгО/л рассчитывают по формуле:
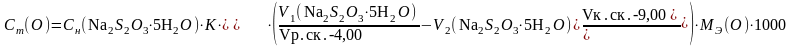
где V1 – объем тиосульфата натрия, израсходованный на титрование рабочей пробы воды, мл;
V2 – объем тиосульфата натрия, израсходованный на титрование контрольной пробы воды, мл;
Сн(Na2S2O3·5H2O) – нормальная концентрация тиосульфата натрия, моль/л;
Vр.ск.- объем рабочей склянки, мл;
Vк.ск.- объем контрольной склянки, мл;
К – поправочный коэффициент к 0,01н раствору Na2S2O3·5H2O;
МЭ(О) – молярная масса эквивалента кислорода, г/моль;
1000 – перевод миллилитров в литры;
Вычисляют среднее значение растворенного кислорода в мгО/л.
