
- •2. Вещество
- •2.1. Виды химической связи: атомная (ковалентная), ионная, металлическая, водородная
- •1) Алканов; 2) альдегидов; 3) спиртов; 4) алкинов.
- •2.2. Способы образования ковалентной связи. Длина и энергия связи. Образование ионной связи
- •2.3. Понятие об электроотрицательности химических элементов. Заряды ионов и степени окисления химических элементов в соединениях
- •2.4. Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток. Зависимость свойств веществ от особенностей их кристаллической решетки
- •1) Алмаз; 2) известняк; 3) кварц; 4) сахароза.
- •1) Фторид натрия; 2) вода; 3) серебро; 4) бром.
- •1) Атомная; 2) молекулярная; 3) ионная; 4) металлическая.
- •2.6. Основные положения и направления развития теории химического строения органических веществ а. М. Бутлерова. Изомерия и гомология органических веществ
- •2.7. Гомологи и изомеры углеводородов
- •Структурная изомерия.
- •Пространственная изомерия.
- •2.9. Общая характеристика металлов главных подгрупп I–III групп в связи с их положением в периодической системе химических элементов д. И. Менделеева и особенностями строения их атомов
- •2.10. Медь, хром, железо – металлы побочных подгрупп
- •1) Оксид хрома (II) 2) оксид хрома (III) 3) оксид хрома (VI) 4) хром
- •2.11. Общая характеристика неметаллов ivа–viiа групп в связи с их положением в периодической системе химических элементов д. И. Менделеева и особенностями строения их атомов
- •1) Железо 2) хром 3) медь 4) цинк
- •2.12. Характерные химические свойства неорганических веществ различных классов: оксидов (основных, амфотерных, кислотных), оснований, амфотерных гидроксидов, кислот, солей
- •1. Оксиды
- •1) Кислотами 2) водой 3) водородом 4)кислотными оксидами.
- •1) Металлами 3) солями 2) оксидами металлов 4) щелочами.
- •2.13. Взаимосвязь неорганических веществ
- •2.15. Виды гибридизации электронных облаков
Пространственная изомерия.
Конфигурационная изомерия.
Геометрическая изомерия. Характерна для соединений, имеющих в составе молекулы двойную связь или цикл и около них одинаковые атомы или группы атомов. Примеры:
СН3–СН=СН–СН3 бутен-2. Для этого вещества характерны два геометрических изомера:

цис-бутен-2 транс-бутен-2
Для циклопропандикарбоновой кислоты также характерны два геометрических изомера:
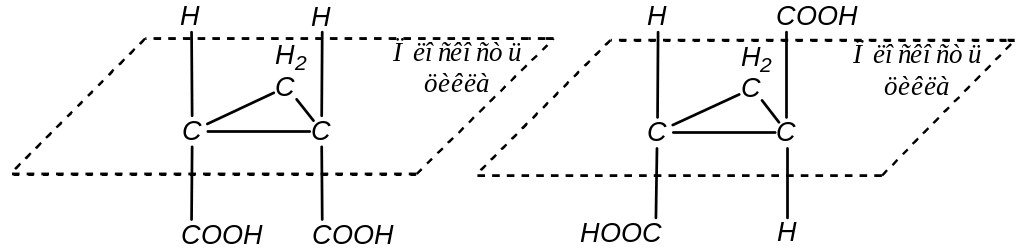
цис-циклопропандикарбоновая кислота транс-циклопропандикарбоновая кислота
Могут быть и другие виды пространственной изомерии, не рассматривающиеся в школьном курсе химии.
Таутомерия – вид изомерии, при которой одно и то же вещество существует в виде нескольких форм, находящихся в состоянии динамического равновесия. Примеры:
1). Кольчато-цепная таутомерия глюкозы:
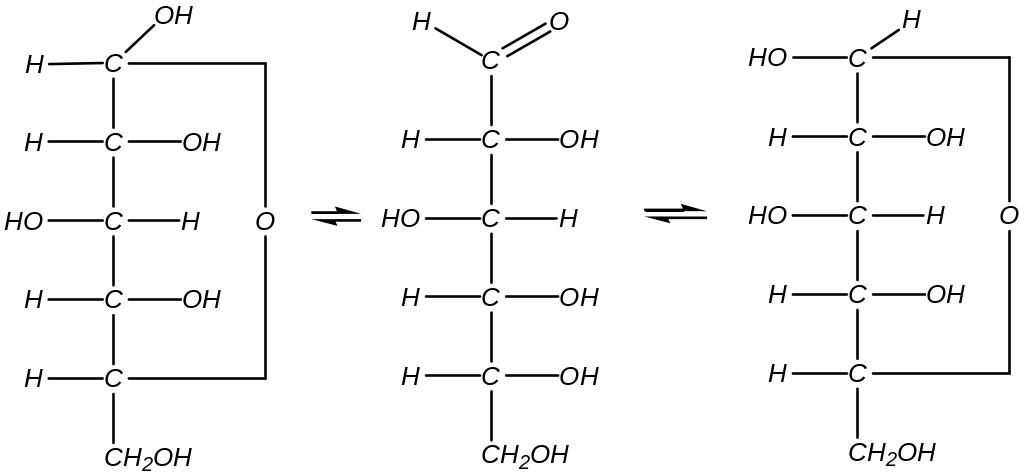
-глюкоза открытая, альдегидная форма глюкозы -глюкоза
2). Кето-енольная таутомерия (енолы – это соединения, содержащие в молекулах гидроксильную группу и двойную связь):
![]() ⇄
⇄ ![]()
виниловый спирт (енольная форма) уксусный альдегид (кетоформа);
![]() ⇄
⇄ ![]()
кетоформа пептидной связи енольная форма пептидной связи
Задания для самостоятельной работы
2.28. Какое из утверждений соответствует теории А. М. Бутлерова?
1) Строение вещества определяет его свойства;
2) все вещества имеют постоянный качественный и количественный состав;
3) все вещества состоят из молекул;
4) органические вещества образуются только в природе.
2.29. Углерод в органических соединениях проявляет валентность: 1) I; 2) II; 3) III; 4)IV.
2.30. Многообразие углеводородов объясняется тем, что атомы:
1) углерода могут иметь любую степень окисления от –4 до +4;
2) углерода могут образовывать устойчивые цепи;
3) водорода могут иметь любую степень окисления от –1 до +1;
4) водорода могут образовывать устойчивые цепи.
2.31. Число структурных изомеров состава С4Н8 равно: 1) 5; 2)2; 3) 3; 4) 4.
2.32. Установите соответствие между структурной формулой вещества и названием его гомологического ряда.
ФОРМУЛА ВЕЩЕСТВА ГОМОЛОГИЧЕСКИЙ РЯД
1) С6Н5–СН2–СН3 А) алкадиены
2) СН2–С(СН3)2–СН2–СН3 Б) алканы
3) СН2=С=СН–СН3 В) арены
4) СН3–С≡С–СН3 Г) алкены
Д) алкины
2.33. К структурным изомерам относятся:
1) бензол и циклогексан 3) пентен-1 и циклопентан
2) этаналь и диметиловый эфир 4)аминобензол и анилин
2.34. Гомологами являются:
1) метан и пропан 3) бутен-1 и бутадиен-1,3
2) бутин-1 и бутен-1 4) этан и циклопропан
2.9. Общая характеристика металлов главных подгрупп I–III групп в связи с их положением в периодической системе химических элементов д. И. Менделеева и особенностями строения их атомов
Металлы. Положение металлов в периодической системе химических элементов Д. И. Менделеева
Если в периодической системе элементов провести диагональ от Ве к Аt, то справа вверх от диагонали будут находиться элементы-неметаллы (исключая элементы побочных подгрупп), а слева внизу – элементы-металлы (к ним же относятся элементы побочных подгрупп). Элементы, расположенные вблизи диагонали (например, Ве, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером, хотя по физическим свойствам относятся к металлам. Это переходные металлы.
Таким образом, к элементам-металлам относятся s-элементы I и II групп (кроме Н), все d- и f-элементы, а также р-элементы III группы (кроме В), IV группы (Ge, Sn, Pb), V группы (Sb, Bi) и VI группы (Ро). Как видно, наиболее типичные элементы-металлы расположены в начале периодов (начиная со второго).
Строение атомов металлов. Металлическая связь
Металлическая связь – это связь в металлах.
Атомы большинства металлов на внешнем электронном слое содержат небольшое число электронов, поэтому у них имеется избыток валентных атомных орбиталей (АО) и недостаток электронов. Например, у атома натрия:
Na
При сближении атомов валентные АО соседних атомов перекрываются, благодаря чему электроны свободно перемещаются от одного атома к другому, осуществляя связь между всеми атомами кристалла по обменному механизму.
Кроме того, атомы металла, катионы (образовавшиеся в результате «перехода» электрона к другому атому) и электроны удерживаются за счет сил электростатического притяжения (электростатический механизм).
Металлическая связь сильно делокализована, т.е. не закреплена между отдельными атомами, как ковалентная и ионная. Она определяет свойства металлов.
Кристаллическая решетка металлов называется металлической.
Физические свойства металлов
Физические свойства металлов можно разделить на 2 группы – общие свойства и свойства, по которым металлы различаются:
№ п/п |
Свойство |
Причины проявления свойства |
Примеры. Исключения |
I. Общие свойства |
|||
1 |
Металлический блеск |
Наличие «свободных» электронов (отражают фотоны – частицы (кванты) света) |
Наибольшая отражательная способность у Ag и In. Они используются для изготовления зеркал, рефлекторов в оптических приборах и т. д. Al и Mg отражают радиоволны, используются в радиолокации |
2 |
Непрозрачность |
|
|
3 |
Серебристо-белый цвет |
Исключения: Cu – красная, Au – желтое, Bi – имеет красноватый оттенок |
|
4 |
Металлы – твердые вещества |
Тип связи |
Исключение – Hg, ее Тпл. = –39оС |
5 |
Пластичность |
Пластичность металлов уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe. Au можно прокатывать в листы толщиной не более 0,003 мм |
|
6 |
Электрическая проводимость |
Электрический ток – направленное движение заряженных частиц (электронов) |
Электрическая проводимость убывает в ряду Ag, Cu, Au, Al, Mg, Zn, Fe, Pb, Hg. С повышением температуры электрическая проводимость металлов уменьшается. Вблизи 0К наблюдается явление сверхпроводимости |
7 |
Теплопроводность |
Высокая подвижность «свободных» электронов и колебательные движения атомов |
Наибольшая теплопроводность – у Ag и Cu, наименьшая – у Bi и Hg |
II. Свойства, по которым металлы различаются |
|||
1 |
Плотность |
Чем меньше атомная масса и чем больше радиус атомов, тем меньше плотность |
Самый легкий металл – Li ( = 0,53 г/см3), самый тяжелый – Os ( = 22,6 г/см3). Металлы с < 5 г/см3 называются легкими, остальные – тяжелыми |
2 |
Температуры плавления и кипения |
Различная прочность химической связи между атомами |
Самый легкоплавкий металл – Hg; Тпл.(Cs) = 29оС; Тпл.(Ga) = 29,8оС. Самый тугоплавкий металл – W (Тпл. = 3390оС). Металлы, Тпл. которых больше 1000оС – тугоплавкие, остальные – легкоплавкие |
3 |
Твердость |
|
Самый твердый металл – Сr (царапает стекло), самые мягкие – щелочные металлы и In (режутся ножом) |
4 |
Отношение к магнитным полям |
– ферромагнитные – способны намагничиваться при действии слабых магнитных полей; |
Fe, Co, Ni, Gd |
– парамагнитные – проявляют слабую способность к намагничиванию; |
Al, Cr, Ti, большинство лантаноидов |
||
– диамагнитные – не притягиваются к магниту или отталкиваются от него |
Bi, Sn, Cu |
||
Основные способы получения металлов
Отрасль промышленности, производящая металлы, и наука о промышленных способах получения металлов и сплавов из природного сырья называются металлургией.
Горные породы, содержащие самородные металлы и соединения, пригодные для промышленного производства металлов, называются металлическими рудами. Различают руды:
оксидные (простые: рутил ТiО2, пиролюзит МnО2, касситерит SnО2 и др.; сложные: магнетит Fе3О4, хромит Fе(СrО2)2 и др.);
карбонатные (магнезит МgСО3, сидерит FеСО3, малахит (СuОН)2СО3 и др.);
сульфидные (пирит FеS2, халькопирит СuFеS2, сфалерит ZnS, галенит PbS и др.);
галогенидные (галит NaCl, сильвин KCl, карналлит KClMgCl26Н2О и др.).
Металлургия – сложное производство, в котором можно выделить 4 основные стадии:
1 стадия |
Подготовка металлических руд:
|
2 стадия |
Собственно металлургический процесс – восстановление металла методами:
|
3 стадия |
Очистка металлов от вредных примесей:
|
4 стадия |
Обработка полученного металла:
|
Основной процесс металлургии – восстановление металлов из соединений – можно выразить уравнением: Меn+ + nе = Ме0.
Частные случаи восстановления:
I. Восстановление металлов из руд при высокой температуре называют пирометаллургией. В пирометаллургии выделяют:
1. Восстановление металлами (металлотермия). Например:
3Fе3О4 + 8Аl = 9Fе + 4Аl2О3 (алюминотермия);
ТiСl4 + 2Мg = Тi + 2МgСl2 (магниетермия).
2. Восстановление неметаллами и их соединениями – коксом, водородом, оксидом углерода (II), метаном. Например:
РbО + С = Рb + СО;
3Fе2О3 + СО = 2Fе3О4 + СО2 |
доменный процесс |
Fе3О4 + СО = 3FеО + СО2 |
|
FеО + СО = Fе + СО2 |
WО3 + 3Н2 = W + 3Н2О.
II. Электрометаллургией называют получение металлов электролизом расплавов (для наиболее активных) или растворов солей. Например:
MgCl2(расплав)
![]() Mg
+ Cl2; CuCl2(р-р)
Cu
+ Cl2.
Mg
+ Cl2; CuCl2(р-р)
Cu
+ Cl2.
III. Гидрометаллургией называют метод выделения металлов из растворов, включающий предварительную обработку руды тем или иным реагентом для перевода металла в раствор. Например, руду, содержащую карбонат гидроксомеди (II) (СuОН)2СО3 (малахит) обрабатывают раствором серной кислоты: (СuОН)2СО3 + 2Н2SО4 = 2СuSО4 + 3Н2О + СО2.
Из полученного раствора металл выделяют либо электролизом, либо действием металлического железа: Fе + СuSО4 = Сu + FеSО4.
В гидрометаллургии возможна подземная переработка руд, при которой жидкий реагент закачивается в пласт через одну скважину, а через другую на поверхность выкачивается раствор соли металла.
Химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы (катионы). Поэтому металлы являются восстановителями.
1. Окисление ионами водорода Н+ (взаимодействие с кислотами):
Zn + 2HCl ZnCl2 + H2;
Zn – 2e Zn2+ – восстановитель; 2Н+ + 2е Н2 – окислитель.
Обратите внимание! С азотной и концентрированной серной кислотами металлы реагируют по-другому.
2. Окисление водой: 2Na + 2H2O 2NaOH + H2;
Na – 1e Na+ – восстановитель; 2H2O + 2e 2OH– + Н2 – окислитель.
3. Окисление ионами других металлов (взаимодействие с водными растворами солей менее активных металлов): Fe + CuSO4 FeSO4 + Cu;
Fe – 2e Fe2+ – восстановитель; Cu2+ + 2e Cu – окислитель.
4. Окисление растворами щелочей (для переходных металлов):
Zn + 2NaOH + 2H2O Na2[Zn(OH)4] + H2
5. Взаимодействие с неметаллами:
– с кислородом: 2Mg + O2 2MgO
– с хлором: 2Fe
+ 3Cl2
![]() 2FeCl3
2FeCl3
– с серой: Fe + S FeS
– с азотом при нагревании: 3Mg + N2 Mg3N2 (Li реагирует с N2 при комнатной температуре)
– с фосфором: 3Ca + 2P Ca3P2
Мерой активности металлов является ряд стандартных электродных потенциалов (ряд напряжений) металлов.
Ряд стандартных электродных потенциалов металлов
Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов – это последовательность, в которой металлы располагаются в порядке убывания их восстановительной способности по отношению к ионам, находящимся в растворах.
По-другому, ряд напряжений – это ряд металлов, составленный по возрастанию алгебраического значения их стандартных электродных потенциалов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Ni, Sn, Pb, H, Bi, Sb, Cu, Hg, Ag, Pt, Au.
Прообразом ряда напряжений был «вытеснительный ряд» Н. Н.Бекетова (1899 г.).
Стандартным электродным потенциалом называется разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л и стандартным водородным электродом, потенциал которого принимается равным 0 В. Металлы до водорода имеют отрицательные значения стандартных электродных потенциалов, а после водорода – положительные. Электродные потенциалы щелочных и щелочноземельных металлов рассчитываются теоретически, т.к. эти металлы в водных растворах реагируют с водой.
Чем левее расположен металл в ряду напряжений, тем он активнее, тем более сильным восстановителем он является, тем труднее восстановить до металла его катион.
Положение металлов в электрохимическом ряду не соответствует изменению активности металлов в группах и периодах периодической системы.
Начинает ряд напряжений литий, в то же время по периодической системе калий активнее лития. Объяснить это несоответствие можно так. При сравнении металлической активности в группах анализируют энергии ионизации металлов в вакууме: тот металл более активен, у которого энергия ионизации атомов меньше. В электрохимическом ряду металлы расположены в порядке уменьшения активности, т.е. увеличения энергии ионизации, но не в вакууме, а в водных растворах. Если в вакууме образование катиона заканчивается отрывом электрона от атомов металлов, то в водном растворе образовавшиеся катионы гидратируются, что сопровождается выделением энергии. Следовательно, энергия ионизации атома в растворе включает сумму двух величин: энергии ионизации (затрата энергии) и энергии гидратации (выделение энергии). Энергия гидратации катиона тем больше, чем больше заряд и меньше радиус при одинаковом заряде. Радиус иона лития меньше радиуса иона калия. Расчеты показывают, что на отрыв электрона от атома лития затрачивается меньше энергии, чем на отрыв электрона от атома калия. Поэтому литий в этих условиях оказывается активнее калия.
На основании ряда напряжений можно сделать некоторые важные выводы о химической активности металлов.
Каждый металл вытесняет из растворов солей другие металлы, стоящие за ним в ряду напряжений.
Металлы, стоящие в ряду напряжений до водорода способны вытеснять водород из растворов кислот (кроме азотной).
Металлы от лития по натрий включительно быстро окисляются кислородом воздуха при обычной температуре; металлы от магния по ртуть включительно медленно окисляются кислородом воздуха при обычной температуре или окисляются при нагревании; остальные металлы не окисляются кислородом воздуха.
Металлы от лития по натрий включительно взаимодействуют с водой при обычной температуре с образованием соответствующего гидроксида и водорода; металлы от магния до водорода взаимодействуют с водой при нагревании с образованием соответствующего оксида и водорода; остальные металлы водород из воды не вытесняют.
Самые активные металлы (от лития по натрий включительно) в любых водных растворах взаимодействуют прежде всего с водой.
На экзаменах типичной ошибкой абитуриентов является написание уравнений реакций вытеснения щелочным или щелочноземельным металлом менее активного металла из растворов солей (например, СuSО4 + + 2Nа = Nа2SО4 + Сu).
На практике натрий взаимодействует с водой, а затем полученная щелочь реагирует с сульфатом меди (II) с образованием осадка гидроксида меди (II) голубого цвета.
Очень часто абитуриенты пишут уравнения реакций щелочных и щелочноземельных металлов с соляной кислотой. Но т.к. соляная кислота содержит максимум 37% хлороводорода, эти металлы взаимодействуют с водой, а образовавшаяся щелочь нейтрализует кислоту.
Нитраты металлов от лития по натрий включительно разлагаются при нагревании с образованием нитритов и кислорода: 2NаNО3 = 2NаNО2 + О2;
Нитраты металлов от магния по медь включительно разлагаются при нагревании с образованием оксида металла, оксида азота (IV) и кислорода: 2Рb(NО3)2 = 2РbО + 4NО2 + О2;
Нитраты остальных металлов разлагаются при нагревании с образованием металла, оксида азота (IV) и кислорода: 2АgNО3 = 2Аg + 2NО2 + О2.
6. По ряду напряжений определяют последовательность восстановления металлов на катоде при электролизе растворов. (См. соответствующий раздел).
Расплавам солей соответствует другой вытеснительный ряд: Cs, Rb, K, Na, Li, Ba, Sr, Ca, Mg, Be, Al, Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pb, Cu, Ag, Hg, Au.
Задания для самостоятельной работы
2.35. Бериллий и магний не относятся к щелочноземельным металлам, так как:
1) свойства их гидроксидов отличаются от свойств гидроксидов щелочноземельных металлов;
2) являются переходными элементами;
3) относятся к неметаллам;
4) имеют небольшое число электронных слоев.
2.36. В схеме
превращений Na
![]() X1
X1
![]() X2
X2
![]() X3 веществами Х1,
Х2, Х3 являются соответственно:
X3 веществами Х1,
Х2, Х3 являются соответственно:
1) Na2O, Na2SO4, NaOH; 3) Na2O, Na2SO4, BaSO4;
2) Na2O2, NaOH, BaSO4; 4) NaOH, Na2SO4, BaSO4;
2.37. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Zn → ZnSO4 → Zn(NO3)2 → Zn(OH)2 → Na2[Zn(OH)4] → ZnCl2.
2.38. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Al→Al2(SO4)3→Al2O3→AlCl3→Na[Al(OH)4]→Al(OH)3
