
- •Молекулярная физика и термодинамика
- •1.1. Опытные законы идеальных газов
- •1.3. Основное уравнение кинетической теории газов
- •1.4. Средняя длина свободного пробега молекул
- •1.5.1.1. Диффузия газов
- •1.5.1.2. Теплопроводность газов
- •1.5.1.3. Внутреннее трение (вязкость) газов
- •1.5.2. Явление переноса в жидкостях
- •2. Основные понятия и законы термодинамики
- •4. Адиабатический процесс.
1.5.2. Явление переноса в жидкостях
М олекулы
жидкости расположены, в отличие от
молекул газа, близко друг к другу и
взаимодействуют друг с другом. Между
молекулами располагаются микрополости.
Молекула жидкости колеблется около
положения равновесия некоторое время
,
затем она “перескакивает” на расстояние
порядка среднего расстояния
между соседними молекулами. Среднее
время
нахождения молекулы около положения
равновесия (время релаксации) зависит
от температуры, уменьшаясь с ее
увеличением. Средняя скорость перемещения
молекул жидкости v
=
олекулы
жидкости расположены, в отличие от
молекул газа, близко друг к другу и
взаимодействуют друг с другом. Между
молекулами располагаются микрополости.
Молекула жидкости колеблется около
положения равновесия некоторое время
,
затем она “перескакивает” на расстояние
порядка среднего расстояния
между соседними молекулами. Среднее
время
нахождения молекулы около положения
равновесия (время релаксации) зависит
от температуры, уменьшаясь с ее
увеличением. Средняя скорость перемещения
молекул жидкости v
=
![]() невелика (значительно меньше, чем
скорость молекул газа при той же
температуре).
невелика (значительно меньше, чем
скорость молекул газа при той же
температуре).
В жидкостях, как и газах, в случае появления пространственной неоднородности плотности, температуры или скорости упорядоченного движения молекул, возникают явления переноса – диффузия, теплопроводность и внутреннее трение. Явления переноса в жидкостях, как и в газах, обусловлены тепловым движением молекул и подчиняются тем же законам Фика, Фурье и Ньютона.
Особенности строения жидкости и теплового движения их молекул сказываются на значениях коэффициентов переноса и на их зависимости от параметров состояния.
Коэффициент диффузии D жидкостей возрастает с увеличением температуры, что связано с сокращением времени релаксации и некоторым увеличением среднего расстояния между положениями равновесия.
Процесс теплопроводности в жидкостях осуществляется путем взаимодействия колеблющихся молекул. Так как молекулы жидкости расположены близко друг к другу, то коэффициент теплопроводности у них значительно больше, чем у газов.
Механизм внутреннего трения у жидкостей отличен от газов. Молекулы жидкостей большую часть времени находятся около положения равновесия, поэтому масса жидкости увлекает соседние слои, в основном, за счет сил сцепления. Коэффициент внутреннего трения у жидкостей с ростом температуры резко уменьшается. Вязкость жидкости во много раз больше, чем вязкость газа.
2. Основные понятия и законы термодинамики
Величины, характеризующие состояние газа, называются параметрами состояния. К ним относятся давление р, температура Т, объем V.
Внутренняя энергия U системы молекул складывается из энергии хаотического движения молекул (поступательного и вращательного), а также колебательного движения атомов в молекулах, потенциальной энергии, обусловленной взаимодействием молекул. Энергию электронных оболочек атомов и ионов, а также энергию движения и взаимодействия нуклонов в атомных ядрах не включают в понятие внутренней энергии тела, так как эта энергия не изменяется в процессах, не связанных с химическими реакциями и другими превращениями электронных оболочек атомов и ионов, с ядерными реакциями.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется только кинетической энергией движения всех его молекул.
Средняя энергия движения одной молекулы
= k T ,
где i – число степеней свободы молекул, k – постоянная Больцмана.
Внутренняя энергия идеального газа есть сумма энергий движения всех молекул
U =
![]() = N
=
NA
=
= N
=
NA
=
![]() NA
,
NA
,
где N – число молекул в газе, NA – число Авогадро, – число молей газа,
m – масса газа, – молярная масса газа.
Тогда U = k NA T = R T ,
где R – универсальная газовая постоянная.
Изменение внутренней энергии идеального газа
dU
=
![]() R
dT
,
R
dT
,
где dT – изменение температуры газа,
или
U
=
![]() =
R
T.
=
R
T.
Изменить состояние тела можно передавая энергию от одного тела термодинамической системы4 к другому. Передача энергии может происходить двумя качественно различными способами: путем совершения работы А или путем передачи теплоты Q.
Работа – есть мера изменения механической энергии при силовом воздействии между телами. Совершение работы всегда сопровождается перемещением тела или его макроскопических частей.
Энергия, переданная от одного тела к другому путем теплообмена, называется теплотой, отданной одним телом другому.
Элементарная работа A, совершающаяся при расширении газа на dV, рассчитывается по формуле
A = p dV ,
а работа, совершающаяся при расширении газа от V1 до V2 , по формуле
А =
 ,
,
где р – давление, которое производится на газ внешними силами (внешнее давление); V1 , V2 – начальный и конечный объем газа.
Теплоемкости идеальных газов
Для определения количества теплоты Q, переданного термодинамической системе для изменения ее температуры, введем понятия теплоемкостей. В зависимости от способа измерения количества вещества в системе подразделяют удельную теплоемкость, молярную теплоемкость и теплоемкость.
Удельной теплоемкостью называется физическая величина с, численно равная теплоте Q, которую сообщают единице массы однородного тела для повышения его температуры на dT.
c =
![]()
![]() .
.
Молярной теплоемкостью называется физическая величина С, численно равная теплоте Q, сообщенной одному молю вещества для изменения его температуры на dT.
C =
![]() .
.
где = – число молей.
Очевидно, что С = m c .
Теплоемкостью тела (системы) называется физическая величина, численно равная теплоте Q, которую сообщают всему телу (системе) для повышения его температуры на dT,
С = .
Tогда С = c m и С = С .
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Существование двух способов передачи энергии термодинамической системе позволяет закон сохранения энергии представить в виде
U = A' + Q ,
где U – изменение внутренней энергии, A' – работа, совершенная над системой внешними силами, Q – переданная системе теплота,
или Q = U + A ,
где А = – A’ – работа, совершаемая самой системой против внешних сил.
Отсюда вытекает следующая формулировка первого начала термодинамики: теплота, переданная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил. Первое начало термодинамики записывают также для изменения состояния системы, вызванного сообщением ей малой теплоты Q, совершением ей малой (элементарной) работы A и приводящего к малому изменению внутренней энергии dU
Q = dU + A .
Обратим внимание на различие в записях малых величин (Q, dU, A).
Внутренняя энергия является однозначной функцией состояния термодинамической системы, т.е. значение внутренней энергии в каком-либо произвольно выбранном состоянии не зависит от способа перевода ее в это состояние. Изменение внутренней энергии dU представляет собой полный дифференциал. Работа и теплота не являются функциями состояния и поэтому Q, A не являются полными дифференциалами.
Применение I начала термодинамики
Рассмотрим применение I начала термодинамики к изопроцессам, а также к адиабатическому процессу идеальных газов.
1. Изохорный процесс (V = const).
Элементарная работа, совершаемая газом
А = p dV.
Так как V = const, то А = 0.
Для элементарного количества теплоты Q из I начала термодинамики
Q = dU = R dT,
или Q = U = R T,
т.е. при изохорном процессе вся подводимая к газу теплота затрачивается на увеличение внутренней энергии газа,
Удельная теплоемкость при постоянном объеме
cv
=
=
![]() =
=
![]() ,
,
Cv = = = R .
Количество теплоты для изохорного процесса можно представить в виде
Q = Cv dT = сv m dT = R dT
или Q = Cv T = сv m T = RT.
2. Изобарный процесс (р = const).
Элементарная работа, совершаемая газом
А = p dV .
С учетом уравнения Менделеева–Клапейрона
А =
p
dV
=
![]() R
dT
.
R
dT
.
Работа, совершаемая газом при увеличении объема от V1 до V2
А =
 = p (V2
– V1)
= p V
=
R
T.
= p (V2
– V1)
= p V
=
R
T.
Первое начало термодинамики можно представить в виде
Q
= cv
m
dT
+
R
dT
=
![]() R
dT
+
R
dT
=
R
dT
+
R
dT
=
![]() R
dT.
R
dT.
Q = cv m T + R T = R T + R T = R T.
Удельная теплоемкость при постоянном давлении
cр
=
=
![]() ,
,
Cр
=
=
![]() R
.
R
.
Количество теплоты для изохорного процесса можно представить в виде
Q
= Cp
dT
= сp
m
dT
=
![]() R
dT
R
dT
или Q = Cp T = сp m T = RT.
3. Изотермический процесс (Т = const)
При изотермическом процессе внутренняя энергия газа, зависящая от температуры, не изменяется, т.е.
dU = 0,
и I начало термодинамики имеет вид
Q = A
или Q = A .
Теплота, подводимая к газу при изотермическом процессе, расходуется на совершение работы газом.
Элементарная работа, совершаемая газом
А = p dV
или
А =
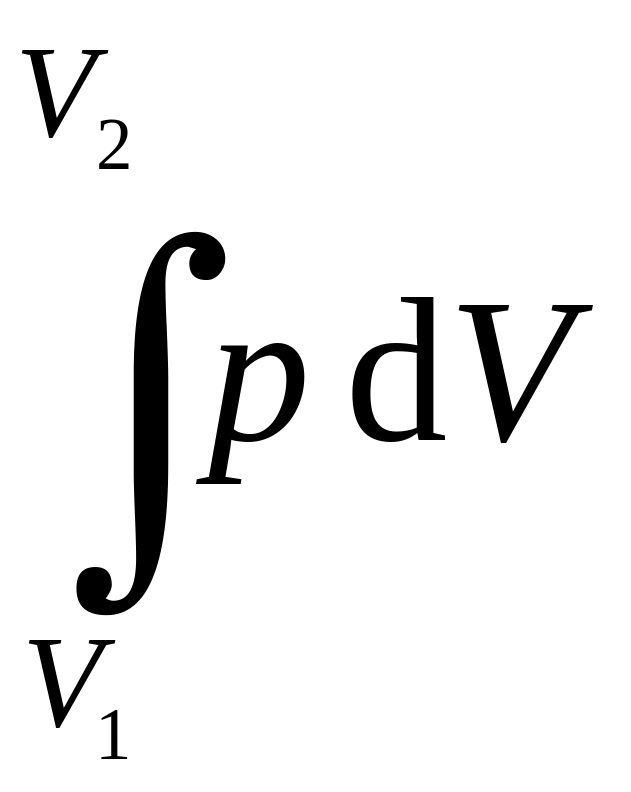 .
.
Учитывая уравнение Менделеева–Клапейрона, получим
А =
R
Т
![]() .
.
Работа газа при изотермическом расширении от V1 до V2
А =
![]() R
Т
R
Т
![]() =
R
Т ln
=
R
Т ln![]() .
.
Количество теплоты для изотермического процесса
Q = R Т ln .
