
Шпоры по химии / Вопрос 1 Предмет и задачи химии
.doc
Вопрос 1 «Предмет и задача химии. Значение химии»
Химия — наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях. В зависимости от атомарной природы изучаемого вещества, типов химических связей между атомами различают неорганическую, органическую и элементоорганическую химии. Объектом неорганической химии являются все химические элементы и их соединения, другие вещества на их основе. Органическая химия изучает свойства обширного класса соединений, образованных посредством химических связей углерода с углеродом. Химия является общетеоретической дисциплиной. Она призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способах превращения одних веществ в другие. Знание основных химических законов, владение техникой химических расчетов, понимание возможностей, предоставляемых химией с помощью других специалистов, работающих в отдельных и узких ее областях, значительно ускоряют получение нужного результата в различных сферах инженерной и научной деятельности.
Химическая отрасль — одна из важнейших отраслей промышленности в нашей стране. Производимые ею химические соединения, различные композиции и материалы применяются повсюду: в машиностроении, металлургии, сельском хозяйстве, строительстве, электротехнической и электронной промышленности, связи, транспорте, космической технике, медицине, быту, и др. Главными направлениями развития современной химической промышленности являются: производство новых соединений и материалов и повышение эффективности существующих производств.
Для инженера:1)фундаментальные знания (любой процесс можно свести к физико-химии, мировоззренческий аспект, научное мировоззрение Игорь Кио.) 2)химические материалы3)хим методы в технологиях в самых разных процессах 4)электрохимич. размерная обработка, Электролитич. осаждение металлов, газотермическое покрытие.
Хим.элемент. – вид атомов с одинаковым зарядом ядер. атом-наименьшая частица химического элемента, сохран все его свойства. молекула-наим. частица индивидуального вещества, способную к самост. существованию.колич вещ.-это число структурных элементов в сиситеме.моль-кол.вещ. системы кот содержит столько определенных структурных элементов,сколько атомов в 0,012кг углерода.-12.
2.в 1897 Дж.Томсон открыл электрон а в 1909 Р.Малликен определил его заряд,кот равен 1,6*10-19Кл.масса составляет 9,11*10-28г.в 1904 Дж.Томсон предложил мод строения атома,согласно кот атом можно представить в виде положит заряженной сферы с электронами..1910 Э. Резерфорд в опытах по рассеянию а-частиц было показано, что почти вся масса атома сосредоточена в очень малом объеме — положительно заряженном ядре.предсказал существование протона и его массу.
Резер.предложил ядерную планетарную модель атома,состоящ из тяжелого ядра,вокруг кот двигаются по орбитам электроны.как показывает теория электромагнитного поля,электроны в этом случае должны двиг по спирали,излучая энергию и падать на ядро.
Н. Бор исходил из планетарной модели атома. Вывод: энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т.е. дискретно.
Постулаты Бора:
1 ℮ может вращаться вокруг ядра не по любым, а только по конкретным круговым орбитам. Эти орбиты получили название стационарных.
2 двигаясь по стационарной орбите, ℮ не излучает электромагнитной энергии.
3 излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна, разности энергии атома в конечном и исходном состояниях. Т.е. энергия электрона, вращающегося вокруг ядра, зависит от радиуса орбиты.
3. Орбиталь – область пространства, где наиболее вероятно нахождение электрона.
Главное квантовое число (n) – характеризует энергетический уровень. Определяет энергию и размеры электронных орбиталей.чем больше n тем выше энергия.
Орбитальное квантовое число (l) – определяет форму атомной орбитали. Характеризует энергетические подуровни в электронной оболочке атома. (s – 0 сферическая форма; p – 1 гантель; d – 2; f – 3).
Квантовые числа- нужны для того чтобы определяет местоположение электронное окно ядерного пространства.
Магнитное квантовое число (m) – характеризует ориентацию орбитали в пространстве. (от –l до +l)в отсутствии внешнего магнитного поля все орббитали одного подуровня имеют одинаковое значение энергии,под воздействием происходит расщепление энергии подоболочек.
Спиновое квантовое число (s) – собственный механический момент движения электрона. (+1/2 - ; -1/2 - )
д![]() войственная
природа электрона математически
выражается ур Шредингера. в этом уравнении
представлены параметры выражающие
электрон как частицу(масса, энергия
покоя) и как поле(плотность
вероятности,энергия)..при решении ур Ш
появляются некоторые контанты кот дают
информацию об электроне как о веществе
и о поле (форма орбитали,энергия электрона
на уровне и подуровне).1926
вывел математическое описание поведения
электрона в атоме.
войственная
природа электрона математически
выражается ур Шредингера. в этом уравнении
представлены параметры выражающие
электрон как частицу(масса, энергия
покоя) и как поле(плотность
вероятности,энергия)..при решении ур Ш
появляются некоторые контанты кот дают
информацию об электроне как о веществе
и о поле (форма орбитали,энергия электрона
на уровне и подуровне).1926
вывел математическое описание поведения
электрона в атоме.
4.в 1905 г.Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами.из теории эйнна следует, что свет имеет двойственную природу.1924 Луи де Бройль выдвинул предположение, что электрон также характеризуется корпускулярно волновым дуализмом.де Бройль предложил уравнение, связывающее длину волны λ электрона или любой частицы с массой m и скоростью v. λ = h/(mv) волны частиц назвал материальными.в 1927 году Гейзенберг постулировал принцип неопределенности: положение и импульс движения субатомной частицы принципиально невозможно определить в любой момент времени с абсолютной точностью.
5.правило Гунда: заполнение орбиталей одной подооблочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. после того как одиночные электроны займут все орбитали в данной подоболочке заполняются орбитали вторыми электронами с противоположными спинами.
Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания числа n.Соответственно этому правилу подоболочки выстраиваются в следущий ряд 1s<2s<3s<3p<4s~3d<4p<5s~4d<5p<6s~5d~4f<6p<7s исключение составляют d и f элементы с полностью заполненными оболочками, у которых наблюдается так называемый провал электронов изза формирования симметричных электронных конфигураций.
6.в 1869 году Д.И.Менделеев: свойство элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Период – это совокупность элементов с одинаковым значением энергии.
Группа – вертикальный ряд элементов имеющих одинаковое число электронов на внешнем эл. слое.
Заряд ядра равен порядковому номеру элемента в системе. Элементы образуют 7 периодов. В периодах свойства элементов закономерно изменяются при переходе от щелочных металлов к благородным газам. Вертикальные столбцы это группы элементов сходных по свойствам. Внутри групп свойства элементов также изменяются закономерно (например, возрастает химическая активность) Периодичность свойств элементов обусловлено периодическим повторением конфигурации внешних электронных оболочек атомов. С положением элементов в системе связаны его химические и многие физические свойства.
Первые три периода называются малыми или короткими все остальные большие или длинные. В зависимости от того, как представлены в периодической таблице длинные периоды, различаются короткопериодные и длиннопериодные варианты таблицы. В последнем варианте длинный период вытянут полностью слева направо и четвертая, пятая строки таблицы содержат последовательность из 18 элементов. Шестой период и теоретически седьмой содержат по 32 элемента.
7.энергия необходимая для удаления одного моля атомов какого либо элемента, называется первой энергией ионизации I.(кДж/моль,эВ)по периоду возрастает.
Сродство к электрону-энергетический эффект присоединения моля электронов к молю нейтральных атомов.по периоду уменьш.Электроотрицптельность-способность атома хим.элемента притягивать к себе электроны.по периоду увелич.Радиус атомный-половина расстояния между ядрами соседних атомов в кристалле или молекуле.по периоду уменьшается. усиление немме свойств по периоду.по группе усиление метал свойств.
8.способность атома присоединять или замещать определенное число других атомов с образованием химичексих связей-валентность.согласно обменному механизму каждый атомотдает на образование общей электронной пары по одному неспаренному электрону. При образовании хим связи атом может переходить в возбужденное состояние в результате разъединения пары электронов и переходе одного электрона в свободную орбиталь той же оболочки. Основное(устоичивие) состояние атома-такое состояние,которое характеризуется минимальной энергией.Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
9. Все вещества состоят из атомов. Атомы бывают различные. Атомы каждого вида одинаковы между собой, но они отличаются от атомов любого другого вида. Атом — система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Тип атома определяется составом его ядра. Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Элемент — совокупность атомов с одинаковым зарядом ядра, т. е. числом протонов. Атомы элемента могут иметь различные числа нейтронов в составе ядра, а следовательно, и массу. Такие атомы, относящиеся к одному элементу, называются изотопами. Каждый известный элемент имеет свое обозначение. Так водород обозначается как Н, углерод — С. Атом — наименьшая частица элемента, обладающая его химическими свойствами
Каждая электронная орбиталь в атоме(атомн орбит) может характеризоваться тремя квантовыми числами n,l,m(l).общее число АО в оболочках равно n во 2 степ.условно атомную орбиталь обозначают в виде клеточки.
10.под хим.связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух и многоатомных соединений :молекул, ионов, кристаллических и иных веществ.Хим.связь, образованная путем обобществления пары электронов двумя атомами называется ковалентной связью. Ковалентная связь может быть образованна путем обобществления валентных электронов двух нейтральных атомов.такой механизм образования связи называется обменным или равноценным. Приводит к поляризации,возможна ионная связь. второй механизм. Донорно акцепторный-согдасно которому образуется общая электронная пара за счет неподеленной пары электронов одного атома(донора) и вакантной орбитали другого атома или иона(акцептора).Атом или ион, поставляющий пару электронов, называют донором, а атом или ион, к которому эта пара электронов перемещается, — акцептором. Согласно методу ВС, ковалентная связь по донорно-акцепторному механизму возникает при перекрывании вакантной орбитали акцептора с заполненными орбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну неподеленную пару электронов.
11.Насыщаемость КС – это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии..Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.Гибридизация КС – при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp-если в хим.связь вступает атом у которого на внешней оболочке имеются s и p электроны , sp2, sp3 –гибридизация. sp – форма молекулы линейная (угол 1800), sp2 – форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028)..
12. . Полярность КС. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью.Кратность КС– Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Количество энергии, выделяющейся при образовании хим.связи, называется энергией хим.связи.для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение. чем больше энергия связи тем устойчивее молекулы. длина связи- расстояние между ядрами в соединении. она зависит от размеров электронных оболочек и степени их перекрывания.
13.водородная связь образуется за счет сил электростатического притяжения полярных молекул друг к другу, особенно когда они содержат атомы сильно электроотрицательных элементов(F,O,N). если водородная связь образуется между разными молекулами, она называется межмолекулярной,если между двумя группами одной и той же молекулы,то она внутримолекулярная. Между двумя молекулами возникает взаимодействие, которое имеет электростатический и частично донорно-акцепторный характер. Водородную связь условно записывают как X—H---Y, где X и Y — атомы F, N, О или S (точками обозначается собственно водородная связь).Энергия и длина водородной связи в значительной мере определяются электрическим моментом диполя связи и размерами атома. Длина связи уменьшается, а энергия водородной связи возрастает с увеличением разности ЭО у атомов X и Y и соответственно электрического момента диполя связи X—Н и с уменьшением размера атома Y. Самая прочная связь образуется между HF.Обычно же энергия водородной связи лежит в пределах 5— 25 кДж/моль, т. е. она больше энергии межмолекулярного взаимодействия, но значительно меньше энергии ковалентной связи. Водородная связь имеет весьма широкое распространение. Она встречается в неорганических и органических соединениях. Водородная связь иногда определяет структуру вещества и заметно влияет на физико-химические свойства. Важную роль играет водородная связь в процессах кристаллизации и растворения веществ, образования кристаллогидратов, ассоциации молекул.
14. Метод молекулярных орбиталей. Электроны в молекуле распределены по МО, которые подобно АО характеризуются определённой энергией и формой. МО охватывают всю молекулу. Молекула рассматривается как единая система.
-
Число МО равно общему числу АО, из которых комбинируется МО.
-
Энергия одних МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО, полученная из набора АО, приблизительно совпадает с средней энергией этих АО.
-
Электроны заполняют МО, как и АО, в порядке возрастания энергии, при это соблюдается принцип запрета Паули и правило Гунда.
-
Наиболее эффективно комбинируются АО с теми АО которые характеризуются сопоставимыми энергиями и соответствующей симметрией.
-
Как и в методе ВС, прочность связи в методе МО пропорциональна степени перекрывания атомных орбиталей. Порядок и энергия связи. Порядок связи n=(Nсв-Nр)/2. Nсв – число e на связывающих молекулярных орбиталях, Nр – число e на разрыхляющих молекулярных орбиталях. Если Nсв = Nр, то n=0 и молекула не образуется. С увеличением n в однотипных молекулах растёт энергия связи. В отличии от метода АО, в методе МО допускается, что связь может быть образована одним электроном.
15.Комплексные соеденения. Сложные соединения у которых имеются ковалентные связи, образованные по донорно акцепторному механизму.согласно координационной теории швейцарского ученого Вернера комплексные соединения состоят из двух сфер: внешней и внутренней.внутренняя сфера-комплекс включает центральный ион ,вокруг которого координируются отрицательно заряженные ионы или нейтральные молекулы. центральный ион-комплексообразователь, а координируемые им ионы или молекулы лиганды.число лигандов –координационное число.различают анионные комплексы,катионные и нейтральные. Заряд комплекса равен сумме заряда центрального иона и зарядов лигандов.Назвние начинается с названия отрицательного лиганда, с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом, с указанием римской цифрой его степени окисления. H2O(аква), NH3(амин), CO(карбонил), NO(нитрозил). Число лигандов обозначается приставками ди-, три-, тетра-, пенто- и др. или бис- трис тетракис- пентакис- гексакис- для комплексов у которых в названии уже используется приставки ди- три-… [Zn(NH3)2Cl]Cl – хлорид хлордиаминцинка. Комплексные соединения диссоциируют на простые и комплексные ионы.
16. Хим.связь, образованная путем обобществления пары электронов двумя атомами называется ковалентной связью. Ковалентная связь может быть образованна путем обобществления валентных электронов двух нейтральных атомов.такой механизм образования связи называется обменным или равноценным. Приводит к поляризации,возможна ионная связь. второй механизм. Донорно акцепторный-согдасно которому образуется общая электронная пара за счет неподеленной пары электронов одного атома(донора) и вакантной орбитали другого атома или иона(акцептора).Атом или ион, поставляющий пару электронов, называют донором, а атом или ион, к которому эта пара электронов перемещается, — акцептором.
 17.
Ковалентная. Связь
образованная за счет обобществленной
пары электронов, поставляемых по одному
от каждого атома. Обладает направленностью
и насыщенностью. Если связь образована
двумя одинаковыми атомами, то она
неполярная. Если один из атомов притягивает
электроны сильнее другого, то связь
полярная. Мерой полярности служит
электрический момент диполя св
[кл/м, D
дебай = 3.3*10-3
кл/м] равный произведению эффективного
заряда
на длину диполя lд
Ионная.
Электростатическое
взаимодействие отрицательно и положительно
заряженных ионов в химическом соединении.
Возникает в случае большой разности ЭО
атомов. Не обладает направленностью и
насыщеностью. водородная
связь
образуется за счет сил электростатического
притяжения полярных молекул друг к
другу, особенно когда они содержат атомы
сильно электроотрицательных
элементов(F,O,N).
если водородная связь образуется между
разными молекулами, она называется
межмолекулярной,если между двумя
группами одной и той же молекулы,то она
внутримолекулярная. металич
связь.-валентные
электроны так непрочно удерживаются
атомами,что фактически не принадлежат
конкретным атомам.такой тип связи
осуществляется в металлах.Вандервальсовы
взаимодействия.
Диполь-дипольное взаимодействие.
Молекулы ориентируются таким образом,
что положительная сторона одного диполя
была ориентирована к отрицательной
стороне другого. Индукционное
взаимодействие. Диполи могут воздействовать
на неполярные молекулы, превращая их в
индуцированные диполи. Между постоянными
и наведёнными диполями возникает
притяжение. Энергия зависит от
поляризуемости и увеличивается с
увеличением размера молекулы.Энергия
вандервальсова взаимодействия. Eв
= a/lв6
+ b/lв12
17.
Ковалентная. Связь
образованная за счет обобществленной
пары электронов, поставляемых по одному
от каждого атома. Обладает направленностью
и насыщенностью. Если связь образована
двумя одинаковыми атомами, то она
неполярная. Если один из атомов притягивает
электроны сильнее другого, то связь
полярная. Мерой полярности служит
электрический момент диполя св
[кл/м, D
дебай = 3.3*10-3
кл/м] равный произведению эффективного
заряда
на длину диполя lд
Ионная.
Электростатическое
взаимодействие отрицательно и положительно
заряженных ионов в химическом соединении.
Возникает в случае большой разности ЭО
атомов. Не обладает направленностью и
насыщеностью. водородная
связь
образуется за счет сил электростатического
притяжения полярных молекул друг к
другу, особенно когда они содержат атомы
сильно электроотрицательных
элементов(F,O,N).
если водородная связь образуется между
разными молекулами, она называется
межмолекулярной,если между двумя
группами одной и той же молекулы,то она
внутримолекулярная. металич
связь.-валентные
электроны так непрочно удерживаются
атомами,что фактически не принадлежат
конкретным атомам.такой тип связи
осуществляется в металлах.Вандервальсовы
взаимодействия.
Диполь-дипольное взаимодействие.
Молекулы ориентируются таким образом,
что положительная сторона одного диполя
была ориентирована к отрицательной
стороне другого. Индукционное
взаимодействие. Диполи могут воздействовать
на неполярные молекулы, превращая их в
индуцированные диполи. Между постоянными
и наведёнными диполями возникает
притяжение. Энергия зависит от
поляризуемости и увеличивается с
увеличением размера молекулы.Энергия
вандервальсова взаимодействия. Eв
= a/lв6
+ b/lв12
a и b – постоянные. Донорно акцепторный-согдасно которому образуется общая электронная пара за счет неподеленной пары электронов одного атома(донора) и вакантной орбитали другого атома или иона(акцептора
18.Объектом изучения в термодинамике является система. системой называется совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленная от окружающей среды. Различают гомогенные и гетерогенные системы. Гомогенные системы состоят из одной фазы, гетерогенные — из двух или нескольких фаз. Фаза — это часть системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела. Примером гомогенной системы может служить вода, но вода с плавающим в ней льдом — система гетерогенная.Одна и та же система может находиться в различных состояниях. Каждое состояние системы характеризуется определенным набором значений термодинамических параметров. К термодинамическим параметрам относятся температура, давление, плотность, концентрация и т. п. Внутренняя энергия системы. При переходе системы из одного состояния в другое изменяются некоторые ее свойства, в частности внутренняя энергия U.Внутренняя энергия системы представляет собой ее полную энергию, которая складывается из кинетической и потенциальной энергий молекул, атомов, атомных ядер и электронов. Внутренняя энергия является термодинамической функцией состояния системы∆U = U2 – U1 где U1 и U2 — внутренняя энергия системы в конечном и начальном состояниях cсоответственно.
Энтальпия-одна из термодинамических функций характеризующих систему,находящуюся при p-const.энтальпия зависит от количества вещества.U+pV=H. Энтальпия химических реакций. Закон Гесса позволяет рассчитать энтальпию химических реакций. Согласно следствию из закона Гесса, энтальпия химической реакции равна сумме энтальпии образования продуктов реакций за вычетом суммы энтальпий образования веществ исходных с учетом стехиометрических коэффициентов.
19.Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики: Q=∆U+W.Выражение означает,что теплота подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.первый закон термодинамики является формой выражения закона сохранения энергии.согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую.
Изобарический p=const Q=∆U+W'’+p∆V
Изохорический V=const Q=∆U
Изотермический T=const
20. Тепловой эффект- изменение энергии с-мы при протекании хим. Процесса,с-ма не совершает никакой другой работы,кроме работы расширения Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы.
При постоянном давлении – это H – энтальпия реакции. В стандартных условиях H0 Если теплота выделяется то H<0, реакция экзотермическая. Если H>0 то реакция эндотермическая, теплота поглощается. тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества Hсг. Теплоемкость – отношение колич.теплоты сообщен. системе к изменению ее температуры.298 К-стандартная теплота образования. ∆Нт=∆Н298+ƒ∆Срdt(Ур-ие Кирхгоффа)
21. Закон Гесса. 1841.Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.
Т.к. энтальпия реакции возникает вследствие разрушения одних связей и образования других, то по известным значениям хим. связей, можно определить энтальпию, и наоборот.
Q=[Cc+(mCв)] T
Cc – теплоёмкость сосуда калориметра.
Cв – удельная теплоёмкость реагирующей смеси и или воды
m – масса реагирующей смеси или воды.
Использование закона Гесса позволяет рассчитать энергию ионной кристалличексой решетки при известных значениях энтальпий других стадий процесса.
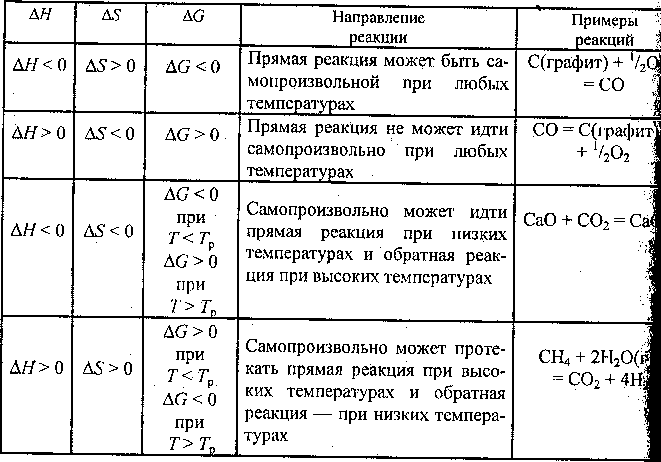
![]()
22.закон Гесса хорошо иллюстрируется с помощью энтальпийных диаграмм. для удобства расчета зависимости между табличными данными, часто представляют в виде диаграммы..процессы в которых система после последовательных превращений возвращается в исходное состояние называются круговыми .
23. Закон Гесса. 1841.Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.bB+dD=lL+mM рассчитывается по уравнению ∆Н=l∆НL+m∆НM-d∆НD-b∆НB Можно рассчитать значение энтальпии образования одного из исходных веществ или продуктов реакций, если известны энтальпии образования остальных реагентов и энтальпия хим реакции.
Т.к. энтальпия реакции возникает вследствие разрушения одних связей и образования других, то по известным значениям хим. связей, можно определить энтальпию, и наоборот.
Использование закона Гесса позволяет рассчитать энергию ионной кристалличексой решетки при известных значениях энтальпий других стадий процесса.
тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества Hсг.расчет проводится с использованием закона Гесса. В технических расчетах используют удельную теплоту сгорания,,которая равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества и 1 м в кубе газообразного вещества до образования высших оксидов.иногда расчет теплового эффекта определяют с помощью калориметров.
