
Технология синтеза мономеров / Основы и технологии мономеров Платэ
.pdf
|
161 |
|
CH3 |
CH3 |
|
|
|
|
CH3—C—C CH + HC CH |
|
|
CH3—C—C CH + HC CNa. |
||
ONa |
|
|
OH |
||
На второй стадии процесса происходит гидрирование диметилацетиленилкарбинола (метилбутинол) до диметилвинилкарбинола (метилбутенол):
CH3 |
|
|
CH3 |
|
|||
CH3—C—C CH + H2 |
CH3 |
|
—C—CH=CH2 |
|
|||
OH |
|
|
|
OH |
|||
В качестве катализаторов используют коллоидный палладий на носителе. Гидрирование метилбутинола проводится в жидкой фазе при 0,5-1,0 МПа и 303-353 К. В присутствии ингибитора, обеспечивающего практически полное превращение метилбутинола в метилбутенол, селективность составляет 99,0- 99,5%.
На третьей стадии синтеза изопрена по Фаворскому проводят каталитическую дегидратацию диметилбутенола:
CH3 |
|
CH3 |
CH3 |
|
|||
|
—C—CH=CH2 |
-Н2О CH2=C—CH=CH2 |
|
|
|||
OH |
|
||
Процесс дегидратации диметилвинилкарбинола протекает с почти полной конверсией (~ 97%) и количественным выходом: селективность составляет ~ 99,8%. Полученный изопрен 98,5%-й чистоты не требует дополнительной очистки, так как не содержит вредных примесей, и может быть направлен на стереоспецифическую полимеризацию.
Метилбутинол может быть превращен в изопрен также и через стадию образования изопропенилацетилена. Реакция протекает при 553 К в присутствии в качестве катализатора фосфата алюминия:
CH3 |
|
CH3 |
CH3—C—C CH |
|
CH2=C—C CH |
OH |
-Н2О |
|
Изопропенилацетилен в результате гидрирования тройной связи превра- |
||
щается далее в изопрен: |
|
|
CH3 |
H2, F |
CH3 |
CH2=C—C CH |
CH2=C—CH=CH2 |
|
Достоинством этого процесса являются мягкие условия его проведения, недостатками - высокая стоимость сырья и проблемы, связанные с взрывоопасностью ацетилена. В промышленности этот метод не нашел широкого распространения.

162
4.2.7. Получение изопрена жидкофазным окислением углеводородов
Получение изопрена жидкофазным окислением изопентена основано на реакции эпоксидирования его органическими гидропероксидами. Процесс разработан в начале 1960-х годов американской фирмой "Халкон".
Процесс включает четыре стадии:
1. Окисление изопентана кислородом воздуха до трет- пентилгидропероксида:
CH3 |
CH3 |
CH3—CH—CH2—CH3 + O2 |
CH3—C—CH2—CH3 |
Изопентан |
O—OH |
трет-Пентилгидропероксид
2. Взаимодействие гидропероксида с 2-метилбутеном-2, который является промежуточным продуктом синтеза, с образованием оксида 2-метилбутена-2:
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
||||||||||
|
|
CH3—C—CH2—CH3 + CH3—C=CH—CH3 |
||||||||
|
|
|
|
O—OH |
|
|
|
|
||
|
|
|
|
CH3 |
|
|
|
CH3 |
||
|
CH3 |
—C—CH—CH3 + CH3—C—CH2—CH3 |
||||||||
|
|
|
|
O |
|
|
|
OH |
||
|
|
|
Оксид |
|
|
трет-Пентиловый |
||||
|
|
2-метилбутена-2 |
|
|
|
спирт |
||||
3. Изомеризация оксида 2-метилбутена-2 в ненасыщенный спирт 2- |
||||||||||
метилбутен-1-ол-3: |
|
|
|
|
||||||
|
|
CH3 |
CH3 OH |
|||||||
|
||||||||||
CH3 |
|
—C—CH—CH3 CH2 |
|
=C—CH—CH3 |
||||||
|
||||||||||
|
|
|||||||||
|
|
O |
|
|
|
|
||||
4. Дегидратация спирта в изопрен: |
||||||||||
|
|
CH3 |
OH |
|
|
|
CH3 ОН |
|||
|
|
|
|
|||||||
CH2=C —CH—CH3 -H2O |
CH2 |
=C—CH=CH2 |
||||||||
163
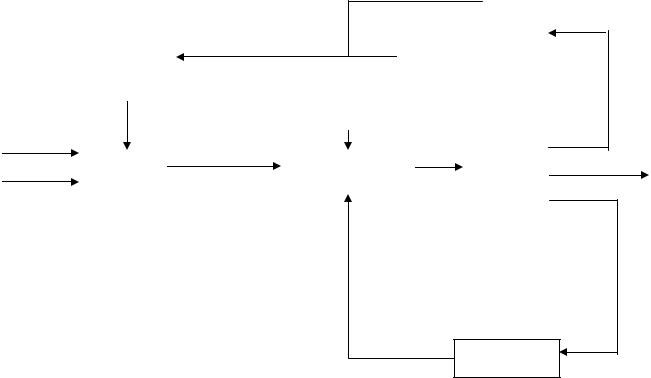
Принципиальная блок-схема процесса приведена ниже (схема 4.1).
Схема 4.1
Непревращенный спирт 
|
|
|
|
|
|
Изомеризация оксида |
|
||||
|
|
|
|
|
|
|
и дегидратация |
|
|||
|
|
|
Изопентан |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Изопентан |
|
трет-Пентил- |
|
|
|
2-Метилбутен-2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
Ги |
гидропероксид |
|
|
|
|
|
|
|
|
|
Эпоксидирование |
|
Разделение |
||||||||
О2 |
Окисление |
|
|
и |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
выделение |
|||
|
|
|
|
|
|
|
|||||
Дегидратация спирта
Оксид 2-метилбутена-2
Побочные продукты
-трет Амиловыйспирт
4.2.8. Получение изопрена из бутенов-2 и синтез-газа
Одним из перспективных методов получения изопрена является синтез из бутенов-2 и синтез-газа через 2-метилбутаналь. Бутены-2 - относительно доступное сырье и могут быть выделены из пиролизной фракции С4 или получены дегидирированием бутена, диспропорционированием пропена, димеризацией этилена. Таким образом, в производство изопрена вовлекаются углеводороды, ранее для этой цели не использовавшиеся.
Процесс состоит из двух стадий: гидроформилирование (оксосинтез) бу- тенов-2 до 2-метилбутаналя и дегидратация последнего до изопрена.
Реакция гидроформилирования олефинов была открыта Роеленом в 1938 г.( Германия) и легла в основу одного из важнейших направлений нефтехимии
– оксосинтеза. Наиболее многотонажным продуктом, производимым по реакции гидроформилирования, является н-масляный альдегид, используемый при получении этилгексанола-2 - сырья для производства пластификаторов.
Гидроформилирование бутенов-2 протекает по реакции

|
164 |
||
CH3—HC=CH—CH3 + CO + H2 |
|
|
O |
CH3—CH2—C |
|
Н—C |
|
|
|||
|
CH3 H |
||
Реакцию осуществляют в жидкой фазе в присутствии родийкарбонильного катализатора, модифицированного фосфорсодержащими лигандами, при 373-393 К и давлении 3,0-6,0 МПа, растворитель - смесь ксилолов.
Механизм гидроформилирования бутенов-2 базируется на общепринятом механизме гидроформилирования Бреслоу-Хека :
H2 |
|
|
RCHO |
|
H2 |
|
|
RCORh(CO)3 |
HR(CO)3 |
|
Rh4(CO)12 |
||||
|
|
|
|||||
CO |
|
ol |
|
|
CO,ol |
|
HRh(CO)3 |
|
|
|
|
H , |
|
|
|
|
RRh(CO)3 |
2 |
|
CO |
|
||
|
|
|
|
Rh6(CO)16 |
кластеры |
||
|
|
|
|
|
ol, CO, H2 |
||
где оl – олефин.
Дегидратацию 2-метилбутаналя (2-МБ) до изопрена осуществляют в присутствии кальцийфосфатного катализатора при 623-673 К и атмосферном давлении со степенью превращения 85-90% и селективностью по изопрену свыше
90%:
|
CH3 O |
CH3 |
|
|
|
|
|
CH3—CH2—CH—C |
CH2=C—CH=CH2 |
||
|
H |
-н2о |
|
Каталитическое превращение альдегидов C5H10O осуществляют в присутствии борфосфатного катализатора, обладающего дегидрирующими свойствами
(табл. 4.5).
|
|
|
Таблица 4.5. |
|
|
|
|
|
|
Условия и состав продуктов превращения альдегидов C5H10O |
|
|
|||||||
|
в присутствии борфосфатного катализатора |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Условия опыта, |
Степень |
|
Содержание, % (мас.) |
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
Исходный |
|
|
превра- |
|
|
|
|
|
|
альдегид |
Т, К |
объемная |
щения, |
С1-С5 |
изо-С5H8 |
МИПК** |
H2O |
н-С5H8 |
прочие |
|
скорость, |
% |
|
|
|
|
|
|
|
|
|
ч-1 |
|
|
|
|
|
|
|
н-Пенталь |
673 |
2,0 |
25-30 |
23-28 |
2-5 |
- |
1-5 |
8-15 |
60-85 |
|
|
|
|
|
|
|
|
|
|
2,2-ДМП* |
673 |
3,0 |
100 |
2-4 |
30-35 |
40-45 |
8-9 |
- |
13-17 |

|
|
|
|
|
|
|
|
|
165 |
|
|
|
|
|
|
|
|
|
|
3-МБ٭٭٭ |
783 |
3,0 |
35-40 40-45 |
20-25 |
- |
5-8 |
- |
20-25 |
|
|
|
|
|
|
|
|
|
|
|
2-МБ٭٭٭٭ |
623 |
3,0 |
93,2 |
6,98 |
57,6 |
16,1 |
15,4 |
сл. |
3,96 |
*2,2-ДМП – 2,2-диметилпенталь;
**МИПК – метилизопропилкетон;
٭٭٭3-МБ – 3-метилбутаналь;
٭٭٭٭ 2-МБ – 2 метилбутаналь.
Как видно из таблицы, только при дегидратации 2-метилбутаналя преобладающим продуктом реакции является изопрен. 3-Метилбутаналь - продукт гидроформилировании изобутилена, хотя и имеет углеводородный скелет изопрена, однако при его дегидратации выход изопрена в 2-3 раза меньше, чем в случае 2-метилбутаналя. Остальные С5-альдегиды также могут превращаться в изопрен благодаря изомеризующим свойствам катализатора, но с очень небольшим выходом (всего несколько процентов).
4.3. ДИЕНОВЫЕ МОНОМЕРЫ ДЛЯ ПОЛУЧЕНИЯ ЭТИЛЕН-ПРОПИЛЕН-ДИЕНОВЫХ КАУЧУКОВ
Среди большого числа синтетических каучуков одно из ведущих мест занимают этилен-пропилен-диеновые сополимеры. Производство каучуков, для получения которых в качестве диена использовали бутадиен, было начато в 1963 г. и уже через 10 лет их стали широко применять как каучуки общего и специального назначения. Доступность и относительно низкая стоимость мономеров, химическая стойкость к воздействию многих агрессивных сред, широкий интервал рабочих температур, легкость переработки, низкая плотность и ряд других ценных свойств этилен-пропилен-диеновых каучуков (СКЭПТ) обусловили их широкое применение при изготовлении конструкционных, технических и бытовых изделий. Введение 1-10% бутадиена при сополимеризации этилена и пропилена обеспечивает возможность вулканизации каучука серой и улучшения таким образом физико-химических и механических характеристик этилен-пропиленового каучука. Благодаря серной вулканизации СКЭПТ применяется гораздо чаще, чем двойной сополимер.
Диеновый мономер, используемый для получения СКЭПТ, должен удовлетворять следующим требованиям:
-ни одна двойная связь не должна образовывать устойчивого комплекса с компонентами каталитической системы полимеризации;
-в процессе сополимеризации должна реагировать только одна двойная связь диенового углеводорода, и, следовательно, двойные связи должны быть сопряженными;
-вторая двойная связь, сохраняющаяся в макромолекуле, должна быстро
иэффективно реагировать с серой или с другим сшивающим агентом;
-мономер должен сополимеризоваться с этиленом и пропиленом с высокой конверсией и иметь способность к легкой рециркуляции.
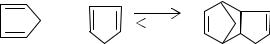
166
В качестве третьего мономера в этилен-пропилен-диеновых сополимерах используют следующие углеводороды:
-линейные несопряженные диены - пентадиен-1,4; гексадиены-1,4 и -1,5; 2-метилпентадиен-1,4; 2-метилгексадиен-1,5; гептадиены-1,4, -1,5 и 1,6; 6- метил-гептадиен-1,5; октадиен-1,5; 2-метилоктадиен-1,7; 3,7-диметилоктадиен- 1,6; 11-этил-тридекадиен-1,11;
-линейные триены и полиеновые углеводороды - декатриен-1,4,9; 2,6- диметилоктатриен-1,5,7; гексатриен-1,3,5; 3-метилгептатриен-1,4,6;
-моноциклические диолефины - 1,4-циклогептадиен, цис,цис- циклооктадиен-1,5; метил-цис, цис-циклооктадиен-1,5;
-бициклические диолефины - бицикло(3,2,0)гептадиен-2,6; метилтетрагидроинден; производные этилидентетрагидроиндена;
-полиалкенилциклоалканы - 1,2-дивинилциклобутан, 1,2-дивинил- циклопентан; 1,2,4-тривинилциклогексан;
-алкилиденциклоолефин - 4-винилциклогексен;
-производные норборнена - дициклопентадиен, норборнадиен, 5-мети- леннорборнен-2,5-ٰ(бутен-2-ил-4)-норборнен-2,ٰ 5-этилиденнорборнен-2, 5- циклогексенилнорборнен-2.
К основным мономерам этого типа относятся производимые в промышленном масштабе для получения СКЭПТ следующие углеводороды: дициклопентадиен, гексадиен-1,4, циклооктадиен-1,5, этилиден- и метиленнорборнены.
4.3.1. Получение несопряженных диенов
Синтез дициклопентадиена
Дициклопентадиен в качестве третьего мономера для СКЭПТ применяют но реже, чем этилиденнорборнен, так как каучук на его основе по многим свойствам уступает каучуку на основе этилиденнорборнена. Кроме того, дициклопентадиен широкоиспользуют в производстве 1,5-транс-полипентенамера.
Дициклопентадиен - это димерная форма циклопентадиена. При комнатной температуре циклопентадиен по реакции Дильса-Альдера легко образует димер:
+
Циклопентадиен получают как побочный продукт пиролиза прямогонного бензина, газойля, этана, пропана в процессах синтеза этилена и пропилена. Концентрация этого углеводорода в С5-фракции пиролиза ~4% (мас.), при пиролизе прямогонного бензина и ~ 8% (мас.) при пиролизе газойля.
167
В коксохимическом производстве выделяют ~2% дициклопентадиена (в расчете на 1 т угля). Поэтому в настоящее время основным источником мономера является нефтехимический дициклопентадиен.
Циклопентадиен из фракции углеводородов С5 может быть выделен экстрактивной ректификацией и димеризацией. В промышленности циклопентадиен в основном выделяют через стадию его димеризации.
Синтез гексадиена-1,4
Этот мономер одним из первых стал применяться в качестве третьего сомономера в производстве СКЭПТ. Однако в дальнейшем он в значительной мере утратил свое значение.
Основным промышленным методом синтеза гексадиена-1,4 является содимеризация бутадиена-1,3 с этиленом, катализируемая комплексами переходных металлов в сочетании с алюминийорганическими соединениями:
CH2=CH—CH=CH2 + CH2=CH2  CH2=CH—CH2—CH=CH—CH3.
CH2=CH—CH2—CH=CH—CH3.
Выход целевого продукта составляет более 95%. Этот процесс был внедрен в промышленность японской фирмой "Тойо Рэйон".
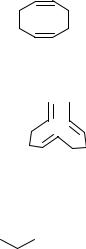
Синтез циклооктадиена-1,5
Циклооктадиен-1,5 получают циклодимеризацией бутадиена-1,3 в присутствии комплексных никелевых катализаторов:
2CH2=CH-CH=CH2 
В качестве побочных продуктов в этой реакции образуются циклододе- катриен-1,5,9: 
3C4H6 
и 4-винилциклогексен-1:
2C4H6 


 CH=CH2
CH=CH2
В присутствии катализатора, состоящего из ацетилацетоната никеля, алюминийорганического соединения и трис-о-бифенилфосфита, можно получить циклооктадиен-1,5 с выходом до 95%.

168
4.3.2. Получение производных норборнена
Синтез этилиденнорборнена
Это наиболее распространенный и перспективный третий мономер для производства СКЭПТ. Этилиденнорборнен получают в две стадии: сначала термической содимеризацией циклопентадиена с бутадиеном-1,3 синтезируют винилнорборнен:
 CH=CH2
CH=CH2
+ CH2=CH—CH=CH2
,
а затем каталитической изомеризацией винилнорборнена получают этилиденнорборнен:
CH=CH2 |
CH-CH3 |
Синтез винилнорборнена из циклопентадиена или его димера и бутадие- на-1,3 впервые описан А.Ф. Платэ и Н.А. Беликовой (МГУ им. М.В. Ломоносолова).
В качестве побочных продуктов в этой реакции образуются 4- винилциклогексен и тетрагидроинден, которые могут иметь самостоятельное значение.
Изомеризация винилнорборнена в этилиденнорборнен может осуществляться в присутствии различных каталитических систем, например амида калия в жидком аммиаке, натрия, нанесенного на промотированный калием оксид алюминия, карбонилов железа, кобальта и др.
Принципиальная технологическая схема процесса получения этилиденнорборнена представлена на рис. 4.9.
Бутадиен и дициклопентадиен вводят в трубчатый реактор 1, в котором проводится синтез винилнорборнена при 453-673 К и 0,4-0,45 МПа. Продукты реакции дросселируют в сепараторе 2, где отделяют непрореагировавший бута- диен-1,3, направляемый на рецикл. В колоннах 3-5 происходит выделение винилнорборнена. Полученный винилнорборнен подвергают изомеризации в этилиденнорборнен в реакторе 6 и очищают его от смол ректификацией в колонне
7.
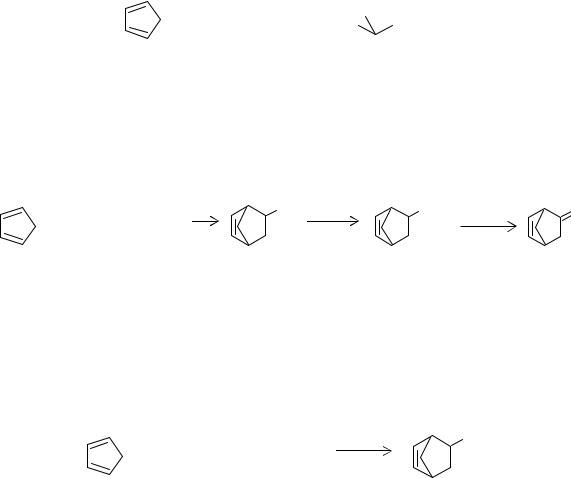
169
Рис. 4.9. Принципиальная технологическая схема получения этилиденнорборнена
1 - реактор синтеза этилиденнорборнена; 2 - сепаратор; 3, 4, 5, 7 - ректификационные колонны; 6 - реактор изомеризации винилнорборнена.
Потоки: I - бутадиен; II - дициклопентадиен; III - винилциклогексен; IV - тетрагидроинден; V - винилнорборнен; VI -этилиденнорборнен; VII - смолы
Производство этилиденнорборнена в промышленном масштабе было начато в США компанией "Юнион Карбайд" в 1967 г.
Синтез метиленнорборнена
Метиленнорборнен как мономер для получения СКЭПТ близок по свойствам к этиленнорборнену, однако используется он в ограниченном масштабе, по-видимому, из-за отсутствия экономичного промышленного способа его производства.
Фирма "Дюпон" (США) запатентовала процесс получения метиленнорборнена из циклопентадиена и аллена по реакции Дильса-Альдера:
+ CH2=C=CH2 

 CH2
CH2
Процесс проводят при 448-498 К в присутствии ингибитора полимеризации (гидрохинона). Ограниченные ресурсы аллена и низкий выход целевого продукта затрудняют внедрение этого процесса в промышленность.
В качестве диенофила в реакции Дильса-Альдера с циклопентадиеном может быть использован акролеин. Эта реакция лежит в основе второго промышленного метода синтеза метиленнорборнена:
+ CH2=CH—CHO |
CHO H2 |
CH2OH |
CH2 |
|
|
-H2O |
|
|
|
|
Синтез пропенилнорборнена
Пропенилнорборнен получают термической содимеризацией циклопентадиена с пентадиеном-1,3 по технологии, близкой к технологии производства
этилиденнорборнена:
CH=CH-СH3
+ CH2=CH—CH=CH-CH3
170
В отличие от синтеза этилиденнорборнена этот процесс не включает стадию изомеризации и пропенилнорборнен является более дешевым.
Синтез 5'-(бутен-2-ил-4)-норборнена-2'
5'-(Бутен-2-ил-4)-норборнен-2' получают из дициклопентадиена и гекса- диена-1,4:
|
5' |
4 |
3 |
2 |
1 |
||
CH2=CH-CH2-CH=CH-CH3 |
|
|
|
CH2-CH=CH-CH3 |
|||
|
|
|
|||||
2' |
|
' |
|
|
|
|
|
|
1' |
|
|
|
|
|
|
Синтез циклопентадиенил-5-эндо-норборнен-2'-ил-5'-метана
Весьма перспективен синтез тройных сополимеров этилена, пропилена и триена, содержащих в основной цепи две сопряженные двойные связи и обладающих рядом интересных свойств. В качестве третьего мономера используют соединения, относящиеся к классу производных циклопентадиенил-5-эндо-
норборнен-2'-ил-5'-метана: |
|
5' |
CH2 5 |
4 R` |
CH2X + R |
R` |
2' |
1 |
3 |
|
-MX |
1' |
R |
2 |
Me
где Х - Hal, Ме - щелочной металл, R = R` = Н или СН3. Метилциклопентадиенил-5-эндо-норборнен-2'-ил-5'-метан получают из 5-
эндо-бромметилнорборнена-2 и натрийметилциклопентадиенила при комнатной температуре в растворе тетрагидрофурана.
В цепи такого полимера отсутствует норборненовая ненасыщенность и присутствуют циклопентадиеновые звенья, т.е. метилциклопентадиенил-5- эндо-норборнен-2'-ил-5'-метан входит в сополимер в результате раскрытия норборненовой двойной связи.
