
- •Вопрос 1 «Предмет и задача химии. Значение химии»
- •Вопрос 2. Строение атома. Модели атома (Морозова, Резерфорда, Бора). Теория Бора. Уравнение Планка. Принцип неопределенности Гейзенберга. Волновая функция.
- •Строение атома по Бору:
- •Вопрос 3. Квантово-механическое представление о строении атома. Квантовые числа и их физический смысл.
- •Вопрос 4. Распределение электронов в многоэлектронном атоме. Принцип Паули. Правило Гунда. Порядок заполнения электронных подуровней.
- •Вопрос 6. Ковалентная связь. Свойства ковалентной связи: прочность, полярность, насыщаемость, направленность, гибридизация, кратность.
- •Вопрос 7. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •Вопрос 8. Σ-, π-, δ- связь.
- •Вопрос 9. Ионная связь и ее свойства.
- •Вопрос 10. Водородная связь и межмолекулярное взаимодействие.
- •Вопрос 11. Комплексные соединения: строение, характер связи, диссоциация.
- •Вопрос 12. Химичёская термодинамика, термодинамические параметры (т, р, V). Внутренняя энергия. Первый закон термодинамики.
- •Вопрос 13
- •Вопрос 13 Энтальпия образования вещества. Закон Гесса и его применение.
- •Вопрос 14. Свободная энергия Гиббса. Самопроизвольность протекания реакций. Свободная энергия Гиббса
- •Вопрос 16. Химическая кинетика. Закон действующих масс гомогенных и гетерогенных систем. Скорость прямой и обратной реакции. Константа скорости химической реакции. Порядок и молекулярность реакции.
- •Вопрос17. Влияние температуры на скорость реакции, правило Вант-Гоффа, энергия активации, уравнение Аррениуса
- •Вопрос 18. Гомогенный и гетерогенный катализ. Катализаторы и ингибиторы.
- •Вопрос 19
- •Вопрос 19. Химическое равновесие. Смещение химического равновесия при изменении условий протекания химических процессов. Принцип Ле-Шателье
- •Вопрос 20. Растворы Свойства растворов.
- •Вопрос 21. Способы выражения концентрации растворов(процентная, молярность, нормальность, моляльность, титр).
- •Вопрос 22. Закон Рауля. Осмос. Физический смысл эбуллиоскопической и криоскопической постоянной.
- •Вопрос 23. Растворы электролитов. Электролитическая диссоциация. Степень диссоциации. Константа диссоциации.
- •Вопрос 24 Ионное произведение воды. Водородный показатель (рН) растворов.
- •Вопрос 25. Гидролиз солей. Константа гидролиза.
- •Вопрос 26. Произведение растворимости.
- •Вопрос 27. Дисперсные системы. Коллоидные растворы, свойства.
- •Вопрос 28.Строение мицеллы коллоидов. Оптические и электрические свойства.
- •Вопрос 29. Окислительно-восстановительные реакции (овр). Ионно-электронный метод уравнивания овр. Термодинамическая вероятность протекания овр.
- •Вопрос 30. Электродный потенциал. Стандартный электродный потенциал. Водородный потенциал. Уравнение Нернста.
- •Вопрос 31. Гальванический элемент: устройства, протекающие процессы на аноде и катоде.
- •Вопрос 32. Эдс и энергия Гиббса гальванического элемента.
- •Вопрос 33. Электролиз. Законы Фарадея. Электрохимический эквивалент. Выход по току.
- •Вопрос 34. Поляризация, ее причины. Перенапряжение.
- •Вопрос 35. Электролиз расплавов и растворов на растворимых и нерастворимых электродах. Последовательность разряда ионов при электролизе на аноде и катоде.
Вопрос 8. Σ-, π-, δ- связь.
В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи.
σ-Связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов (рис. II.4). Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (рис. II.4,а). Вследствие сферической формы s-орбиталей два s-электрона могут образовывать только такую связь, при которой перекрывание атомных орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может возникнуть также при перекрывании s- и р-орбиталей (рис. 11.4,6), двух р-орбиталей (рис. 11,4, в), двух d-орбиталей (рис. II.4, г) d- и s-орбиталей и d- и р-орбиталей. σ-Связь возникает, если атомные р- и d-opбитали ориентированы вдоль оси связи.
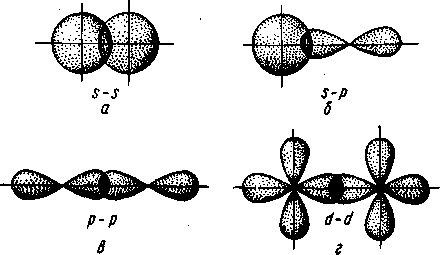
Рис. II.4. Перекрывание различных электронных
облаков при образовании σ–связи
π-Связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух р-орбиталей (рис. II.5, а), расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания. Соответственно π-связь характеризуется двумя областями перекрывания, расположенными по обе стороны оси, соединяющей ядра атомов. π-Связь также может образоваться при перекрывании р- и d-орбиталей (рис. 11.5,6) или двух d-opбиталей (рис. П.5,в).
δ-Связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях (рис. II.6). Таким образом, s-электроны могут участвовать лишь в образовании σ-связи, р-электроны — в образовании σ- и π-связей, a d-электроны — как в образовании σ- и π-связей, так и δ-связей. Еще более разнообразны способы взаимодействия f-электронов.
π- и δ-Связи налагаются на σ-связи, вследствие чего образуются двойные и тройные связи.
Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии σ- и π-связей.

Рис. II.5. Перекрывание электронных
облаков при образовании π-связи

Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
облаков при образовании δ-связи
Вопрос 9. Ионная связь и ее свойства.
Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь может возникать лишь при больших различиях в значениях электроотрицательностей атомов.
Так как электрическое поле иона имеет сферическую симметрию, то в отличие от ковалентной ионная связь не обладает направленностью. Взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность притягивать и другие ионы. Поэтому в отличие от ковалентной ионная связь не обладает насыщаемостью. Из-за отсутствия у ионной связи направленности и насыщаемости каждый ион окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Поэтому соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов. Лишь при высоких температурах, когда вещество переходит в газообразное состояние, ионные соединения могут существовать в виде неассоциированных молекул.
Ионную связь можно рассматривать как предельную полярную химическую связь, для которой эффективный заряд атома близок к единице. В то же время для неполярной ковалентной связи эффективный заряд атомов равен нулю. Химическая связь большинства соединений является полярной, т. е. имеет промежуточный характер между неполярной ковалентной и ионной связями. Ковалентная связь имеет частично ионный характер. Долю ионного характера связи называют степенью ионности, которая количественно характеризуется эффективными зарядами атомов в молекуле. Степень ионности связи возрастает с увеличением разности электроотрицательности образующих ее атомов.
