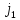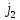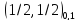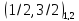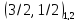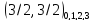- •1. Сериальные закономерности атомных спектров.
- •19. Влияние межмолекулярных взаимодействий на спектр молекулы.
- •2. Тонкое расщепление атомных спектров. Спин-орбитальное взаимодействие.
- •17. Классификация электронных переходов в молекулах, соотношения между интенсивностями спектральных линий различных типов переходов.
- •3. Систематика спектров многоэлектронных атомов.
- •10. Колебательно-вращательные спектры двухатомных молекул.
- •5. Особенности спектральных термов в приближении “j-j” связи.
- •6. Общая характеристика спектров молекул.
- •7. Вращательные спектры двухатомных молекул в приближении жёсткого ротатора.
- •11. Колебательно-вращательные спектры многоатомных молекул.
- •12. Связь между характером колебаний и интенсивностью колебательных полос поглощения.
- •13. Классификация нормальных колебаний по форме и симметрии молекул.
- •16. Вероятность электронно-колебательных переходов.
- •8. Вращательные спектры многоатомных молекул.
- •18. Методы описания межмолекулярных взаимодействий.
- •20. Изменения спектров поглощения и люминесценции растворов по сравнению со спектрами газов. Принцип Франка-Кондона для межмолекулярных взаимодействий.
- •4. Особенности спектральных термов в приближении “l-s” связи.
- •9. Колебательные спектры двухатомных молекул
- •14. Спектры комбинационного рассеяния молекул
- •15. Электронные состояния двухатомных молекул.
5. Особенности спектральных термов в приближении “j-j” связи.
Приближение j-j связи работает, когда электромагнитное взаимодействие больше электростатического, понятия орбитального и спинового моментов теряют смысл, говорят о полном моменте электрона J. Величина энергии спин-орбитального взаимодействия пропорциональна 4 степени зарядового числа. Это приближение хорошо описывает спектры многозарядовых ионов. (38)
В
схеме j-j связи состояние каждого
электрона характеризуется четырьмя
квантовыми числами: n,
l, j, mj.
Для данного
 ,
одно l
- четное, другое – нечетное, всегда
целое => значение кв. числа j и четность
определяют значение l.
,
одно l
- четное, другое – нечетное, всегда
целое => значение кв. числа j и четность
определяют значение l.
Значение
j указывается внизу справа:
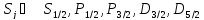 .
.
Состояние
с
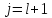 и
и
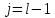 из-за спин-орбитального взаимодействия
относятся к разным уровням энергии и,
если пренебречь электростатическим
взаимодействием, то энергия каждого
электрона не будет зависеть от ориентации
j в пространстве и будет определяться
только n, l и j. Поэтому каждое j-е
состояние 2j + 1 кратно вырождено.
из-за спин-орбитального взаимодействия
относятся к разным уровням энергии и,
если пренебречь электростатическим
взаимодействием, то энергия каждого
электрона не будет зависеть от ориентации
j в пространстве и будет определяться
только n, l и j. Поэтому каждое j-е
состояние 2j + 1 кратно вырождено.
Если
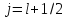 ,
то
,
то
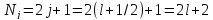 ,
если
,
если
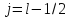 ,
то
,
то
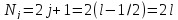 .
.
То
есть кратность вырождения уровня с
большим j больше, чем с меньшим j. При
учете электростатического взаимодействия
это вырождение снимается, и каждое
состояние
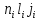 расщепляется на ряд уровней с определенным
значением j.
расщепляется на ряд уровней с определенным
значением j.
Порядок нахождения возможных состояний:
1)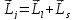 ,
,
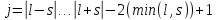 ;
;
2)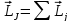 .
.
Если
конфигурация двухэлектронна, то сначала
находят значение полного момента
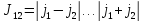 ,
,
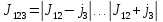
Пример: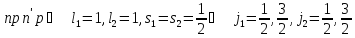 .
.
|
|
|
состояния |
|
1/2 |
1/2 |
|
|
1/2 |
3/2 |
|
|
3/2 |
1/2 |
|
|
3/2 |
3/2 |
|
- обозначение по Рану.
jl-связь: реализуется, когда оптический электрон находится в большом расстоянии от атомного остатка. При этом электростатическое взаимодействие с электронами атомного остатка может оказаться малым по сравнению со спин-орбитальным взаимодействием электронов атомного остатка (ионы инертных газов). Сначала учитывают статическое взаимодействие электронов остатка и находят в приближении ls-связи полный орбитальный и спиновый момент всего атома (добавляют еще один электрон).
Для атомов начала периодической системы (до группы Fe) – приближение L-S-связи. Для группы Pd – L-S или jl-связи (одинаково плохо). Для группы Pt – jl-связь. Атомы инертных газов и сильновозбужденного состояния, ионы инертных газов – jl-связь. Тяжелые атомы (начиная с Pb) – j-j-связь.
---------------------------------------------------------------
6. Общая характеристика спектров молекул.
Молекулярные спектры отличаются от атомных тем, что движение образующих молекулы частиц более сложное, чем движение электронов в атомах. Движение в молекулах описывается: а) движением электронов – движение электронов, участвующих в создании химической связи, и движение электронов, локализованных около ядра; б) периодическим изменением относительного положения ядер в молекулах – колебательное движение; в) периодическим изменением ориентации молекулы в пространстве – вращательное движение.
Полная энергия молекулы:
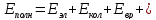
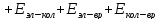
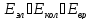
Если энергию выразить в [кДж/моль]:
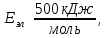
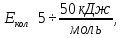
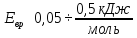
Колебательный, вращательный и электронный спектры находятся в разных областях спектра.
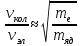 ,
,
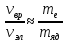
Соотношение
между частотами эквивалентно тому, что
частоты колебательных спектров
приблизительно (0,01÷0,1)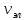 ,
вращательных (
,
вращательных (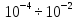 )
)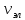 .
Т.е.:
.
Т.е.:
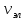 ≥ 1000
≥ 1000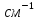 ,
,
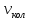 = (100÷1000)
= (100÷1000)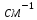 ,
,
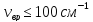 .
.
Длины волн электронного спектра: 0,01÷1 мкм, колебательного: 1÷100 мкм, вращательного: >100 мкм. (40)
Структура энергетических уровней молекулы:
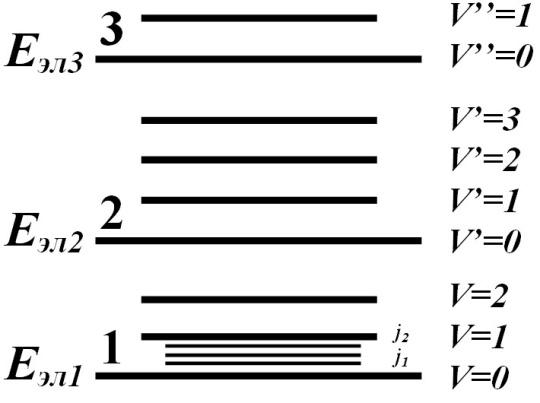
Если говорить о чисто вращательных переходах, то это переходы между вращательным и колебательным состоянием одного электрона.