
- •3.Ферменты. Простые и сложные ферменты.
- •4.Активные и аллостерические центры ферментов.
- •5. Механизм действия ферментов.
- •6. Свойства ферментов.
- •7. Номенклатура и классификация ферментов.
- •8. Гидролазы.
- •9.Оксидоредуктазы.
- •10.Трансферазы.
- •11.Лиазы и лигазы.
- •12.Изомеразы и синтетазы
- •13.Изоферменты
- •14.Активаторы и ингибиторы ферментов
- •15. Диагностическое значение определение активности ферментов крови животных
- •17. Классификация витаминов
- •18. Каротины и каротиноиды и их биологическая роль
- •19.Структура, роли витамина а в организме
- •21.Структура, роль витамина к в организме
- •22.Структура, роль витамина f в организме.
- •24. Коферментная функция водорастворимых витаминов: над,фад.
- •25. Строение, роль витамина в1 в организме.
- •26. Строение, роль витамина в2 в организме.
- •27. Строение, роль витамина в3 в организме.
- •28. Строение, роль витамина в5 в организме.
- •29. Строение, роль витамина в6 в организме.
- •30. Строение, роль витамина Вс в организме.
- •32: Строение, роль витамина с в организме.
- •33. Биотин (витамин н, антисеборейный)
- •41.Гормоны поджелудочной железы
- •51. Аэробный распад углеводов.
- •52. Биологическая роль цикла Кребса
- •53. Пентозный путь окисления углеводов, его роль.
- •54. Липиды, их переваривание и всасывание в пищеварительном тракте.
- •55. Желчь, ее роль в переваривание и всасывание жиров.
- •56. Переваривание и всасывание фосфолипидов.
- •57. Окисление жирных кислот.
- •62. Синтез холестерина, его биологическая роль
- •63. Синтез кетоновых тел. Кетозы.
- •64. Переваривание и всасывание белков в пищеварительном тракте.
- •65. Особенности превращения азотсодержащих в-в в пищ. Тракте жвачных ж-х.
- •66. Процессы гниения белков в толстом кишечнике ж-х.
- •67. Осн. Этапы синтеза белка в клетке.
- •68. Реакции переваривания аминок-т в тканях.
- •69. Механизмы обезвреживания аммиака в орг-ме.
- •70. Синтез гемоглобина.
- •71. Распад гемоглобина. Желчные пигменты и их значение.
- •74.Простагландины. Тромбоксаны, их биологическая роль.
- •75.Буферные системы крови животного.
- •77. Белки сыворотки крови, их диагностическое значение.
- •78. Взаимосвязи обменов углеводов, жиров, белков.
- •79. Биохимия почек.
- •80. Биохимия молочной железы. Молоко , молозево.
- •81.Биохимический механизм мышечного сокращения
- •Вопрос 82. Роль печени в обмене веществ.
- •Вопрос 83.Биохимия нервной ткани.
- •Вопрос 84. Особенности обменов веществ в организме птицы.
- •Вопрос 85. Роль, значение макроэлементов в организме.
- •Вопрос 86. Роль, значение микроэлементов в организме.
- •Вопрос 87. Биохимические характеристики эритроцитов, лейкоцитов.
- •Вопрос 88. Строение рнк и днк, их биологическая роль.
- •Вопрос 89. Механизм свертывания крови.
- •Вопрос 90. Составные компоненты крови, их диагностическое значение.
41.Гормоны поджелудочной железы
Для поджелудочной железы характерным является клеточный полиморфизм. Выявлены четыре типа клеток железы, каждый из которых вырабатывает определенный гормон: а-клетки, (3-клетки, 8-клетки, F-клетки. Все гормоны поджелудочной железы являются пептидами или белками. Островки Лангерганса поджелудочной железы.
секретируют инсулин, глюкагон, соматостатин, панкреатический полипептид. Уровень глюкозы в крови поддерживается сравнительно постоянным. Глюкоза в органах и тканях трансформируется в глюкозо-6-фосфат, ключевой посредник, который может быть направлен на синтез гликогена, на синтез энергии по пути гликолиза, на окисление по пентозному пути. Судьба глюкозо-6-фосфата определяется действием двух гормонов поджелудочной железы — инсулина и глюкагона. Высокий уровень глюкозы приводит к увеличению секреции инсулина, а низкий уровень глюкозы стимулирует секрецию глюкагона.
Инсулин. Это первый белковый гормон, полученный в 1925 г. в кристаллическом виде и с выясненной Сэндже- ром в 1953 г. аминокислотной последовательностью. Он синтезируется (5-клетками железы в форме проинсулина (84 аминокислотных остатка), а затем в результате протео- лиза с отщеплением С-пептида из 33 аминокислотных остатков переходит в активную форму. В настоящее время инсулин синтезирован химическим путем и методом генной инженерии. Молекула инсулина состоит из двух по- липептидных цепей (А и В) с 21 и 30 аминокислотами соответственно, связанных двумя дисульфидными связями. В тетрамере инсулина обнаружено 2 молекулы цинка. Молекулярная масса инсулина — 5700. Инсулин в крови не связан с транспортными белками, а поэтому его период полураспада составляет лишь 3-5 мин. Связывание инсулина с его рецепторами на поверхности клеток-мишеней (печень, жировая ткань) без проникновения внутрь клетки вызывает образование в ней вторичных посредников, что приводит к активизации ферментов внутри клетки уже через несколько секунд или часов. В регуляции синтеза инсулина определенную роль играет концентрация глюкозы в крови. 107
. чувствительна к действию гормона, чем клетки печени. Инсулин — единственный гормон, способный понижать уровень сахара в крови, тогда как целый ряд других гормонов в организме повышают уровень сахара в крови. Инсулин — важнейший анаболитический агент в печени, жировой ткани, мышцах. Эти эффекты объясняются усилением образования АТФ, НАДФН (+Н+). Важнейший источник энергии в клетках — аэробный гликолиз и последующее окисление промежуточных продуктов в цикле трикарбоновых кислот. Указанные процессы усиливаются за счет влияния инсулина на клеточные ферменты гликолиза. Понижение в печени активности фермента фрук- тозо-1,6-дифосфатазы и пируваткарбоксилазы приводит к снижению глюконеогенеза.
Глюкагон. Это полипептид с молекулярной массой около 3600-4200, в своем составе содержит 29 аминокислот. Он синтезируется в а-клетках поджелудочной железы в форме проглкжагона в ответ на низкий уровень глюкозы в крови. В плазме крови он не связан с белками, и период полураспада его составляет несколько минут. Печень и почки быстро инактивируют глюкагон. Клетки печени — основные мишени гормона. Действие глюкагона прямо противоположно эффектам инсулина.
Панкреатический полипептид. Он включает 36 аминокислот с молекулярной массой 4200 и является продуктом F-клеток поджелудочной железы. Панкреатический полипептид способен активизировать ферменты пищеварительного тракта, поджелудочной железы. Можно полагать, что клетками-мишенями для этого гормона являются клетки всех отделов желудочно-кишечного тракта. Биохимические процессы, связанные с панкреатическим полипептидом, не выяснены. При диабете выявлена гиперплазия синтезирующих полипептид клеток.
Соматостатин. Впервые выделен из гипоталамуса. Это циклический пептид из 14 аминокислот, синтезируемый также в 8-клетках поджелудочной железы вначале в форме прогормона из 28 аминокислот. Соматостатин обнаружен и в разных отделах пищеварительного тракта.
42Гормоны паращитовидных желез
Паращитовидные железы синтезируют и выделяют паратгормон. Паратгормон — белок с молекулярной массой около 9000-9500, содержащий 84 аминокислотных остатка, период полураспада его составляет несколько минут. Паратгормон вырабатывается железой в форме прогормона (90 аминокислот), который с потерей гексапептида переходит в активную форму.
Паратгормон оказывает прямое воздействие на функцию почек, вызывая увеличение экскреции фосфора (при отсутствии паратгормона фосфор реабсорбируется почками). Увеличение экскреции фосфора почками приводит к снижению концентрации этого элемента в крови. Дефицит паратгормона в организме приводит к значительному снижению уровня кальция в крови. Регуляция кальция во внеклеточной жидкости осуществляется кальцитонином, витамином Д (кальцитриол) и паратгормоном. Их органами- мишенями является кишечник, почки, костная ткань.
аратгормон связывается с рецепторами мембран почек и костей с последующей активацией аденилатциклазной системы с образованием цАМФ. Постоянство уровня кальция в крови животного поддерживается главным образом кальцитонином щитовидной железы и паратгормоном па- ращитовидной железы.
43. Мозговой слой надпочечников служит продолжением симпатической нервной системы — это специализированный ганглий, лишенный продолжения в виде аксона. Хро- мафинные клетки мозгового вещества надпочечников вырабатывают из тирозина гормоны, содержащие в своей структуре катехол, а поэтому названные катехоламинами — адреналин и норадреналин.
На долю адреналина приходится около 80% всех катехоламинов. Адреналин и норадреналин также синтезируются симпатической нервной системой и рассматриваются как симпатические нейромедиаторы.
44Катехоламины транспортируются в хромафинные гранулы белками-транспортерами. Поток кальция на нервное окончание обеспечивается деполяризацией потенциала. «Кислый» белок хромогранин образует при этом комплекс с положительно заряженными катехоламинами. Действие катехоламинов прекращается Ма+-зависимым транспортным белком, который удаляет их из синаптической области и транспортирует в клетки, их использующие.
Основным органом, где происходит распад катехоламинов за счет реакций метилирования, окислительного дезаминирования, синтеза парных соединений, является печень.Адреналин мобилизует гликоген печени, по крайней мере, тремя различными механизмами. Во-первых, через стимуляцию глюкагона. Во-вторых, адреналин связывается с рецепторами на поверхности клеток печени, что приводит к образованию цАМФ, производного АТФ. Гормон не поступает в клетки печени, а все его эффекты опосредованы цАМФ. Адреналин служит, как и глюка- гон, первым «сигнальным посредником» (от одной клетки к другой), а цАМФ выступает как второй «сигнальный посредник» (внутри клетки). Увеличение уровня цАМФ приводит к повышению активности аденилатцик- лазы. В процессе активации аденилатциклазы необходимо дополнительно участие ГТФ. Гуанил-нуклеотид — связывающий белок является посредником в процессе активации и получил название G-белка. Вероятно, активированный рецептор стимулирует G-белок, который'и передает стимулирующий сигнал на аденилатциклазу. В третьих, мембраны клеток печени имеют другие места связывания адреналина — а-адренэргические рецепторы. Взаимодействие этих рецепторов с адреналином приводит к образованию инозитол-трифосфата, который стимулирует реализацию Са2+ из внутриклеточных запасов (эндоплазма- тический ретикулум), что вызывает активацию различных фосфорилаз, прежде всего — фосфорилазы гликогена. В скелетных мышцах адреналин создает условия для повышения уровня глюкозо-6-фосфата, необходимого для гликолиза. АТФ, получаемый в результате гликолиза, используется затем в обменных процессах при стрессовых ситуациях организма.
45ПОЛОВЫЕ ГОРМОНЫ
Половые железы (яичники у самок и семенники у самцов) синтезируют, как и кора надпочечников, множество стероидных структур. Следует отметить, что в женских половых железах имеет место незначительный синтез мужских половых гормонов, а в мужских половых железах синтезируются некоторые количества женских половых гормонов.
Основная функция половых гормонов — обеспечение развития, роста, регуляция репродуктивной системы. Половые гормоны классифицируются в соответствии с их биологической активностью. Андрогены — мужские половые гормоны, их структура включает 19 атомов углерода. Эстрогены — женские половые гормоны, их структура включает 18 атомов углерода и одно ароматическое ядро, а также прогестерон, представляющий собой C2i — стероид.
Мужские половые гормоны (андрогены)
Андрогены продуцируются в основном в клетках Лейдига семенников, в небольшом количестве — в яичниках, в коре надпочечников животных обоих полов. Андрогены влияют на развитие, поддержание и функции мужских репродуктивных органов, на развитие вторичных половых признаков. Андрогены оказывают широкое влияние на весь организм, а также на отдельные специфические ткани. Они оказывают выраженную анаболическую активность, приводящую к усвоению азота, увеличению мышечной и костной массы.
Андрогены определяют формирование костной ткани и прекращение роста костей после полового созревания. Влияя на нервную систему, андрогены определяют характерное половое поведение. Рецепторные места для андрогенов выявлены в мозге, мышцах и других тканях.
Основной мужской половой гормон — тестостерон (от лат. testis — семенник), а из мочи самцов выделяют андро- стерон, который является продуктом распада тестостерона.
ОН О
Синтез и выделение андрогенов железами происходит непрерывно. В крови тестостерон связан с (3-глобулина- ми. Тестостерон значительно активнее андростерона и легко проходит в ядра клеток, где находит соответствующий рецептор. Можно рассматривать тестостерон как прогормон, так как он превращается в активное соединение — 5-а-дигидротестостерон в различных тканях вне семенников. Получил распространение в практике лечения недостаточностей мужских половых желез препарат метилтесто- стерон. Тестостерон-пропионат, эфир тестостерона, обладает более длительным биологическим действием, чем нативный гормон, так как медленнее рассасывается в тканях.
46Женские половые гормоны — эстрогены и прогестерон, синтез которых протекает в яичниках, плаценте, надпочечниках в возрастающих количествах во второй стадии беременности и носит циклический характер.
Наиболее активные эстрогены (от греч. oistros — страстное влечение) — эстрадиол, эстрон — образуются в яичниках, тогда как плацента образует как эти стероиды, так и эстриол. Основная функция гормонов яичников — подготовка женской половой системы к размножению: созревание примордиальных зародышевых клеток, развитие тканей для имплантации бластоцисты, контроль времени овуляции, обеспечение регуляции родов и лактации. Они способствуют также росту и дифференцировке молочных желез, синтезу белков, задержке воды в тканях и определяют телосложение женского типа.
Для молекул всех трех нативных эстрогенов (стероиды состоят из 18 атомов углерода) свойственно наличие фенольного кольца с гидроксигруппой в положении 3 и ме- тильной группой в положении 18. Их предшественником является холестерол.
Эстрогены оказывают эффекты на основные обмены веществ организма, включая усиление липогенеза в жировой ткани, синтез ряда белков в печени, включая трансферрин, церуло- плазмин. Эстрогены, подобно андрогенам, оказывают влияние на формирование костной ткани, на сердечно-сосудистую систему, на процесс свертывания крови. Места рецепторов для эстрадиола выявлены в матке, влагалище, молочной железе, мозге и в других тканях-мишенях. Образование эстрогенов находится под контролем гипоталамуса и фолликулостимулирующего и лютеинизирующего гормона передней доли гипофиза.
Другим женским половым гормоном является прогестерон, продукцию которого стимулирует только ЛГ. Это гормон желтого тела яичника и плаценты. Он необходим для фиксации оплодотворенного яйца к слизистой матки и для развития эмбриона в первой половине беременности, стимулирует развитие ткани молочной железы. Органом-мишенью для прогестерона является и яйцевод кур, где он стимулирует синтез специфического белка-авидина. В период беременности холе- стерол крови является основным предшественником прогестерона в плаценте. Корова считается беременной, если концентрация прогестерона составляет 1-2 нг/мл крови. В норме продукция прогестерона составляет 3-5 мг в сутки, тогда как в конце беременности его количество достигает 30-50 мг в сутки. Поэтому прогестерон рассматривается как гормон беременности. В плазме крови прогестерон циркулирует в виде комплекса с белком транскортином.
Во время беременности животного функционирует плацента, которая продуцирует хорионический гонадотропин, глюкопротеин с молекулярной массой 100 тысяч. Он обладает активностью ЛГ, но имеет иную аминокислотную последовательность и иммунологически отличается от ЛГ. Его основная функция — поддержать существование желтого тела до тех пор, пока плацента начнет синтез прогестерона (C2i). В плаценте синтезируются также и эстрогены.
СН„
Определенные запасы эстрогенов и прогестерона имеются в жировой ткани. Эти стероиды имеют также явную печеночно-кишечную циркуляцию, они быстро появляются в желчи в конъюгированной форме и подобно холестерину, поступают в кишечник, реабсорбируясь через воротную вену обратно в печень. В отличие от этих гормонов, андрогены и адренокортикоиды экскретируются в восстановленной форме в мочу.
Для получения женских половых гормонов используют мочу жеребых кобыл. В ветеринарной практике находит применение синтетический препарат синэстрол, обладающий эстрогенной активностью.
47ГОРМОНАЛЬНАЯ АКТИВНОСТЬ ТИМУСА
Известно, что в тимусе (thymus) из поступающих в него стволовых клеток костного мозга дифференцируются и созревают субпопуляции Т-лимфоцитов, обладающих хелперной, супрессорной или киллерной активностью. В процессе пролиферации и дифференцировки под влиянием веществ, выделяемых тимусом, образуются сначала предшественники — лимфоциты тимуса, а из них — Т-лимфоциты, поступающие в кровь. Тимус (вилочковая железа) рассматривается как центральный лимфоидный орган. За последние десятилетия было убедительно показано, что удаление тимуса у новорожденных животных сопровождается быстрым снижением роста, уменьшением числа лимфоидных клеток и неспособностью к иммунологическим реакциям.
Из тимуса выделены пять биологически активных факторов: тимозин, гомеостатический тимусный гормон, тимопо- этин I, тимопоэтин И, тимусный гуморальный фактор. Определена их молекулярная масса и установлена химическая структура. Все они являются полипептидами.
Синтезируемые и выделяемые тимусом гормоны влияют на скорость развития и созревания лимфоидных клеток. Так, тимозин участвует в превращении стволовых лимфоидных клеток в иммунологически компетентные Т-лимфоциты. В присутствии тимозина и антигенной стимуляции появляются «обученные» Т-лимфоциты. Тимопоэтин I и тимопоэтин II индуцируют дифференциацию Т-клеток, способствуют их созреванию и обучению в тимусе, усиливают активность лимфоцитов на различные митогены. Нарушения функции тимуса в раннем постнатальном периоде приводят к ослаблению или отсутствию как клеточного, так и гуморального иммунитета.
Выработка гормонов тимусом контролируется непосредственно гипофизом или косвенно через гормоны щитовидной железы, коры надпочечников, половые гормоны. Следует учитывать, что лимфоидная ткань является мишенью не только для гормонов тимуса, но и для гормонов ряда других эндокринных желез. Поэтому в случае удаления тимуса во взрослом организме нарушения иммунологической реактивности наблюдаются через значительный промежуток времени. Кроме того, способные к иммунологическому ответу лимфоидные клетки существуют довольно долго.
Хотя в целом итоговый эффект гормонов тимуса заключается в обеспечении иммунологической реактивности организма, наличие нескольких гормонов этой эндокринной железы не является случайным. Это объясняется тем, что популяция лимфоидных клеток неоднородна и разные гормоны оказыва-ют влияние на определенный подкласс этих клеток. Вероятно, что каждый гормон тимуса имеет свою специфичность на клетки-мишени.
В настоящее время ряд биологически активных препаратов, полученных из тимуса (тималин), или их синтетические аналоги (тимоген) с успехом используются в ветеринарной практике для коррекции тимусзависимых первичных и вторичных иммунодефицитных состояний.
Фабрициева сумка (Bursa fabricii) — лимфоэпителиальный орган, расположенный в задней части клоаки у птиц. Открыта Джероламо Фабрицием.
Представляет собой кожистое мешковидное углубление, открывающееся в самую нижнюю часть клоаки птиц со спинной стороны. Фабрициева сумка хорошо развита у всех молодых птиц до наступления половой зрелости, подвергается редукции у взрослых (в возрасте 8-9 мес) (за исключением нанду).
Стенка сумки состоит из перитонеального покрова, слоя неправильно перекрещивающихся гладких мышечных волокон и слизистой оболочки, в толще которой залегают замкнутыефолликулы. Просвет сумки выстлан цилиндрическим эпителием, подобным эпителию кишечника. Непосредственно за эпителиальным слоем располагаются узелки (дольки), общее строение которых напоминает организацию долек тимуса. Кора представлена в основном плотным скоплением малых лимфоцитов. Более светлое мозговое вещество включает большие лимфоциты, плазматические клетки, макрофаги, гранулоциты, ретикулярные клетки. Эпителиальные клетки органа образуют сеть, переходящую в эпителиальные покровы просвета органа. В отличие от тимуса и других лимфоидных органов, в узелках сумки корковый слой отделен от медуллярного основной мембраной.
В середине 60-годов утвердилось мнение, что Фабрициева сумка выполняет роль центрального органа иммунитета, являясь поставщиком В-клеток для периферии. Были предприняты даже попытки найти аналогичный орган у млекопитающих, исключая костный мозг. Действительно, фабрициева сумка является местом активного образования антителопродуцентов. Однако исключительность этого органа для В-системы иммунитета не подтвердилась
48 полисахаридов. Этот фермент не атакует 1,6-гликозидные связи полисахаридов и гидролизует лишь небольшую чжпь углеводов, что важно для молодняка. Однако корма находятся в ротовой полости кратковременно, поэтому этот процесс не имеет большого значения для взрослых животных. К тому же есть данные, что у некоторых видов животных амилаза слюны вообще отсутствует.
Затем углеводы поступают в желудок, где амилолити- ческие ферменты отсутствуют, а амилаза слюны в кислой среде желудочного сока (pH = 1,5-2,0) теряет свою активность. Последующий гидролиз полисахаридов, олигосахаридов и дисахаридов происходит в тонком кишечнике, где амилолитическая активность обусловлена поджелудочной а-амилазой. Щелочной сскрст поджелудочной желряы (pH = 7,5-8,0) и желчи нейтрализует желудочное содержимое и обеспечивает ему щелочной характер, необходимый ДЛЯ Проявлен И И ик тИКНОГ.ТИ фСрМСПТОЕ поджслудоч- iioii железы и кишечного еока. Панкреатическая амилаза расщепляет крахмал и гликшен с. образованием дисахари да мальтозы, трнсахарида мн.мк'РОтриоаы и декстринов, со держащих в среднем до 8 мо.ч«кул глюкозы, объединенных а-1.б-глшеозидными связями. Под влиянием а-глюкозида зы (мальтазы) в щеточной кайме эпителия слизистой оболочки кишечника (пристеночное нищенйрение) мальтоза распадается на две молекулы глюкозы. и-1,С-гликозид- ные связи крахмала и гликогена расщепляются под действием амило-1,б-глюкозидазы и олиго-1,6-глюкпвидязы. Дисахарид лактоза расщепляется под влиянием р-гнлак- тозидяям (лактаяы) на глюкозу и галактозу. Сахароза под влиянием сахаразы распадается па глюкозу и фруктозу. Окончательный гидролиз углеводов приводит к образованию моносахнри/вж. Hei идролизоваппые дисахариды и полисахариды не могут абсорбироваться в тонком кишечнике и поступают в толстый кишечник, где подвергаются воздействию бактериальных ферментов с образованием молочной кислоты, низкомолекулярмых жирных кислот
— — — и r 'U Г'ГI -
И 1 aoub.
У жвачных лсивотных кормовые массы в иреджелуд- ках перетираются, а затем отрыгиваются в ротовую по- iHH-.ih. где подвергаются воздействию слюны и обратпоступают в преджелудки. В преджелудках клетчатка расщепляется под влиянием ферментов микрофлоры, насчитывающей до 150 видов бактерий, с разрывом Р-гликозид- ных связей, образуя молекулы глюкозы. Последние, подвергаясь различным видам брожения, образуют жирные кислоты — уксусную (70%), пропионовую (18%), масляную (8%) и другие, называемые «летучими жирными кислотами» (ЛЖК), а также газы, на долю которых приходится: С02 (60-70%), СН4 (25%).
Глюкоза вначале трансформируется в молочную кислоту, которая превращается в уксусную и пропионовую кислоты:
С6Н1206 -> 2СН3—СНОН—СООН
глюкоза молочная кислота
ЗСНз—СНОН—СООН ->
молочная кислота
-► СНз—СООН + 2СН3—СН2—СООН + Н20 + С02
уксусная кислота пропионовая кислота
В обычных условиях кормления в рубце лактирующей коровы в течение суток образуется 2,5-5 кг ЛЖК, в рубце овцематки — 0,2—0,5 кг этих кислот.
Превращение основной массы полисахаридов (клетчатки) в преджелудках у жвачных животных в ЛЖК объясняет факт более низкой концентрации глюкозы в крови у этих видов животных по сравнению с другими видами. Большая часть ЛЖК всасывается в кровь из полости многокамерного желудка, тогда как в течение суток у коровы из кишечника в кровь поступает не более нескольких граммов глюкозы. В то же время глюкоза нужна животному как клеточное топливо для мозга, других органов и тканей, а также как предшественник для синтеза лактозы в период лактации. Откуда же берется глюкоза у коровы, если полисахариды почти полностью метаболизируют у нее до ЛЖК? Эта потребность покрывается за счет участия ЛЖК в процессе глюконеогенеза, протекающего очень интенсивно в печени по схеме:
Пропионат —> сукцинат -» малат —> глюкоза -» гликоген
ЛЖК у жвачных животных поставляют до 70% всей необходимой организму энергии.
этому сахара молока поступают прямо в сычуг и тонкий кишечник.
Продукты гидролиза полисахаридов в основном в форме D-глюкозы, D-галактозы и D-фруктозы в тонком кишечнике хорошо всасываются на основе двух механизмов: Ка+-зависимого трансмембранного активного транспорта с помощью Ка+-К+-АТФазы и Ка+-независимого трансмембранного переноса облегченной диффузии с участием специальных переносчиков. Активный транспорт глюкозы и галактозы осуществляется при участии специальных белков мембран микроворсинок и ионов натрия. За счет ворсинок и микроворсинок площадь кишечника составляет огромную всасывающую поверхность. При повышении внеклеточной концентрации ионов натрия усиливается транспорт глюкозы. Трансмембранный транспорт ионов натрия требует затраты АТФ. Активный транспорт глюкозы и галактозы объясняет большую их скорость всасывания по сравнению с фруктозой и пентозами. Глюкоза является основным моносахаридом в крови животных.
50.
Анаэробный гликолиз представляет запасной путь, способный дать две молекулы АТФ, основного соединения макроэргического метаболизма тканей, из молекулы глюкозы при отсутствии молекулярного кислорода. Это значит, что когда в тканях имеется дефицит кислорода, уровень АТФ может еще поддерживаться, по крайней мере, на короткое время, за счет гликолиза. Так, при рождении животного во всех органах, за исключением мозга, циркуляция крови снижается и энергетика тканей обеспечивается за счет гликолиза до восстановления нормальной циркуляции крови. Это экономит кислород для мозга.
Анаэробный гликолиз — это стадия окисления глюкозы, в которой кислород не является необходимым в клетках и его присутствие может косвенно угнетать процесс. Учитывая, что клетки содержат митохондрии, конечным продуктом гликолиза в присутствии кислорода в первую очередь является пируват, а не молочная кислота. Пирови- ноградная кислота затем может быть полностью окислена в аэробных условиях до С02 и Н20 за счет ферментов митохондрий. Гликолиз при этом служит подготовительным механизмом для полного аэробного окисления глюкозы.
Важность гликолиза установлена для функционирования мозга, имеющего абсолютную потребность в глюкозе, окисление которой протекает через аэробный гликолиз и цикл Кребса до С02 и Н20 в митохондриях клеток. В других тканях гликолиз является основным механизмом продукции АТФ. В частности, эритроциты имеют мало митохондрий, а значит, они не способны активно превращать пиро- виноградную кислоту в С02 и Н20. Роговица, хрусталик глаза имеют недостаток циркуляции крови, число митохондрий, поэтому для них гликолиз важен как источник энергии. Мозговая доля почек, тестикулы, лейкоциты, белые мышечные волокна также в целом зависят от гликолиза, источника АТФ (они сравнительно бедны митохондриями).
В присутствии достаточного количества кислорода глюкоза полностью окисляется до С02 и Н20 (С6Н120б + 602 -» —> 6С02 ■+* 6Н20 + 38АТФ) посредством большого числа взаимосвязанных реакций. Однако эти реакции приводят
Первая реакция гликолиза — гексокиназная, протекающая в цитозоле клетки, в которой глюкоза переходит в активное состояние — в глюкозо-6-фосфат. Реакция протекает с участием фермента гексокиназы. Гексокиназа — своеобразный клапан, снижающий чрезмерно высокий уровень свободной глюкозы в крови, поскольку глюкоза- 6-фосфат не может преодолеть клеточную мембрану и остается в цитоплазме клетки, т. е. «запирается» в клетке. Эта реакция, использующая одну макроэргическую фосфатную связь АТФ, необратима в условиях клетки:
Первой ферментативной реакцией гликолиза является фосфорили-рование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакциякатализируется ферментом гексокиназой:

Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктомреакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной тканиэтот фермент отсутствует (подробнее см. главу 16).
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:

Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второймолекулы АТФ:

Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущейреакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:

Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакциясдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
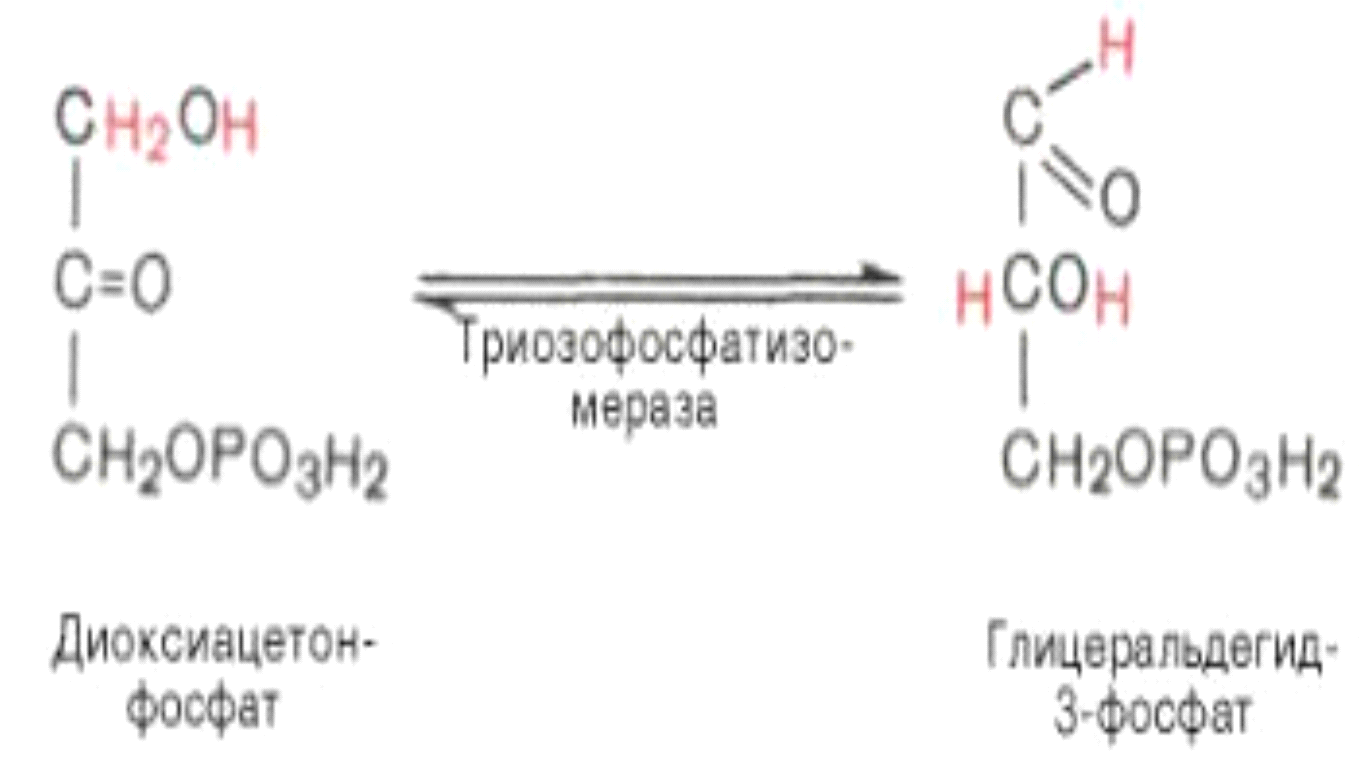
Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД инеорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:Р

1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается смолекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влияниемнеорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):

Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие отокислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат)
Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы водыпереходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:

Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратноефосфорилирование). Катализируется ферментом пируваткиназой:

51
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:

По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратациифермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:

Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.

В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+или Мn2+.
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае вреакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.

Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:

В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, вмолекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:

Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислотагидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью(см. главу 4) – в ходе реакции образуется L-яблочная кислота:

Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходитокисление L-малата в оксалоацетат:

Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулыацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электроновчерез KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратноефосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системеокислительного фосфорилирования может образоваться 12 молекул АТФ.
