
- •Введення
- •1 Аналітичний огляд
- •Сучасний стан виробництва формальдегіду
- •Теоретичні основи процесу
- •2 Технологічна частина
- •2.1 Фізико-хімічна характеристика вихідної сировини, матеріалів і продуктів
- •2.2 Опис технологичного процессу та розробка технологічної схеми
- •2.2.1 Розробка технологічної схеми
- •2.2.2 Нове технологічне рішення
- •2.3 Норми технологічного режиму
- •3 Розрахунки
- •3.1 Матеріальні розрахунки стадій свиробництва формальдегіду
- •Вихідні дані:
- •3.1.2 Розрахунок основних видаткових коефіцієнтів на одиницю продукції, що випускається
- •3.2 Теплоенергетичні розрахунки основних технологічних стадій процесу
- •3.3 Технологічний розрахунок основного устаткування
- •3.3.1 Технологічний розрахунок контактного апарата
- •3.3.2 Розрахунок реактора
- •3.3.3 Технологічний розрахунок спиртовипарювача
- •3.3.3.1 Призначення, пристрій і основні розміри. Визначення кількості апаратів
- •3.3.3.2 Тепловий розрахунок
- •3.3.3.3 Розрахунок спиртовипарювача
- •Технологічний розрахунок підконтактного холодильника
- •3.3.4.1 Призначення, пристрій і основні розміри
- •3.3.4.2 Тепловий розрахунок
- •3.3.4.3 Розрахунок підконтактного холодильника
- •3.4 Характеристика основного технологічного устаткування
- •Розміщення технологічного обладнання
- •4.1 Контроль основних технологічних параметрів процесу
- •4.2 Регулювання технологічних параметрів
- •Сигналізація й блокування
- •5. Техніка безпеки, промсанітарія й протипожежний захист
- •5.1 Основні фізико-хімічні властивості, токсичність, пожежо- та вибухонебезпезпечність речовин, що застосовано та добуто на виробництві
- •5.2 Небезпечні і шкідливі виробничі фактори на виробництві
- •Класифікація і категорійнїсть виробництва і його приміщень
- •5.4 Заходи запобігання шкідливих і небезпечних виробничих факторів
- •5.4.1 Вентиляція і опалювання
- •Заходи, що забезпечують охорону водних ресурсів і повітряного басейну
- •Основні техногенні небезпеки на виробництві
- •Розрахунки основних небезпек виробництва
- •Прогнозування масштабів зони можливого зараження сдор під час аварій (руйнувань) на хімічно небезпечних об‘єктах
- •Повна глибина зони зараження r (км), яка обумовлена дією первинної і вторинної хмари сдор обчислюється таким чином [15]:
- •Засоби та заходи щодо забезпечення підвищення стійкості об'єкту у надзвичайних ситуаціях
- •Індивідуальні та колективні засоби захисту
- •8 Економіка, організація і планування виробництва
- •8.2 Проектовані організаційно-технічні заходи
- •8.3 Проектна потужність і об’єм випуску продукції
- •8.4 Розрахунок зміни собівартості продукції
- •8.4.1 Розрахунок індексів зміни витрат
- •8.4.2 Аналіз зміни собівартості
- •8.5 Розрахунок техніко-економічних показників
- •Висновки
- •Література
Теоретичні основи процесу
Механізм, хімізм, кінетіка та термодінамікка процесів окислювального дегідрування
Під дегідруванням розуміють хімічні процеси, пов'язані із відщепленням атомів водню від органічної сполуки, зокрема від спиртів [1]:
|
RCH2OH RCHO + H2; |
(1.12) |
|
R2CHOH R2CO + H2. |
(1.13) |
Наведені вище перетворення можна проводити за допомогою реакцій окиснення:
|
RR’CHOH + 0,5 О2 RR’CO + H2О. |
(1.14) |
У зв'язку із цим широке поширення одержали процеси окисного дегідрування, коли відщеплення водню здійснюється у присутності молекулярного кисню й кінцеві речовини утворюються як наслідок розвитку процесів окиснення, так і дегідрування:
|
2CH3OH + 0,5 О2 2НCН + H2О + Н2. |
(1.15) |
Ці реакції займають проміжне положення між окисненням і дегідруванням і іноді настільки близько примикають до окиснення, що важко стає провести точну межу між окисненням і окисним дегідруванням [1].
Механізм утворення формальдегіду основан на паралельно- послідовних реакціях, тобто частина продуктів утворюється по первинним хімічним реакціям, а друга частина – по наступним хімічним реакціям за участю продуктів, отриманих у первинних реакціях [2].
Найбільш вірогідним механіхм утворення формальдегіда це окислювально-дегідрогєнізійний. Механізм утворення формальдегіда протікаєчерез адсорбцію кисня на каталізаторі із наступною десорбцією його, при хімічній реакції окиснення метанолу у формальдегід, поміжні продукти реакції – воду та діоксид вуглецю із виділенням молекулярного металлу каталізатора (срібла). Молекулярний каталізатор далі знову адсорбує кисень і знову вступає у реакцію[2].
При заглибленному вивченні хімізма реакцій, протікаючих на каталізаторі по окислювально-дегідрруючому механізму утворення формальдегіду із метанолу, за проведення реакціїокиснення відповідальність несе кисень, адсорбований на срібло у формі Ag(O-)адс., за реакцію дегідрування - зв' язаний атомарний двухзарядний Ag(O2-)адс., а слабо зв' я-заний молекулярний кисень у формі Ag(O-2)адс., забезпечує реакції глубокого окиснення метанолу до СО2 і Н2О (1.5).
Швидкість процессу окислювального дегідрування метанолу у формальдегід при прийнятих виробничих температурних режимах лімітується підводом реагентів до поверхні каталізатора, що вказує на протікання процессу у зовнішньодифузійній області. Швидкість процесу описується рівнянням першого порядку по концентрації кисня. Температурний коефіцієнт швидкості реакції відповідає температурному коефіцієнту дифузії кисня[3].
Окиснення метанолу на окисних каталізаторх протікає по окислювально-відновлювальному механізму, наприклад [3]:
СН3ОН+ 2МоО3→ СН2О + Н2О + МоО5 (1.17)
2МоО3 + 0,5О2 → 2МоО 3 (1.18)
або
СН3ОН+0,5О2→ СН2О + Н2О+ 147,4кДж (1.20)
Лімітуюча стадія як основної, так і побочної реакції- взаємодія метанолу із поверхневим киснем, тобто основний хімічний акт. Утворюющаяся вода оказує гальмуючу дію на обидві реакції. Крім того, метанол гальмує окиснення формальдегіда до окису вуглецю і води.
Окисні каталізатори менш чутливі до домішок, ніж срібляний і його аналоги.
Вираз для швидкості реакції (1.4) та (1.5)-(1.7) при постій ній температурі мають вигляд[3]:
 (1.21)
(1.21)
та
 ,
(1.22)
,
(1.22)
Де
![]() та
та![]() -
константи швидкості лімітуючої стадії,
-
константи швидкості лімітуючої стадії,
a1, a2, a3,b1, b2, b3 – кінетичні коеффіцієнти.
Рівняння
Аррєніуса для ![]() та
та
![]() у мл/(м2с)
та зерен каталізатора визначеного
розміру запропоновані у формі [3]:
у мл/(м2с)
та зерен каталізатора визначеного
розміру запропоновані у формі [3]:
k1=2,33*108exp(-18500/RT) (1.23)
k2=2,05 exp(-3600/RT) (1.24)
Для підтримки активності каталізатора реакцію необхідно проводити у надлишку кисня, оскільки у протилежному випадку під дією метанолу і формальдегіду каталізатор швидко руйнується. Із цього, з урахуванням меж взриву реакційних сумішей, випливає важливіша відмінність отримання формальдегіду на окисних контактах: реакцію проводять при співвідношенні реагентів і повітря нижче нижньої межі взриву, тобто при складі метанолу в вихідній суміші не більше 7-8%. Із порівняння рівнянь k1 та k2 бачимо, що енергії активації головної реакції більш ніж у п'ять разів перевищує той же показник побочної реакції і, тому, вихід формальдегіду повинен збільшуватись при підвищенні температури. Але було доведено, що при температурі вище 400 0С каталізатор втрачає активність. Крім того, при перевищенні цієї межі, з'являються значні втрати формальдегіда через термічний розпад. З урахуванням ціх співвідношень, робоча температура процесу підтримується на рівні 350-390 0С [3].
Процеси окисного дегідрування мають тепловий ефект, що залежить від частки реакцій окиснення й властно дегідрування. Оскільки окиснення завжди протікає з виділенням тепла, введенням тих або інших кількостей кисню можна широко вар’їрувати тепловий ефект сумарної реакції. Це є одним з переваг окисного дегідрування - усуваються эндотермічність процесу й необхідність у постійному підігріві реакційної системи [3].
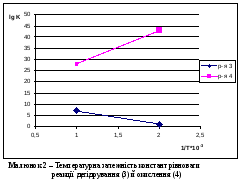
Дуже важливою особливістю реакцій дегідрування є їхня оборотність. Очевидно, що для ендотермічних реакцій дегідрування підвищення температури буде сприяти зсуву рівноваги вправо. Температурні залежності вільної енергії дегідратації спиртів зображені на мал. 1 [1]. Близькі до нуля або негативні значення ΔG° указують на можливість практичного здійснення й на зсув рівноваги у відповідності рівнянням:
|
|
(1.24) |
Як видно з (мал. 1), рівновага більше зміщена вправо у вторинних спиртів (при утворенні кетонів), а менше - для первинних спиртів (особливо для метанолу), що дають при дегідруванні альдегіди.
Як видно з (мал. 2), рівновага реакції дегідрування (1.3) і окислювання (1.4) істотно зрушена у бік утворення продуктів реакції [3]. Значення констант рівноваги для реакцій окисного дегідрування значно вище, ніж для простого дегідрування. Це означає, що реакція (1.4) може розвиватися до практично повного вичерпування реагенту, узятого в недоліку, у цьому випадку кисню, невитрачений метанол може піддаватися лише простому дегідруванню або побічним перетворенням.
При дегідруванні через відщіплення водню завжди відбувається збільшення обсягу газів, і, отже, підвищенню ступеня конверсії сприяє низький тиск, тому ці процеси здійснюють при атмосферному тиску, а в деяких випадках під вакуумом, або, розбавляючи реакційну масу газом або парою, що веде до зниження парціальних тисків реагентів і росту рівноважного ступеня конверсії. Зниження парціального тиску реагентів дозволяє також знизити температуру процесу й тим самим зменшити утворення побічних продуктів.
З
 астосування
каталізаторів дозволяє досягти високої
швидкості процесів при порівнянно
низькій температурі, коли ще не одержують
значного розвитку побічні реакції.
астосування
каталізаторів дозволяє досягти високої
швидкості процесів при порівнянно
низькій температурі, коли ще не одержують
значного розвитку побічні реакції.
Каталізатори реакцій дегідрування й гідрування [1] можна розділити на наступні групи:
метали VIII групи (Fe, Co, Ni, Pd, Pt) і I групи (Cu, Ag);
окисли деяких металів (MgO, Cr2O3, Fe2O3, ZnO, MoO3, WO3 і ін.);
сульфіди кобальту,нікелю,
молібдену й вольфраму;
складні каталізатори, що складаються із двох і більше металів (Ni + Cu), з окислів різних металів (особливо хроміти ZnO·Cr2O3 и CuО·Cr2O3) або сульфідів (NiS∙WS3; CoS∙MoS3 и др.)
Всі вони є або провідниками струму (метали) або напівпровідниками, здатні каталізувати реакції, пов'язані з електронними переходами. Вони дезактивуються контактними отрутами, до яких належать галогени, сірчисті з'єднання, деякі метали, що спричиняється необхідність очищення сировини від цих з'єднань. Сульфіди металів, окисли молібдену й вольфраму стійкі проти дії каталітичних отрут (активність окисів навіть підвищується в присутності сірки) [1].
1.2.2 Селективність процесу окислювального дегідрування
Для дегідрування, завжди здійснюваного при високій температурі, щоб уникнути небажаних побічних реакцій використовують [1] менш активні каталізатори - мідь, срібло, окисли цинку, хрому, заліза й ін.
Дезактивація каталізатора у процесі роботи може бути обумовлена не тільки домішками в сировину, але й розвитком побічних реакцій, що викликають відкладення на його поверхні смолистих речовин і коксу. Регенерацію каталізатора проводять у реакторі або в спеціальному регенераторі окислюванням відкладень повітрям або водяною парою.
При температурах, характерних для виробництва, швидкість перетворення метанолу у формальдегід лімітується підведенням реагентів до поверхні зерен каталізатора, тобто процес протікає у зовнішньодифузійній області [3].
З переходом у зовнішньодифузійну область різко зростає активність і селективність каталізатора, що призводить до значного підвищення продуктивності каталізатора (на 1,5 - 2 порядки). При наявності внутрідифузійного гальмування в тонких порах відбувається неповне згоряння метанолу й формальдегіду до диоксида вуглецю й води.
З підвищенням температури конверсія метанолу монотонно зростає селективність формальдегіду, що утвориться, практично постійна при збільшенні температури від 400 до °700 С, а з подальшим ростом різко знижується [3].
Селективність процесів дегідрування залежить від розвитку послідовних і паралельних реакцій, зв'язаних високою температурою проведення процесу. Наприклад, відбувається крекінг сировини, гидрогеноліз під дією водню, що утвориться, а також реакції полімеризації, циклізації й дегідроконденсації, ведучі, в остаточному підсумку, до виділення смолистих речовин і коксу, дезактивуючих каталізатор.
На тому самому каталізаторі селективність процесу залежить від ряду факторів, у тому числі від відносної реакційної здатності органічних речовин або окремих функціональних груп і від їхньої здатності адсорбуватися на поверхні каталізатора. Часто обоє фактора впливають одночасно або перший з них превалює над другим[3].
Незалежно від вибору каталізатора й інших умов на селективність дегідрування сильно впливає температура. Звичайно чим нижче температура, тим селективніше можна провести процес по більше реакційно здатних групах або зупинити його на певній проміжній стадії. Навпаки, підвищення температури сприяє глибоким перетворенням. Істотно, що небажані побічні реакції гидрогеноліза, крекінгу, дегідроконденсації й інші мають більше високу енергію активації, чим дегідрування. Оскільки при зменшенні температури одночасно зменшуються швидкість процесу й продуктивність реактора, те практично в кожному випадку можна знайти область оптимальних температур, що відповідає мінімуму економічних витрат. Додаткові обмеження на вибір цього оптимуму накладає оборотність реакції дегідрування. Нарешті, за інших рівних умов оборотність залежить від часу контакту, що визначає фактичний ступінь конверсії вихідної речовини. Чим ближче вона до рівноважного, тим значніше розвиток послідовних реакцій крекінгу або конденсації, що ведуть до зниження селективності. При дегідруванні ступінь конверсії становить іноді 20 - 40 %, а час контакту перебуває в межах від часток секунди до декількох секунд [3].
1.2.3 Вибір методу виробництва формаліну
При співставленні двох методів окислювального дегідрування метанолу – на металевих (срібляних) та окисних (залізомолібденових) каталізаторахможна виділити наступні переваги та недоліки :
- на срібляному каталізаторі головною перевагою є висока продуктивність, низька металлоємкість, простота конструкції реактора і що дуже важливо для данного проекту, немає меж по потужності одиничної установки. Але є і недоліки: високий витратний коефіцієнт по сировині, домішкі у продукті, витрата драгоційного металлу;
- на окисних каталізаторах перевагою є низький витратний коефіцієнт по сировині та та практично чистий готовий формалін, але низька продуктивність(8-10 тис. т/р), підвищена витрата енергії та повітря, підвищенна металлоємкість та межі по одиниці потужності установки.
Виходячи із цього у данному проекті розрбляєть схема отримання формальдегіду на срібляному каталізаторі[3].
