
- •1. Скорость химической реакции
- •1.1. Кинетическая классификация реакций
- •1.2. Понятие о скорости химической реакции
- •1.3. Факторы, влияющие на скорость реакции
- •1.3.1. Зависимость скорости реакции от природы реагирующих веществ
- •1.3.2. Зависимость скорости реакции
- •1.3.3. Влияние температуры на скорость реакции
- •1.3.4. Уравнение Аррениуса
- •1.3.5. Влияние среды на скорость реакции
- •1.3.6. Другие факторы, влияющие на скорость химической реакции
- •1.4. Катализ
- •1.4.1. Особенности катализаторов
- •1.4.2. Механизм действия катализаторов согласно теории активации. Гомогенный и гетерогенный катализ
- •1.4.3. Ферментативный катализ
- •1.5. Цепные реакции
- •1.6. Фотохимические реакции
- •1.7. Последовательность расчета кинетических данных
- •1.8. Примеры решения задач
- •2. Химическое равновесие
- •2.1. Обратимые и необратимые реакции
- •2.2. Состояние химического равновесия
- •2.3. Способы выражения константы равновесия
- •2.4. Смещение химического равновесия
- •2.4.1. Влияние изменения концентрации на состояние равновесия
- •2.4.2. Влияние изменения температуры на состояние равновесия
- •2.4.3. Влияние изменения давления на состояние равновесия
- •2.5. Влияние температуры на константу равновесия
- •2.6. Состояние равновесия и катализаторы
- •2.7. Использование кинетических знаний в управлении химическим процессом
- •2.8. Примеры решения задач
- •3. Контрольные вопросы
- •4. Экспериментальная часть
- •Задачи и упраждения для самостоятельной работы
- •2. Влияние температуры и природы веществ на скорость реакции
- •4. Вычисление молярности растворов и равновесных концентраций
2.3. Способы выражения константы равновесия
Константа равновесия может быть выражена различными способами. Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности , т.е. в моль/л, то она обычно обозначается Кс и для равновесия обратимой реакции
аА + bB dD + rR
записывается в виде:
 (2.4)
(2.4)
Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:
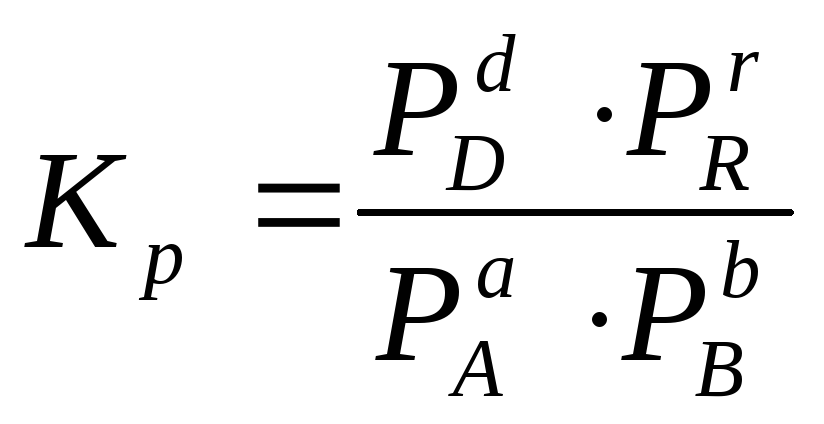 (2.5)
(2.5)
Иногда константу равновесия удобно выразить не через парциальные давления и концентрации, а через количества веществ:
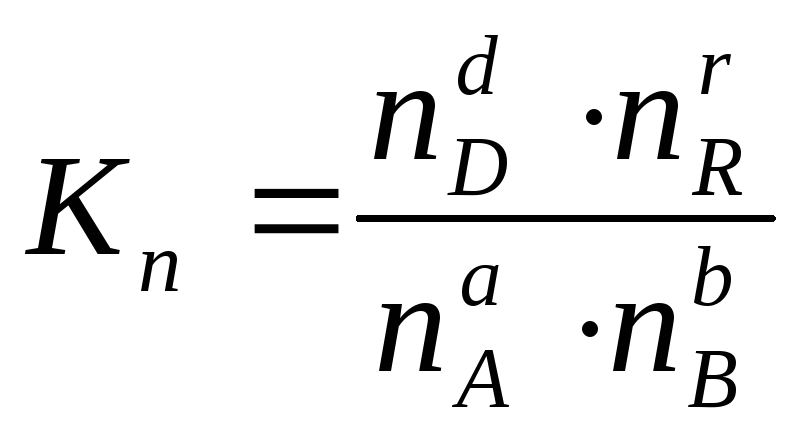 (2.6)
(2.6)
или через соответствующие мольные доли:
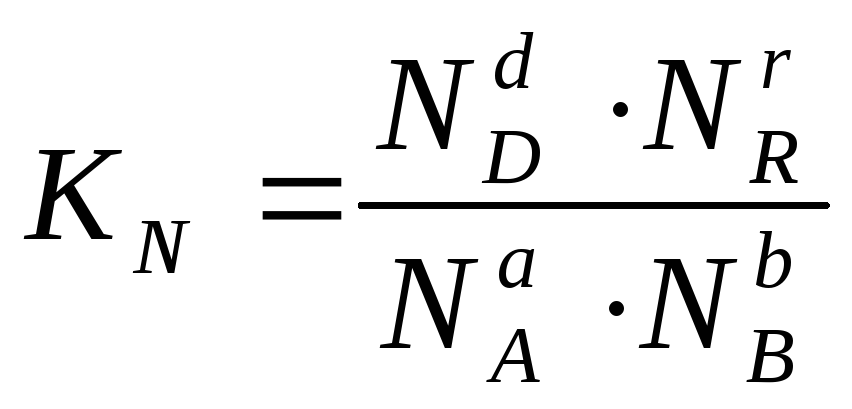 (2.7)
(2.7)
В общем случае константы равновесия Кс, Кр, Кn и КN различны по значениям. Установим связь между ними.
В газовых системах, для характеристики которых применимо уравнение состояния идеальных газов Менделеева – Клайперона, значение парциального давления любого компонента можно вычислить следующим образом:
![]()
откуда
![]()
![]() (2.8)
(2.8)
где C – концентрация i-го компонента, выраженная в моль/л. Подставим значение р из уравнения (2.8) в уравнение (2.5) и получим соотношение, которым определяется связь Кс и Кр:
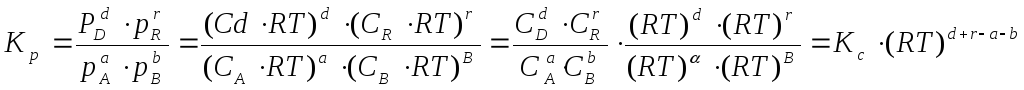
или
![]() ,
(2.9)
,
(2.9)
где
![]() –
изменение числа моль в результате
реакции.
–
изменение числа моль в результате
реакции.
Для идеальных газов парциальные давления связаны с общим давлением Робщ и мольной долей Ni данного компонента в смеси согласно законам Дальтона следующим равенством:
pi = NiPобщ (2.10),
где рi – парциальное давление компонента; Ni – мольная доля этого компонента в смеси; Робщ – общее давление.
Подставим значение рi в уравнение (2.5), получим:
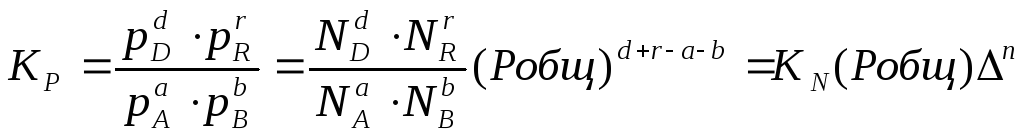
или Кр = К∙ (Робщ)∆n (2.11).
Воспользовавшись
соотношением Pi
= Ni∙
Робщ
=![]() общ)∆n,
общ)∆n,
где ni – число моль компонента i в смеси, а ni – число моль всех компонентов в смеси, получаем:
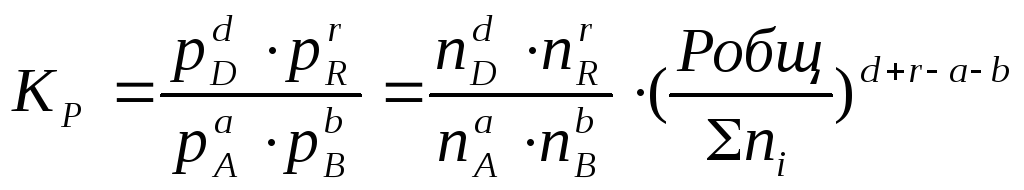 или
или
![]()
Таким образом, если n≠ 0, т.е. если реакция сопровождается изменением числа моль, то имеет место соотношение:
![]() (2.12).
(2.12).
Если же ∆n=0 (реакция не сопровождается изменением числа моль), то Кр = Кс = Кn = KN , т.е. значения всех видов констант равновесия совпадают.
Кр и Кс для реакции идеальных газов не зависят от давления. КN и Кn от давления зависят в случае ∆n≠0.
2.4. Смещение химического равновесия
При постоянных условиях химическое равновесие сохраняется как угодно долго. Однако внешние условия не могут бесконечно оставаться неизменными, а изменение хотя бы одного из них нарушает состояние равновесия, т.е. скорос-
ти прямой и обратной реакций не будут равны между собой (v1 v2). Но, так как все физико-химические системы самопроизвольно стремятся к состоянию равновесия, то с течением времени оно вновь установится. Однако, это будет новое равновесие, с другими значениями равновесных концентраций, отвечающими другим, изменившимся условиям.
В каком направлении сместится равновесие при том или ином внешнем воздействии? Ответ на этот вопрос дает принцип Ле-Шателье Брауна, который можно сформулировать следующим образом: если на систему, находящуюся в состоянии равновесия, оказывается какое – либо внешнее воздействие, то система отвечает таким образом, чтобы это воздействие ослабить. При этом, если в результате нарушения равновесия скорость прямой реакции будет больше скорости обратной реакции, то говорят, что равновесие смещено вправо (v1 v2), и соответственно, если преобладает скорость обратной реакции, говорят, что равновесие смещено влево (v1 v2 ).
Важнейшими условиями, определяющими состояние химического равновесия, являются:
1) концентрация реагирующих веществ
2) температура
3) давление (для реакций, протекающих с изменением давления).
Изменение хотя бы одного из них приведет к нарушению равновесия.
