
Ход работы
Подвести под плавающее кольцо предметное стекло и вынуть его вместе с зародышем и кольцом (рис. 2, Б, В). Поместить стекло в чашку Петри. Рассмотреть зародыш под микроскопом, обливая его теплым физиологическим раствором из пипетки или налив этот раствор в чашку Петри. В условиях практикума вместо физиологического раствора можно использовать теплую воду, что позволяет наблюдать сердечные сокращения в течение нескольких минут.
2) Сделать рисунок тотального препарата эмбриона курицы 4-го дня инкубации. Отметить на нем кровеносные сосуды, зародыш, амнион, амниотическую жидкость, аллантоис, серозную оболочку, хорио-аллантоис, остаток желточной оболочки, остатки халазы, желточный мешок.
3) Сделать выводы по выполненной работе.
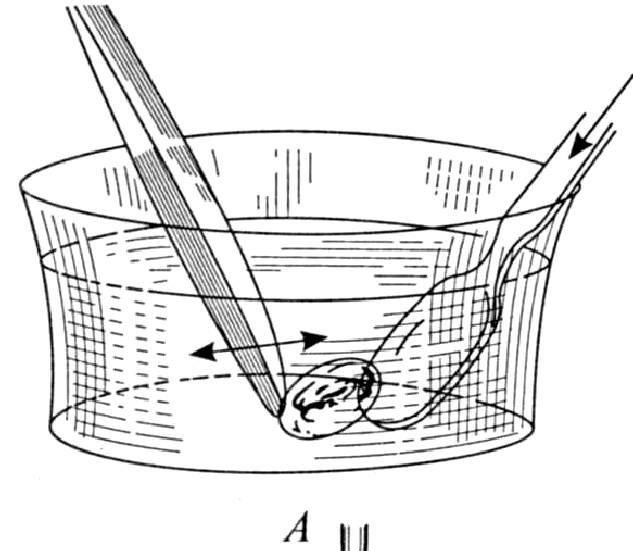

 Рис.2. Приготовление
тотального препарата эмбриона курицы
4-го дня инкубации:
Рис.2. Приготовление
тотального препарата эмбриона курицы
4-го дня инкубации:
А — отмывка от желтка зародыша курицы в кристаллизаторе с теплой водой или физиологическим раствором;
Б, В — перенос препарата на предметное стекло.
Вопросы для самоконтроля
1. Каково систематическое положение курицы домашней?
2. Каковы особенности овуляция яйцеклетки курицы?
3. Что такое инкубация?
4. Как происходит оплодотворение яйцеклетки курицы?
5. Как происходит дробление зиготы?
6. Что такое гаструляция?
7. Что такое нейруляция?
8. Что такое эмбриогенез?
9. Как приготовить тотальный препарат эмбриона курицы 2—4-го дней инкубации?
10. Чем можно объяснить отсутствие гарантии заданной стадии развития зародыша?
11. Как развивается эмбрион курицы по истечении 2-х суток инкубации?
12. Как развивается эмбрион курицы по истечении 4-х суток инкубации?
Лабораторная работа №2 нарушениеэмбрионального морфогенеза амфибий в условиях техногенного загрязнения среды (Методика разработана о. П. Мелеховой)
В раннем
эмбриогенезе имеются особо чувствительные
к повреждающим воздействиям фазы
(«критические периоды» по
П. Г.
Светлову), которые коррелируют с
инициацией экспрессии генов, определяющих
цитодифференцировку, а также связанные
с межклеточными взаимодействиями при
морфогенезе. Эмбрионы амфибий в
критических фазах развития могут служить
в качестве биотестов для оценки
токсичности, вызванной химическими,
электромагнитными или радиоактивными
загрязнениями водной среды. Оценка
эмбриотоксичности водной среды позволяет
заключить, что концентрации поллютантов,
считающиеся допустимыми для взрослых
животных, являются критическими
(вызывающими аномалии развития и
смертность) для эмбрионов. Таким образом,
методы биомониторинга, основанные на
изучении параметров гомеостаза лишь
взрослых гидробионтов, недостаточно
информативны для прогноза воспроизведения
популяций. Возможно, нарушения именно
гомеостаза развития являются причиной
быстрого исчезновения некоторых внешне
благополучных поселений водных
животных.
Принцип предложенного
в лабораторной работе оригинального
метода оценки эмбриотоксичности воды
основан на определении физиологического
состояния зародышей амфибий по
морфологическим аномалиям и смертности
(рис. 1). Применение эмбриональных моделей
в экспериментах по выявлению действия
повреждающих факторов позволяет сделать
предположения о механизмах повреждения,
используя в качестве биотестов эмбрионы
на разных стадиях развития.
 Рис.
1. Типичные аномалии развития амфибий,
вызванные токсичной
средой.
Показаны
асимметрии тела эмбрионов лягушки,
связанные с нарушением развития осевого
зачатка: А — пунктиром представлен
нормальный контур, сплошной линией —
аномалии, приводящие к гибели эмбриона;
Б — стадии гибели эмбрионов амфибий от
качества воды может быть использован
в водной токсикологии, при испытаниях
побочного действия фармакологических
препаратов, пищевых концентратов,
кормовых добавок, при испытаниях
экологической чистоты технологий,
связанных со сбросом сточных вод, при
составлении прогноза изменений в
популяциях различных водных животных
в трансформированных сбросом сточных
вод экосистемах.
Эмбрионы и молодь
водных животных являются уникальной
природной моделью для исследования
механизмов повреждений, вызванных
токсическими агентами. Нарушения
субклеточных процессов, возникающие в
момент воздействия, в результате развития
эмбриона быстро визуализируются и могут
быть зарегистрированы морфометрически
(появление уродств, изменение скорости
или остановка развития). Сочетание
обнаружения первичных процессов
поражения на субклеточном уровне с
морфометрической регистрацией изменений
хода развития позволяет получить
сведения о механизмах повреждений.
Рис.
1. Типичные аномалии развития амфибий,
вызванные токсичной
средой.
Показаны
асимметрии тела эмбрионов лягушки,
связанные с нарушением развития осевого
зачатка: А — пунктиром представлен
нормальный контур, сплошной линией —
аномалии, приводящие к гибели эмбриона;
Б — стадии гибели эмбрионов амфибий от
качества воды может быть использован
в водной токсикологии, при испытаниях
побочного действия фармакологических
препаратов, пищевых концентратов,
кормовых добавок, при испытаниях
экологической чистоты технологий,
связанных со сбросом сточных вод, при
составлении прогноза изменений в
популяциях различных водных животных
в трансформированных сбросом сточных
вод экосистемах.
Эмбрионы и молодь
водных животных являются уникальной
природной моделью для исследования
механизмов повреждений, вызванных
токсическими агентами. Нарушения
субклеточных процессов, возникающие в
момент воздействия, в результате развития
эмбриона быстро визуализируются и могут
быть зарегистрированы морфометрически
(появление уродств, изменение скорости
или остановка развития). Сочетание
обнаружения первичных процессов
поражения на субклеточном уровне с
морфометрической регистрацией изменений
хода развития позволяет получить
сведения о механизмах повреждений.
Цель работы — выявление действия малых доз гамма-излучения на нарушение развития низших позвоночных на примере амфибий. В качестве тест-объекта используются эмбрионы лягушки на стадии закладки нервной системы (нейруляции). Эта фаза развития характеризуется резким повышением уровня окислительного метаболизма и инициацией экспрессии генов, связанных с начальными процессами дифференцировки.
Нарушение этих процессов повреждающими воздействиями через двое суток определяется визуально по морфологическим аномалиям осевого зачатка.
Оборудование и материалы:
лабораторные препараты “Со (или промышленная установка с источником ионизирующего излучения); чашки Петри; зародыши (нейрулы) травяной (Rana temporaria L.) и шпорцевой (Xenopus laevis D.) лягушек — для каждого опыта берется по 25 зародышей, стандартизированных по возрасту; стадии развития объектов определяются по таблицам Н.В.Дабагяна и Л.А. Слепцовой для R. temporaria и по таблице П. Ньюкупа и Дж. Фабера для X. Laevis. ПОРЯДОК ВЫПОЛНЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫ Препараты для лабораторной работы студентов готовятся заранее — за двое-трое суток до начала проведения.
Проинкубировать по 25 зародышей, помещенных в чашки Петри с отстоянной водой в присутствии слабого источника излучения и без него. Длительность у-облучения может составить до 30 ч при мощности дозы 10_й Гр/ч. Получить у преподавателя зародыши лягушек. В таблицу занести данные о возрасте эмбриона (стадии развития), размере, характере аномалий в соответствии с рис. 1, проценте смертности:
|
Источ ник излуче ния |
Доза 7-облу чения |
Стадия развития |
Харак тер анома лий |
Заключение биотес тирова ния |
Гибель/уродство, % |
|||||
|
В начале опыта |
В конце опыта |
Через 1 ч (сутки) |
Суммарно двое суток |
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Действующую дозу у-облучения определить по наличию морфологических аномалий развития (например, асимметрия осевого зачатка, недоразвитие или гипертрофия отделов тела), а также по изменениям в скорости роста и процента смертности зародышей, контактировавших с источником излучения, по сравнению с контролем. Эксперимент ставится в трех повторностях. Сделать вывод об эмбриотоксичности определенных доз облучения на основании сравнения характера распределения регистрируемого признака в опытной и контрольной группе зародышей. Использовать методы непараметрической статистики (например, критерий Пирсона). СПИСОК ЛИТЕРАТУРЫ: Дабагян Н.В. Объекты биологии развития / Н.В.Дабагян, Л. А. Слепцова. — М.: Наука, 1975. Мелехова О. П. Модификации эмбрионального развития при воздействии радионуклидов / О. П. Мелехова (и др.] // Физические проблемы экологии. — М.: Изд-во МГУ, 2001. Мелехова О. П. Исследование нарушений развития гидробионтов как средство оценки загрязнений водной среды // Современные проблемы биоиндикации и биотестирования. — Сыктывкар: Ин-т биологии Уральского отд. РАН, 2001.
