
- •Лабораторная работа №1 химическая термодинамика
- •1. Определение изменения энтальпии реакции нейтрализации
- •3. Выбор направления протекания реакции
- •Лабораторная работа №2 химическая кинетика. Химическое равновесие
- •1. Зависимость скорости реакции от концентрации реагирующих веществ
- •2. Зависимость скорости реакции от температуры
- •3. Катализ
- •1. Каталитическое разложение пероксида водорода
- •2. Автокатализ
- •4. Зависимость скорости реакции от природы реагирующих веществ
- •5. Влияние площади соприкосновения реагирующих веществ на скорость гетерогенной химической реакции
- •6. Способы смещения химического равновесия
- •Лабораторная работа №3 растворы. Процесс растворения. Растворимость
- •1. Тепловые эффекты, вызываемые растворением солей
- •3. Влияние «третьего» вещества на растворимость солей
- •4. Приготовление пересыщенного раствора
- •5. Изменение температуры замерзания и кипения растворов
- •Лабораторная работа №4 электролитическая диссоциация. Обменные реакции в растворах электролитов. Условия образования осадков
- •1. Зависимость электропроводности растворов от силы электролитов
- •2. Зависимость электропроводности раствора от концентрации электролита
- •3. Влияние одноименных ионов на диссоциацию слабого электролита
- •4. Обменные реакции в растворах электролитов
- •5. Условия образования осадков
- •Лабораторная работа №5 гидролиз солей
- •1. Зависимость рН растворов от состава солей
- •2. Влияние температуры на гидролиз
- •3. Зависимость полноты гидролиза от концентрации раствора
- •4. Смещение равновесий гидролиза за счет удаления продуктов
- •5. Полный, взаимно‑усиливающийся гидролиз
- •Лабораторная работа №6 гальванический элемент. Направление протекания окислительно‑восстановительных реакций. Электрохимическая коррозия. Электролиз
- •Гальванический элемент
- •2. Направление протекания окислительно‑восстановительных реакций
- •3. Коррозия
- •1) Влияние гальванопар на скорость коррозии металлов
- •2) Протекторная защита
- •3) Коррозия оцинкованного и луженого железа
- •4) Пассивирование стали
- •5) Термическое оксидирование (воронение) стали
- •3 . Электролиз растворов
- •Лабораторная работа №7 комплексные соединения
- •1. Соединения с комплексным катионом
- •2. Соединения с комплексным катионом
- •3. Поведение комплексных ионов в растворе
- •4. Окраска комплексов
- •5. Комплексы с полидентатными лигандами
- •6. Влияние комплексообразования на окислительно‑восстановительные свойства веществ
- •7. Гидратная изомерия комплексных соединений
2. Влияние температуры на гидролиз
Налейте в пробирку 4‑5 мл раствора ацетата натрия и добавьте 2‑3 капли фенолфталеина. Часть полученного раствора отлейте в другую пробирку и оставьте для сравнения, а оставшийся раствор нагрейте до кипения. Как меняется интенсивность окраски? Охладите раствор и сравните его цвет с цветом контрольного раствора. Дайте объяснения наблюдаемым явлениям.
3. Зависимость полноты гидролиза от концентрации раствора
а) Налейте в пробирку 1 мл раствора хлорида сурьмы (III) НSbCl4 и, интенсивно перемешивая раствор, добавьте по каплям дистиллированную воду до образования осадка во всем объеме. Напишите уравнения гидролиза, считая, что при разбавлении раствора образуется осадок оксохлорида сурьмы SbOCl. Объясните результат опыта.
б) Раствор с осадком разделите на три части, к одной из частей прилейте по каплям концентрированную соляную кислоту, к другой – концентрированную серную кислоту, к третьей – 1‑2 стеклянных ложечки кристаллического хлорида натрия. Затем в каждую пробирку вновь добавьте воду. Что в каждом случае наблюдается и почему?
4. Смещение равновесий гидролиза за счет удаления продуктов
Налейте в пробирку около 2 мл раствора хлорида железа(III) и внесите в него 0,5 стеклянной ложечки магниевого порошка. Результатом какой реакции является выделяющийся газ? Как сказывается протекание этой реакции на полноте гидролиза FeCl3? В чем это проявляется?
5. Полный, взаимно‑усиливающийся гидролиз
В небольшом термостойком стакане слейте вместе по 10‑15 мл растворов соли алюминия и карбоната натрия. Каков состав выпавшего осадка и выделяющегося газа? Составьте уравнение реакции, протекающей при совместном гидролизе двух солей.
Стакан прогрейте на электроплитке, отфильтруйте осадок на воронке Бюхнера, промойте его на фильтре горячей водой для удаления избытка Na2CO3 (как убедиться в полноте промывки осадка?). Докажите опытным путем, что полученный осадок является не карбонатом алюминия, а гидроксидом алюминия.
Какие соли не могут быть получены (не могут существовать) в водном растворе?
Лабораторная работа №6 гальванический элемент. Направление протекания окислительно‑восстановительных реакций. Электрохимическая коррозия. Электролиз
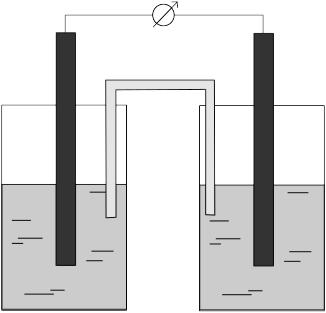
Гальванический элемент
И
Рис.5. Схема гальванического элемента
Рассчитайте ожидаемое значение ЭДС для каждого гальванического элемента, использованного в опыте. Составьте схемы гальванических элементов, указав катод и анод и направление движения тока в цепи.
Как изменится ЭДС гальванического элемента, если один из растворов солей разбавить в 10 раз? Рассчитайте ЭДС для данного случая и измерьте, разбавив соответствующий раствор в 10 раз. Вновь сравните расчетное и экспериментальное значения. Как следует изменять концентрацию раствора в прикатодном пространстве (в прианодном пространстве), чтобы повысить ЭДС гальванического элемента?
