
- •Лабораторная работа №1 химическая термодинамика
- •1. Определение изменения энтальпии реакции нейтрализации
- •3. Выбор направления протекания реакции
- •Лабораторная работа №2 химическая кинетика. Химическое равновесие
- •1. Зависимость скорости реакции от концентрации реагирующих веществ
- •2. Зависимость скорости реакции от температуры
- •3. Катализ
- •1. Каталитическое разложение пероксида водорода
- •2. Автокатализ
- •4. Зависимость скорости реакции от природы реагирующих веществ
- •5. Влияние площади соприкосновения реагирующих веществ на скорость гетерогенной химической реакции
- •6. Способы смещения химического равновесия
- •Лабораторная работа №3 растворы. Процесс растворения. Растворимость
- •1. Тепловые эффекты, вызываемые растворением солей
- •3. Влияние «третьего» вещества на растворимость солей
- •4. Приготовление пересыщенного раствора
- •5. Изменение температуры замерзания и кипения растворов
- •Лабораторная работа №4 электролитическая диссоциация. Обменные реакции в растворах электролитов. Условия образования осадков
- •1. Зависимость электропроводности растворов от силы электролитов
- •2. Зависимость электропроводности раствора от концентрации электролита
- •3. Влияние одноименных ионов на диссоциацию слабого электролита
- •4. Обменные реакции в растворах электролитов
- •5. Условия образования осадков
- •Лабораторная работа №5 гидролиз солей
- •1. Зависимость рН растворов от состава солей
- •2. Влияние температуры на гидролиз
- •3. Зависимость полноты гидролиза от концентрации раствора
- •4. Смещение равновесий гидролиза за счет удаления продуктов
- •5. Полный, взаимно‑усиливающийся гидролиз
- •Лабораторная работа №6 гальванический элемент. Направление протекания окислительно‑восстановительных реакций. Электрохимическая коррозия. Электролиз
- •Гальванический элемент
- •2. Направление протекания окислительно‑восстановительных реакций
- •3. Коррозия
- •1) Влияние гальванопар на скорость коррозии металлов
- •2) Протекторная защита
- •3) Коррозия оцинкованного и луженого железа
- •4) Пассивирование стали
- •5) Термическое оксидирование (воронение) стали
- •3 . Электролиз растворов
- •Лабораторная работа №7 комплексные соединения
- •1. Соединения с комплексным катионом
- •2. Соединения с комплексным катионом
- •3. Поведение комплексных ионов в растворе
- •4. Окраска комплексов
- •5. Комплексы с полидентатными лигандами
- •6. Влияние комплексообразования на окислительно‑восстановительные свойства веществ
- •7. Гидратная изомерия комплексных соединений
3. Влияние «третьего» вещества на растворимость солей
В две сухие пробирки налейте насыщенный (лучше свежеприготовленный) раствор хлорида натрия и добавьте в одну из них раствор концентрированной соляной кислоты, а в другую – этиловый спирт. Чем можно объяснить эффект «высаливания» в каждом случае?
4. Приготовление пересыщенного раствора
Положите несколько кристаллов Na2S2O3·5H2O в сухую пробирку и медленно нагрейте. Что происходит? Составьте уравнение протекающей реакции. Закрыв пробирку ватой, дайте ей охладиться до комнатной температуры. После охлаждения пробирку резко встряхните или внесите в раствор маленький кристаллик исходного вещества. Опишите наблюдаемое явление.
Дайте термодинамическое и кинетическое объяснение процессам, инициируемым на последнем этапе опыта.
5. Изменение температуры замерзания и кипения растворов
а) Две пробирки, одна из которых наполовину заполнена дистиллированной водой, а вторая – 10%‑ным раствором хлорида натрия, поместите в стакан с охладительной смесью (лед с поваренной солью). Отметьте температуру замерзания воды и раствора хлорида натрия.
б) Пробирку с дистиллированной водой, закрепленную в штативе, нагрейте до кипения и измерьте температуру кипения воды. Уберите спиртовку и внесите в пробирку 1‑2 ложечки сухого хлорида кальция. Вновь доведите раствор до кипения и измерьте температуру кипения раствора.
Как и почему изменяется температура кипения и замерзания растворов в сравнении с чистым растворителем?
Лабораторная работа №4 электролитическая диссоциация. Обменные реакции в растворах электролитов. Условия образования осадков
1. Зависимость электропроводности растворов от силы электролитов
Рис.4. Схема прибора для изучения
электропроводности растворов
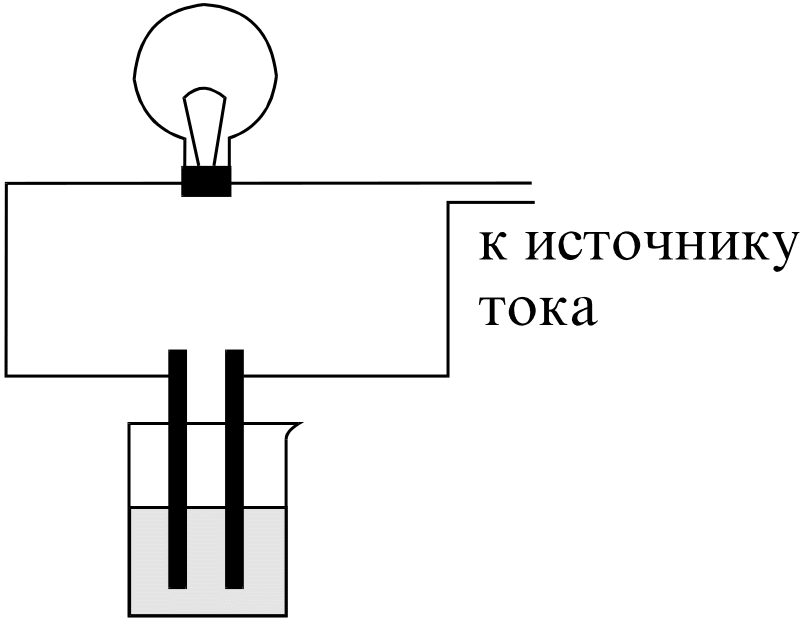
Такой же опыт повторите с дистиллированной и водопроводной водой, раствором глицерина, 0,1М растворами аммиака, соляной и азотной кислоты, гидроксидов калия и натрия, хлорида кальция, а также с насыщенным раствором сульфата кальция. Объясните результаты. Составьте уравнения электролитической диссоциации всех рассмотренных в данном опыте электролитов. После каждого испытания выключайте прибор из сети и промывайте стаканчик и электроды дистиллированной водой!
Слейте растворы уксусной кислоты и аммиака в один стакан и определите электропроводность полученного раствора. Объясните полученный результат.
Всегда ли процесс растворения молекулярных и ионных веществ сопровождается электролитической диссоциацией?
2. Зависимость электропроводности раствора от концентрации электролита
Измерьте электропроводность концентрированного раствора уксусной кислоты и сделайте вывод о силе данного электролита. Разбавьте этот раствор водой в соотношении примерно 4:1 (для этого кислоту долейте к заранее отмеренному количеству воды) и вновь изучите электропроводность. После этого раствор разбавьте вдвое и повторите измерение электропроводности. Обоснуйте наблюдаемые явления.
(Опыт выполняется демонстрационно).
