
- •Лабораторная работа №1 химическая термодинамика
- •1. Определение изменения энтальпии реакции нейтрализации
- •3. Выбор направления протекания реакции
- •Лабораторная работа №2 химическая кинетика. Химическое равновесие
- •1. Зависимость скорости реакции от концентрации реагирующих веществ
- •2. Зависимость скорости реакции от температуры
- •3. Катализ
- •1. Каталитическое разложение пероксида водорода
- •2. Автокатализ
- •4. Зависимость скорости реакции от природы реагирующих веществ
- •5. Влияние площади соприкосновения реагирующих веществ на скорость гетерогенной химической реакции
- •6. Способы смещения химического равновесия
- •Лабораторная работа №3 растворы. Процесс растворения. Растворимость
- •1. Тепловые эффекты, вызываемые растворением солей
- •3. Влияние «третьего» вещества на растворимость солей
- •4. Приготовление пересыщенного раствора
- •5. Изменение температуры замерзания и кипения растворов
- •Лабораторная работа №4 электролитическая диссоциация. Обменные реакции в растворах электролитов. Условия образования осадков
- •1. Зависимость электропроводности растворов от силы электролитов
- •2. Зависимость электропроводности раствора от концентрации электролита
- •3. Влияние одноименных ионов на диссоциацию слабого электролита
- •4. Обменные реакции в растворах электролитов
- •5. Условия образования осадков
- •Лабораторная работа №5 гидролиз солей
- •1. Зависимость рН растворов от состава солей
- •2. Влияние температуры на гидролиз
- •3. Зависимость полноты гидролиза от концентрации раствора
- •4. Смещение равновесий гидролиза за счет удаления продуктов
- •5. Полный, взаимно‑усиливающийся гидролиз
- •Лабораторная работа №6 гальванический элемент. Направление протекания окислительно‑восстановительных реакций. Электрохимическая коррозия. Электролиз
- •Гальванический элемент
- •2. Направление протекания окислительно‑восстановительных реакций
- •3. Коррозия
- •1) Влияние гальванопар на скорость коррозии металлов
- •2) Протекторная защита
- •3) Коррозия оцинкованного и луженого железа
- •4) Пассивирование стали
- •5) Термическое оксидирование (воронение) стали
- •3 . Электролиз растворов
- •Лабораторная работа №7 комплексные соединения
- •1. Соединения с комплексным катионом
- •2. Соединения с комплексным катионом
- •3. Поведение комплексных ионов в растворе
- •4. Окраска комплексов
- •5. Комплексы с полидентатными лигандами
- •6. Влияние комплексообразования на окислительно‑восстановительные свойства веществ
- •7. Гидратная изомерия комплексных соединений
3) Коррозия оцинкованного и луженого железа
В две пробирки налейте 3‑4 мл 0,1 М раствора серной кислоты, добавьте в каждую из них 2‑3 капли раствора гексацианоферрата(III) калия и опустите полоски оцинкованного и луженого железа, сделав предварительно на них глубокие царапины. В какой пробирке и почему появляется интенсивно‑синее окрашивание? Составьте уравнения катодного и анодного процессов для каждого случая. Какое покрытие является катодным? анодным? Сравните эффективность катодного и анодного покрытий.
4) Пассивирование стали
Зачистите наждаком два гвоздя. Один гвоздь пассивируйте, опустив его в пробирку с концентрированным раствором азотной кислоты. Ополосните гвоздь водой и вновь опустите в тот же раствор, после чего гвоздь достаньте и сполосните водой.
Обработанный и необработанный концентрированной кислотой гвоздь поместите в две пробирки с разбавленным раствором серной кислоты. В каком случае скорость выделения газа (какого?) больше?
5) Термическое оксидирование (воронение) стали
Очистите наждаком две стальные пластинки. Проведите оксидирование одной из них, для чего нагрейте пластинку в пламени горелки до появления цветов побежалости, т.е. до появления оксидных пленок, которые ввиду своей различной толщины вызывают интерференцию света и потому окрашиваются в разные цвета. Нанесите по капле раствора сульфата меди на оксидированный и неоксидированный образцы и по скорости появления пятна меди оцените защитные свойства образовавшейся пленки.
3 . Электролиз растворов
а) Электролиз водных растворов иодида калия и сульфата натрия
П
Рис.6. Схема электролизера
с графитовыми электродами
В U‑образную трубку (рис.6) налейте раствор одной из солей, опустите в оба колена графитовые электроды, подсоединенные к внешнему источнику постоянного электрического тока. Включите прибор и подайте напряжение на электроды. Что наблюдается? Обнаружьте продукты электролиза предложенными способами.
б) Влияние перенапряжения на состав продуктов электролиза
Используя данные по стандартным электродным потенциалам и учитывая перенапряжение по водороду и кислороду, обоснуйте состав продуктов электролиза водного раствора хлорида цинка. Как обнаружить ожидаемые продукты? Составьте уравнения катодных и анодных процессов, суммарные уравнения с разделенными катодным и анодным пространствами и при перемешивании раствора.
П
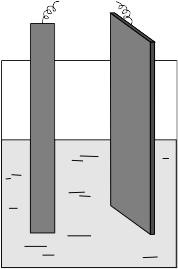
в) Влияние материала анода на состав продуктов электролиза
О
Рис.7. Схема электролизера
с медным анодом
В большой стакан (рис.7) налейте 1М раствор серной кислоты и закройте его крышкой с закрепленными в ней графитовым и медным электродами. Подсоедините электроды к внешнему источнику постоянного тока так, чтобы медный электрод поляризовался анодно. Включите питание, подайте напряжение на электроды. Что наблюдается? Почему на графитовом электроде водород и медь выделяются одновременно?
После окончания опыта графитовый электрод погрузите в 10%‑ный раствор азотной кислоты (зачем?), после чего промойте водой.
