
- •1. Фотоэффект. Уравнение Энштейна для фотоэффекта.
- •2. Понятие красной границы фотоэффекта
- •3. Эффект Комптона
- •4. Корпускулярно-волновой дуализм. Волны де-Бройля
- •5. Принцип неопределенности Гейзенберга
- •7. Волновая функция и ее физический смысл
- •8. Стационарное уравнение Шредингера
- •9. Частица в потенциальной яме
- •10. Туннельный эффект
- •11. Теория водородоподобного атома Бора
- •12. Постулаты Бора
- •13. Квантовые переходы. Серии Лаймана, Бальмера, Пашена, Брэккета, Пфунда
- •14. Квантовые числа
- •15. Понятие спина
- •16. Принцип Паули. Фермионы и бозоны
- •17. Статистика Ферми-Дирака и Бозе-Энштейна
- •18. Понятие абсолютно черного тела
- •19. Отражательная способность. Излучательная способность
- •20. Закон Стефана-Больцмана
- •21. Законы смещения Вина
13. Квантовые переходы. Серии Лаймана, Бальмера, Пашена, Брэккета, Пфунда
Квантовые переход - скачкообразные переходы квантовой системы (атома, молекулы, атомного ядра, твёрдого тела) из одного состояния в другое. При переходе с более высокого уровня энергии Ek на более низкий Ei система отдаёт энергию Ek — Ei, при обратном переходе — получает её (рис.). К. п. могут быть излучательными и безызлучательными. При излучательных К. п. система испускает (переход Ek → Ei) или поглощает (переход Ei → Ek) квант электромагнитного излучения — Фотон — энергии hν (ν — частота излучения, h — Планка постоянная), удовлетворяющей фундаментальному соотношению
Ek - Ei = hν, (1)
(которое представляет собой закон сохранения энергии при таком переходе). В зависимости от разности энергий состояний системы, между которыми происходит К. п., испускаются или поглощаются фотоны радиоизлучения, инфракрасного, видимого, ультрафиолетового, рентгеновского излучения, γ-излучения. Совокупность излучательных К. п. с нижних уровней энергии на верхние образует спектр поглощения данной квантовой системы, совокупность обратных переходов — её спектр испускания.
С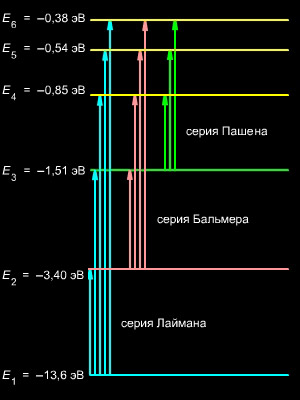 пектральные
серии водорода —
набор спектральных
серий,
составляющих спектр атома водорода.
Поскольку водород — наиболее простой
атом,
его спектральные серии наиболее изучены.
Они хорошо подчиняются формуле
Ридберга:
пектральные
серии водорода —
набор спектральных
серий,
составляющих спектр атома водорода.
Поскольку водород — наиболее простой
атом,
его спектральные серии наиболее изучены.
Они хорошо подчиняются формуле
Ридберга:
![]() ,
,
где
R = 109 677 см−1 —
постоянная
Ридберга
для водорода,
![]() —
основной уровень серии. Спектральные
линии возникающие при переходах на
основной энергетический уровень
называются резонансными, все остальные —
субординатными.
—
основной уровень серии. Спектральные
линии возникающие при переходах на
основной энергетический уровень
называются резонансными, все остальные —
субординатными.
Открыта Т. Лайманом в 1906 году. Все линии серии находятся в ультрафиолетовом диапазоне. Серия соответствует формуле Ридберга при n' = 1 и n = 2, 3, 4,… Линия Lα = 1216 Å является резонансной линией водорода. Граница серии — 911,8 Å.
Открыта И. Я. Бальмером в 1885 году. Первые четыре линии серии находятся в видимом диапазоне. Серия соответствует формуле Ридберга при n' = 2 и n = 3, 4, 5,… Линия Hα = 6565 Å. Граница серии — 3647 Å.
Предсказана Ритцем в 1908 году на основе комбинационного принципа. Открыта Ф. Пашеном в том же году. Все линии серии находятся в инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 3 и n = 4, 5, 6,… Линия Pα = 18756 Å. Граница серии — 8206 Å.
Открыта Ф. С. Брэккетом в 1922 году. Все линии серии находятся в далёком инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 4 и n = 5, 6, 7,… Линия Bα = 40522 Å. Граница серии — 14588 Å.
Открыта А. Г. Пфундом в 1924 году. Все линии серии находятся в далёком инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 5 и n = 6, 7, 8,… Линия Pfα = 74598 Å. Граница серии — 22794 Å.
Открыта К. Д. Хэмпфри в 1953 году. Все линии серии находятся в далёком инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 6 и n = 7, 8, 9,… Основная линия 123718 Å. Граница серии — 32823 Å.
14. Квантовые числа
Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые
квантовые числа связаны с движением в
пространстве и характеризуют вид
волновой
функции частицы. Это, например,
радиальное (главное)
(![]() ),
орбитальное
(
),
орбитальное
(![]() )
и магнитное
(
)
квантовые числа электрона в атоме,
которые определяются как число узлов
радиальной волновой функции, значение
орбитального углового момента и его
проекция на заданную ось, соответственно.
)
и магнитное
(
)
квантовые числа электрона в атоме,
которые определяются как число узлов
радиальной волновой функции, значение
орбитального углового момента и его
проекция на заданную ось, соответственно.
