
- •Содержание
- •Введение
- •Периодическая система элементов
- •Структура периодической системы элементов
- •Изменение свойств элементов и их соединений в периодах и главных подгруппах
- •Расположение электронов по энергетическим уровням
- •Квантовые числа
- •Ядро атома. Изотопы
- •Химическая связь
- •Ковалентная связь
- •Основные характеристики ковалентной связи
- •Гибридизация атомных орбиталей
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Вопросы для подготовки к занятию
- •Задания для выполнения контрольных заданий для студентов заочной формы обучения и индивидуальных заданий для дневной формы обучения
- •Тема 1 Периодическая система элементов. Строение атома
- •Пример выполнения задания
- •Тема 2 Химическая связь
- •Пример выполнения задания
- •Тема 3 Химическая термодинамика
- •Пример выполнения задания
- •Тема 4 Кинетика химических реакций
- •Пример выполнения задания
- •Тема 5 Химическое равновесие
- •Пример выполнения задания
- •Решение
- •Тема 6 Растворы. Способы выражения концентрации растворов
- •Пример выполнения задания
- •Решение
- •2. Проведение расчетов перехода от заданной концентрации к указанным
- •Тема 7 Растворы электролитов
- •Пример выполнения задания
- •Тема 8 Гидролиз
- •Пример выполнения задания
- •Тема 9 Комплексные соединения
Тема 2 Химическая связь
Определите тип химических связей в молекулах, указанных в таблице 12. Изобразите схемы перекрывания валентных орбиталей при образовании ковалентных связей в выделенных молекулах.
Таблица 12 – Контрольные задания по теме 2
№ задачи |
Молекулы |
№ задачи |
Молекулы |
1 |
H2O , H2S |
8 |
CH3Cl, РСl3 |
2 |
NН3, РН3 |
9 |
С2Н4, AsCl3 |
3 |
АlCl3, HCl |
10 |
CO2, AsH3 |
4 |
CH4, N2 |
11 |
AlH3, H2Te |
5 |
NF3, F2 |
12 |
BCl3, BeO |
6 |
CCl4, H2Se |
13 |
CH3OH, Br2 |
7 |
SiCl4, РCl3 |
14 |
HNO2 (N – sp2), N2 |
Пример выполнения задания
CO2 Тип химической связи определяем исходя из электроотрицательностей элементов, образующих химическую связь:
(О – C) = 3,50 – 2,50 = 1,00 – связь ковалентная полярная
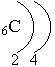 электронная
формула углерода:
электронная
формула углерода:
1s22s22p2 – это р-элемент
![]()
![]()
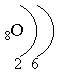 электронная
формула кислорода:
электронная
формула кислорода:
1s22s22p4 – это р-элемент
![]()
![]() или
или
связь ковалентная структурная
полярная формула молекулы
(электронная
формула молекулы)
Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию молекул. Так, при комбинации одной s- и одной р-орбитали возникают две sр-гибридные орбитали расположенные симметрично под углом 180. Отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180. Например, у атома углерода sp-гибридизация орбиталей проявляется в молекуле СО2, которая вследствие этого имеет линейную форму:
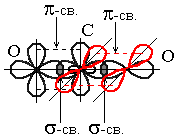
У углерода sp – гибридные орбитали; форма молекулы – линейная; OCO=180.
Тема 3 Химическая термодинамика
(выполняют только студенты нехимических специальностей)
Вычислить
![]() (стандартное изменение энергий Гиббса)
и
(стандартное изменение энергий Гиббса)
и
![]() (стандартное изменение энергии
Гельмгольца) для реакции (см. табл. 13) и
определить, в какую сторону пойдет
реакция в данных условиях
(стандартное изменение энергии
Гельмгольца) для реакции (см. табл. 13) и
определить, в какую сторону пойдет
реакция в данных условиях
Таблица 13 – Контрольные задания по теме 3
№ задачи |
Реакции |
№ задачи |
Реакции |
||
1 |
2H2 + CO CH3OH(г) |
12 |
2HCl(г) H2(г) + Cl2(г) |
||
2 |
2CO2 2CO + O2 |
13 |
MgCO3(т) MgO(т) + CO2 |
||
3 |
C2H6(г) C2H4(г) + H2(г) |
14 |
4NH3(г) + 5O2 4NO + 6H2O(г) |
||
4 |
C + H2O(г) CO + H2 |
15 |
2CO2 2CO + O2 |
||
Продолжение таблицы 13 |
|||||
№ задачи |
Реакции |
№ задачи |
Реакции |
||
5 |
H2 + HCOH(г) CH3OH(г) |
16 |
C2H5OH(ж) C2H4(г) + H2O(ж) |
||
6 |
2NO2 2NO(г) + O2 |
17 |
CH3COOH(г) + 2H2 2CH3OH(г) |
||
7 |
SO2 + Cl2 SO2Cl2(г) |
18 |
4HCl(г) + O2 2H2O(г) + 2Cl2(г) |
||
8 |
CO2 + 4H2 CH4 + 2H2O(г) |
19 |
CO + 3H2 CH4 + H2O(г) |
||
9 |
CH4 + CO2 2CO + 2H2 |
20 |
C2H4(г) + 3O2 2CO2 + 2H2O(ж) |
||
10 |
CO + H2O(ж) CO2 + H2 |
21 |
2SO2 + O2 2SO3 |
||
11 |
Fe3O4(т)+4H2(г)3Fe(т)+4H2O(г) |
22 |
CH3CHO(г) + H2 C2H5OH(ж) |
||
