
- •Содержание
- •Введение
- •Периодическая система элементов
- •Структура периодической системы элементов
- •Изменение свойств элементов и их соединений в периодах и главных подгруппах
- •Расположение электронов по энергетическим уровням
- •Квантовые числа
- •Ядро атома. Изотопы
- •Химическая связь
- •Ковалентная связь
- •Основные характеристики ковалентной связи
- •Гибридизация атомных орбиталей
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •Вопросы для подготовки к занятию
- •Задания для выполнения контрольных заданий для студентов заочной формы обучения и индивидуальных заданий для дневной формы обучения
- •Тема 1 Периодическая система элементов. Строение атома
- •Пример выполнения задания
- •Тема 2 Химическая связь
- •Пример выполнения задания
- •Тема 3 Химическая термодинамика
- •Пример выполнения задания
- •Тема 4 Кинетика химических реакций
- •Пример выполнения задания
- •Тема 5 Химическое равновесие
- •Пример выполнения задания
- •Решение
- •Тема 6 Растворы. Способы выражения концентрации растворов
- •Пример выполнения задания
- •Решение
- •2. Проведение расчетов перехода от заданной концентрации к указанным
- •Тема 7 Растворы электролитов
- •Пример выполнения задания
- •Тема 8 Гидролиз
- •Пример выполнения задания
- •Тема 9 Комплексные соединения
Тема 1 Периодическая система элементов. Строение атома
Для указанных в таблице 11 элементов составьте электронные и электронно-графические формулы. Укажите валентные электроны. Определите валентные возможности элемента и степени окисления. Напишите формулы возможных соединений этих элементов с кислородом. Укажите характер оксидов, уравнениями реакций докажите их важнейшие химические свойства.
Таблица 11 – Контрольные задания по теме 1
№ задачи |
Элементы |
№ задачи |
Элементы |
1 |
Ba, Zn |
10 |
Sn, Co |
2 |
Si, Cd |
11 |
I, Ni |
3 |
Al, Hg |
12 |
Pb, Zn |
4 |
Рb, Ti |
13 |
Cl, Cd |
5 |
Bi, Mn |
14 |
N, Au |
6 |
I, Fe |
15 |
Ca, W |
7 |
Te, Cu |
16 |
Rb, Cu |
8 |
Se, Ag |
17 |
Sb, Mn |
9 |
S, Au |
18 |
Si, Ag |
Пример выполнения задания
Галлий располагается в IV периоде (следовательно, у него 4 энергетических уровня), III группе (следовательно, сумма валентных электронов равна 3) главной подгруппе (следовательно, валентными являются s- и p-электроны внешнего энергетического уровня; на внешнем энергетическом уровне находится 3 электрона):
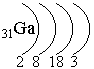 – распределение
электронов по энергетическим уровням
– распределение
электронов по энергетическим уровням
Электронная формула: 1s2 2s22p6 3s23p6 4s23d104p1 (табл. 4, с. 16)
валентные электроны: 4s24p1 – это р-элемент.
Электронно-графическая формула галлия:
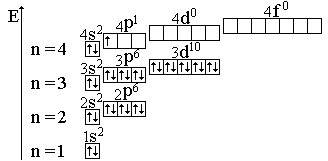
Е – энергия, следовательно, приведенная схема является не только электронно-графической формулой, но и энергетической диаграммой;
n – главное квантовое число, которое совпадает с номером энергетического уровня
Определяем валентные возможности галия, для этого распишем валентные электроны атома по орбиталям в нормальном (н. с.) и возбужденном состоянии (в. с.).
![]()
В – валентность, которая совпадает с числом неспаренных электронов. н. с., степень окисления равна +1, валентность равна 1.
У галлия на внешнем энергетическом уровне есть свободные 4р- орбитали, поэтому один электрон с 4s-орбитали при возбуждении перейдет на свободную 4р-орбиталь:
![]()
* – возбужденное состояние.
в. с., степень окисления – +3.
Галлий имеет три валентных электрона на s- и р-орбитали внешнего энергетического уровня. В невозбужденном состоянии неспарен только р-электрон. Соответственно в соединениях эти элементы могут проявлять степень окисления +1. Однако, для элементов IIIA-группы более характерна степень окисления +3. это обусловлено тем, что переход электронов с s- на р-подуровень требует не очень большой затраты энергии (возбужденное состояние). Затраты полностью компенсируются при образовании дополнительных химических связей.
Оксид Ga2О3 и гидроксид Ga(ОН)3 амфотерны.
Ga2О3 – амфотерный оксид, основная и кислотная функции проявляются примерно в одинаковой степени.
Ga2О3 + 6HCl GaCl3 + 3H2О
Ga2О3 + 6NaOH + 3H2О 2Na3[Ga(OH)6]
Производные Ga+1 неустойчивы и являются сильными восстановителями.
Скандий располагается в IV периоде (следовательно, у него 4 энергетических уровня), III группе (следовательно, сумма валентных электронов равна 3) побочной подгруппе (следовательно, валентными являются s-электроны внешнего энергетического уровня и d-электроны предвнешнего энергетического уровня; на внешнем энергетическом уровне находится 2 электрона).
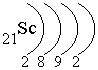 –
распределение
электронов по энергетическим уровням
–
распределение
электронов по энергетическим уровням
Электронная формула: 1s2 2s22p6 3s23p6 4s23d1.
валентные электроны: 4s23d1 – это d-элемент.
Электронно-графическая формула скандия:
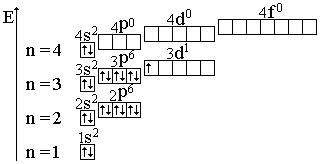
Определяем валентные возможности скандия, для этого распишем валентные электроны атома по орбиталям в нормальном (н. с.) и возбужденном состоянии (в. с.).
![]()
н. с., степень окисления равна +1, валентность равна 1.
У скандия на внешнем энергетическом уровне есть свободные 4р- орбитали, поэтому один электрон с 4s-орбитали при возбуждении перейдет на свободную 4р-орбиталь; электрон с 3 энергетического уровня перейти на 4 энергетический уровень не может:
![]()
* – возбужденное состояние.
в. с., степень окисления – +3.
Для скандия характерна только степень окисления +3.
Соединение
с кислородом:
![]() – амфотерный оксид (по химическим
свойствам напоминает Al2O3).
– амфотерный оксид (по химическим
свойствам напоминает Al2O3).
Sc2O3 + 6HCl 2ScCl3 + 3H2O
Sc2O3 + 2NaOH NaScO2 + H2O
метаскандинат
натрия
