
zadachi_enzymes
.docПримеры задач к занятию № 2 по теме «Ферменты»
1. Известно, что карбоангидраза сильно ингибируется ацетазоламидом, применяемым как мочегонное средство и как препарат для лечения глаукомы, характеризующейся чрезмерным повышением внутриглазного давления. В этих и других секреторных процессах карбоангидраза играет важную роль, поскольку она участвует в регуляции рН и содержания бикарбоната во многих жидкостях организма человека.

На рисунке показана экспериментальная кривая, выражающая зависимость скорости реакции, катализируемой карбоангидразой, от концентрации субстрата. При проведении опыта в присутствии ацетазоламида получается нижняя кривая. Исходя из анализа кривых и Ваших знаний о кинетических свойствах конкурентных и неконкурентных ингибиторов ферментов, оцените каков механизм ингибирования ацетазоламидом. Объясните, на чем основано Ваше утверждение.
2. После инкубации с p-хлоромеркуриобензоатом связывание фермента с субстратом не изменилось по сравнению с необработанным ферментом, но каталитическая активность фермента уменьшилась на 40%. Какой вывод можно сделать из этого наблюдения?
3. Фермент конкурентно ингибируется в разной степени при одной и той же концентрации трех ингибиторов I1, I2 и I3. Константы диссоциации ингибиторов K(I1) = 0,1 ммоль/л, K(I2) = 0,01 ммоль/л, K(I3) = 1,0 ммоль/л. Какой ингибитор будет вызывать наибольшее ингибирование? Наименьшее?
4. Фермент глутаматдегидрогеназа катализирует реакцию превращения L-глутамата в aльфа - кетоглутарат. Кинетические данные зависимости изменения начальной скорости реакции от концентрации L - глутамата приведены в таблице:
-
Концентрация
L – глутамата, ммоль/л
Начальная скорость
(образование НАДН, оценена по увеличению
оптической плотности раствора)
условных единиц в минуту
1,68
3,33
5,00
6,67
10,00
20,00
25,00
30,00
0,127
0,250
0,286
0,303
0,334
0,384
0,385
0,385
Найдите Км и Vmax этой реакции путём построения классической зависимости по Михаэлису - Ментен и по методу Лайнуивера - Берка.
5. Измеряли кинетику ферментативной реакции в зависимости от концентрации субстрата в присутствии или в отсутствие ингибитора. Были получены следующие данные:
[S], M |
Скорость реакции, мкмоль/мин |
|
без ингибитора |
с ингибитором |
|
0,3 * 10-5 |
10,4 |
4,1 |
0,5 * 10-5 |
14,5 |
6,4 |
1,0 * 10-5 |
22,5 |
11,3 |
3,0 * 10-5 |
33,8 |
22,6 |
9,0 * 10-5 |
40,5 |
33,8 |
а) Чему равны Vmax и Kм в отсутствие ингибитора и в присутствии его? б) Каков тип ингибирования?
6. Декарбоксилирование глиоксилата митохондриями ингибируется малонатом. При кинетическом исследовании были получены следующие результаты:
Концентрация глиоксилата, мМ |
Скорость выделения СО2 (условные единицы) |
||
в отсутствие малоната |
при концентрации малоната 1,26 мМ |
при концентрации малоната 1,96 мМ |
|
1,00 |
2,50 |
2,17 |
1,82 |
0,75 |
2,44 |
1,82 |
1,39 |
0,60 |
2,08 |
1,41 |
1,28 |
0,50 |
1,89 |
1,30 |
1,00 |
0,40 |
1,67 |
1,09 |
- |
0,33 |
1,39 |
- |
- |
0,25 |
1,02 |
- |
0,56 |
Можно ли утверждать, что малонат является конкурентным ингибитором?
7. Фермент Ацетил-КоА-карбоксилаза катализирует реакцию образования Малонил-КоА из Ацетил-КоА:
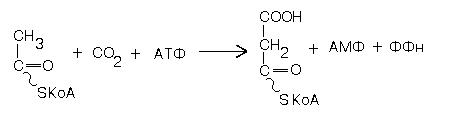
При исследовании влияния лимонной кислоты на этот фермент получены следующие данные:
[Ацетил-КоА] |
Скорость реакции при различных концентрациях цитрата (нм Ацетил-КоА/мин) |
||
|
1,25 мМ цитрата |
2,5 мМ цитрата |
10 мМ цитрата |
0.02 мМ 0.025 мМ 0.033 мМ 0.05 мМ 0.1 мМ |
0,425 0,485 0,606 0,74 1,0 |
0,74 0,847 1,05 1,31 1,69 |
1,41 1,69 1,88 2,44 3,44 |
Что можно сказать о механизме регуляции данного фермента?
В какой роли выступает в данной реакции цитрат?
8. Обнаружено, что активность фермента А значительно повышается в присутствии АТФ и протеинкиназы. При этом количество АТФ, пропорциональное количеству фермента А в инкубационной смеси переходит в АДФ. О каком типе регуляции можно говорить в данном случае ?
9. При исследовании зависимости скорости ферментативной реакции от рН среды обнаружили следующую зависимость (количество фермента 0,5 мг)
рН |
4.5 |
5.0 |
5.5 |
6.0 |
6.5 |
7.0 |
7.5 |
8.0 |
V мкМ/мин |
0.2 |
0.3 |
0.25
|
0.34 |
0.55 |
1.2 |
1.9 |
0.8 |
Какая величина рН соответствует оптимуму?
Рассчитать удельную активность фермента при оптимальном значении рН?
10. Сколько юнит содержится 1 мл исследуемого раствора фермента, если за 10 минут инкубации в оптимальных условиях 5 мл раствора фермента катализируют превращение 20 мкМоль субстрата. Рассчитайте активность
1 мг белка в препарате фермента (концентрация фермента в пробе составляет 3 мг/мл).
11. При некоторых заболеваниях печени наблюдается врожденная недостаточность фермента УДФ-глюкуронил-трансферазы, который катализирует реакцию обезвреживания токсических соединений. При недостатке этого фермента в крови повышается уровень продукта распада гемоглобина - билирубина, который также обезвреживается с участием этого фермента. Эмпирически было найдено, что прием производных барбитуровой кислоты приводит к нормализации уровня билирубина. Как можно объяснить это явление с точки зрения механизмов регуляции ферментативных процессов в организме? Перечислите возможные механизмы влияния низкомолекулярных соединений на скорость ферментативных процессов.
12. Изменяется ли активность фермента после удаления аллостерического ингибитора
из среды (например,путем диализа), если при этом не происходит нарушений третичной структуры фермента?
13. По приведенным данным, используя метод Лайнуивера-Берка, определить тип ингибирования фермента.
[S]o мМ/л |
Vo (мкМ/мин) без ингибитора |
Vo (мкМ/мин) с ингибитором |
0,6 |
5,0 |
2,0 |
1,0 |
7,2 |
3,0 |
2,0 |
11,4 |
4,4 |
6,0 |
16,5 |
6,9 |
18,0 |
20,2 |
8,0 |
14**. Рассчитать молекулярную активность фермента, если 1 микрограмм фермента за 1 минуту превращает 2 мкмоля субстрата? Молекулярную массу исследуемого фермента принять равной 25 кДа.
15**. Рассчитайте, сколько юнит содержит 1 мг фермента, если при инкубации 2 мл смеси фермента и субстрата, с концентрацией фермента 0.025 мг/мл произошло снижение концентрации субстрата в оптимальных условиях с 5 мМоль/л до 3 мМоль/л за 20 минут.
16. В таблице приведены скорости ферментативной реакции при разных концентрациях субстрата в отсутствие ингибитора (Vo), а также в присутствии ингибитора (Vi):
[S]о мМ/л |
1 |
2 |
3 |
5 |
10 |
20 |
30 |
Vo |
30 |
55 |
65 |
80 |
110 |
110 |
110 |
Vi |
15 |
28 |
38 |
55 |
80 |
110 |
110 |
Какой тип ингибирования наблюдается в данном случае? Чему равна величина Км в присутствии и в отсутствие ингибитора?
17. В таблице приведены скорости ферментативной реакции при разных концентрациях субстрата в отсутствие ингибитора (Vo), а также в присутствии ингибитора (Vi):
[S]о мМ/л |
1 |
2 |
3 |
5 |
10 |
20 |
30 |
Vo |
30 |
55 |
65 |
80 |
110 |
110 |
110 |
Vi |
15 |
27.5 |
32.5 |
40 |
55 |
55 |
55 |
Какой тип ингибирования наблюдается в данном случае? Чему равна величина Км в присутствии и в отсутствие ингибитора?
18. При исследовании фермента фосфатазы было обнаружено, что он гидролизует р-нитрофенилфосфат Na (конц. 10мМ) со скоростью 2,3 мкМ/час.л. Этот же препарат фермента гидролизовал бета-глицерофосфат натрия, взятый в той же концентрации со скоростью 5,1 мкМ/ч.л. Как можно объяснить полученные результаты? Какие свойства фермента и субстрата можно охарактеризовать по имеющимся данным? Как нужно продолжить исследование, чтобы рассчитать кинетические параметры фермента?
19. При исследовании фермента обнаружено, что добавление в инкубационную среду ионов [Са2+]повышает скорость ферментативной реакции в диапазоне [Са2+]от 0,5 до 5 мМ/л. При [Са2+] < 0,2 мМ/л - ферментативная реакция не идет; при [Ca2+] > 5,5 мМ/л - скорость реакции резко падает. В какой роли выступают ионы Са2+ в отношении исследованного фермента? С помощью каких манипуляций можно увеличивать или уменьшать концентрацию ионов Са2+ in vitro в среде, содержащей фермент?
20. При исследовании зависимости V от [S] получены следующие значения скорости ферментативной реакции при разных концентрациях субстрата в отсутствие ингибитора (Vo) и в присутствии ингибитора (Vi):
[S]о мМ/л |
2,0 |
3,0 |
5,0 |
10,0 |
Vo мкМ/мин |
6,7 |
10,0 |
11,8 |
15,4 |
Vi мкМ/мин |
4,25 |
5,7 |
7,1 |
9,5 |
Какой тип ингибирования наблюдается в данном случае? Какие значения имеют кинетические характеристики ?
Примеры задач к занятию № 1 по теме «Ферменты»
1. При выполнении самостоятельной работы по теме «Строение и свойства аминокислот и белков» Вы должны были изучить реакцию образования γ-карбоксиглутамата, которая требует участия витамина К в качестве кофермента. К какому классу относится фермент, катализирующий превращение Glu -> Gla ?
2. Превращение пирувата в лактат (молочную кислоту) – это обратимый процесс, протекающий в любых клетках и катализируемый тканеспецифичными изоферментами лактатдегидрогеназы (ЛДГ). Изофермент M4, характерный для скелетных мышц, обладает более высоким сродством по отношению к пирувату, а в гепатоцитах преобладают варианты ЛДГ типов H4 и H3M, обладающие более высоким сродством к лактату.
В каком направлении преимущественно идёт реакция в скелетных мышцах и в печени? Какие из названных клеток образуют и выделяют в кровь лактат, а какие, наоборот, «извлекают» лактат из крови и превращают в пируват? Для какого из названных ферментов КM, определённая для лактата выше?
3. Первая реакция обмена глюкозы в организме – это превращение глюкозы в глюкозо-6-фосфат путем фосфорилирования с участием АТФ. Известно, что в мышцах и в большинстве других тканей эта реакция катализируется ферментом гексокиназой, которая обладает KM = 0,1 ммоль/л, а в печени, кроме этого фермента имеется ещё и глюкокиназа, для которой KM = 10 ммоль/л.
К какому классу относятся эти ферменты? Какой из ферментов, гексокиназа или глюкокиназа обладает более высоким сродством к глюкозе?
Постройте графики зависимости V от [S] для двух ферментов в одной системе координат исходя из предположения, что Vmax для глюкокиназы в гепатоцитах в 2 раза выше, чем Vmax гексокиназы.
4. Может ли рассчитанная величина Vmax определенная при исследовании разных препаратов одного и того же фермента быть разной по абсолютной величине? Дайте объяснение.
5. Сладкий вкус зерен в свежесобранных початках кукурузы обусловлен высоким содержанием в них сахара. Кукуруза, которую продают спустя несколько дней после сбора, имеет более низкую сахаристость, так как около 50% свободного сахара в зернах превращаются в крахмал в течение одного дня хранения. Чтобы сохранить сладкий вкус свежесобранной кукурузы, очищенные початки помещают на несколько минут в кипящую воду ("бланшируют"), а затем охлаждают в холодной воде. Кукуруза, обработанная таким образом и хранящаяся в замороженном или в консервированном виде, сохраняет свой сладкий вкус. В чем биологическая основа этой обработки?
6. Активный центр фермента обычно представляет собой «карман» на поверхности фермента, выстланный боковыми цепями аминокислот, необходимыми для связывания субстрата и катализа его химического превращения. Молекула карбоксипептидазы, последовательно отщепляющей С-концевые аминокислотные остатки от субстратов (пептидов), состоит из одной полипептидной цепи (307 аминокислотных остатков). Три главные каталитические группы в активном центре - это аргинин 145, тирозин 248 и глутаминовая кислота 270 (номер указывает положение аминокислоты в цепи).
а) Если бы карбоксипептидаза представляла собой «идеальную» aльфа-спираль, то на каком расстоянии (в нм) друг от друга находились бы аргинин 145 и тирозин 248, аргинин 145 и глутаминовая кислота 270?
б) Объясните, каким образом эти три аминокислоты, расположенные так далеко друг от друга в полипептидной цепи, могут катализировать реакцию, участники которой занимают пространство размером в несколько десятых долей нанометра.
в) Если в процессе гидролиза участвуют только эти три каталитические группы, для чего ферменту необходимо иметь так много аминокислотных остатков?
7. Мышечный фермент лактатдегидрогеназа катализирует реакцию:
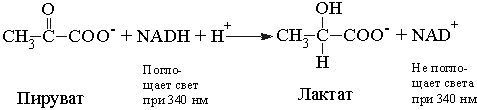
В отличие от NAD+ раствор NADH поглощает свет при 340 нм. Это свойство используется для определения концентрации NADH в растворе путем измерения поглощения раствора при 340 нм с помощью спектрофотометра. Объясните, как эти свойства NADH можно использовать для количественного определения активности лактатдегидрогеназы.
8. При нагревании раствора фермента со временем он постепенно утрачивает каталитическую активность. Это обусловлено разворачиванием молекулы нативного фермента, которая по мере возрастания ее тепловой энергии принимает конформацию беспорядочного клубка.
При инкубации раствора гексокиназы в течение 12 минут при 45оС фермент теряет 50% активности, но если гексокиназа инкубируется при 45оС в присутствии очень большой концентрации одного из двух её субстратов - глюкозы, то она утрачивает только 3% активности. Объясните, почему тепловая денатурация гексокиназы замедляется в присутствии одного из её субстратов.
9. Метанол, который является одним из продуктов целлюлозно-бумажного производства и входит в состав некоторых технических жидкостей, обладает очень высокой токсичностью: прием внутрь всего лишь 30 мл чистого метанола может привести к смерти. Высокая токсичность метанола обусловлена действием не столько самого метанола, сколько продукта его метаболизма – формальдегида. Метанол быстро окисляется до формальдегида под действием фермента печени алкогольдегидрогеназы – фермента обладающего относительной субстратной специфичностью:
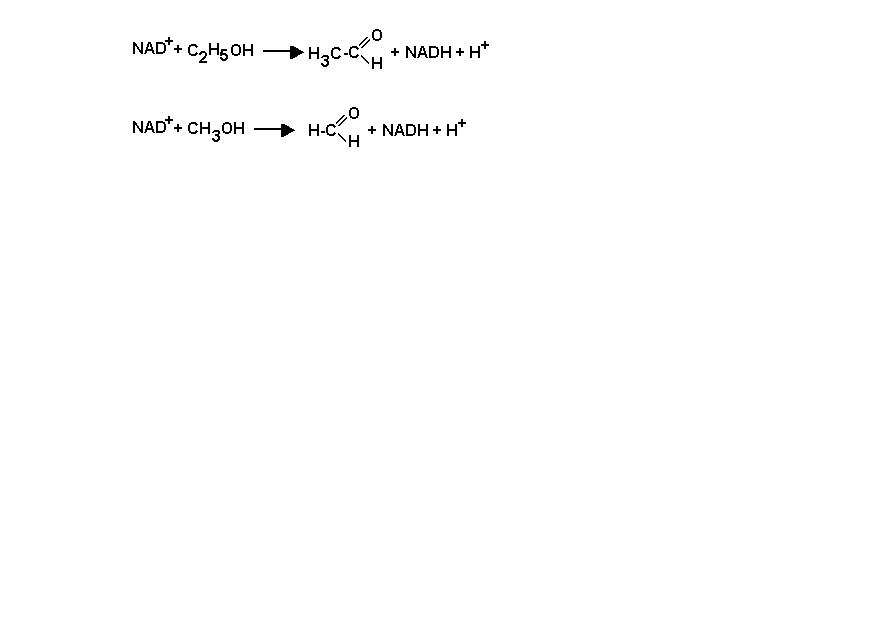
Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этанол либо внутрь, либо внутривенно в количествах, которые у здорового человека вызывают интоксикацию. Объясните, почему такое лечение оказывается эффективным.
10. Уравнение Михаэлиса-Ментен описывает связь между скоростью ферментативной реакции и концентрацией субстрата:
![]()
а) При какой концентрации субстрата фермент, для которого максимальная скорость превращения субстрата составляет 30 мкмолей/мин*мг, а величина Км равна 0,005М, будет работать со скоростью, равной максимальной?
б) Определите, какую долю Vmax будет составлять скорость реакции при концентрациях субстрата, равных + Км , 2Км и 10Км.
11. Фермент сахараза может катализировать следующие реакции:
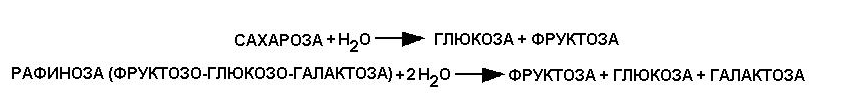
Если субстратом является сахароза, то КМ = 0,05 мМ, если рафиноза, то КМ = 2,0 мМ. В каком случае при одинаковой концентрации субстратов скорость реакции будет больше?
12. Рассмотрите схему ферментативной реакции. Сравните структурные формулы субстрата и продукта:
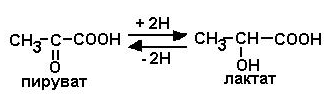
а) Назовите класс фермента, катализирующего данную реакцию.
б) Рассчитайте удельную активность фермента, если за 30 с 1 мг фермента при оптимальных условиях инкубации (рН 7,2; 37 0С) превращает 50 мкмоль пирувата.
