
- •260200 – Производство продуктов питания из растительного сырья;
- •260300 – Технология сырья и продуктов животного происхождения;
- •260500 – Технология продовольственных продуктов специального
- •Предмет коллоидной химии
- •Глава I. Дисперсные системы:
- •1.1 Основные свойства дисперсных систем
- •1.2 Классификация дисперсных систем
- •Классификация по степени дисперсности
- •Классификация по агрегатному состоянию
- •Классификация по структурно-механическим свойствам
- •Раздел II. Поверхностные явления. Адсорбция
- •2.1 Классификация поверхностных явлений
- •Классификация поверхностных явлений
- •2.2 Поверхностное явление – адсорбция
- •2.2.1 Основные понятия и определения
- •2.2.2 Адсорбция на границе жидкость-газ
- •2.2.3. Адсорбция на твердом адсорбенте
- •2.3 Адгезия и смачивание
- •Раздел III. Электрические свойства дисперсных
- •3.1 Возникновение электрического заряда
- •3.2 Современные представления о строении
- •3.3 Строение мицеллы гидрофобного золя
- •3.4. Факторы, влияющие на электрокинетический потенциал
- •3.4.1 Влияние температуры
- •3.4.2 Влияние электролитов
- •3.4.3 Влияние рН среды
- •3.4.4 Влияние природы дисперсионной среды
- •3.5 Электрокинетические явления
- •3.5.1 Электрофорез
- •3.5.2 Потенциал седиментации
- •3.5.3 Электроосмос
- •3.5.4 Потенциал течения
- •Раздел IV. Устойчивость и нарушение устойчивости лиофобных золей
- •4.1. Седиментационная устойчивость
- •4.2 Агрегативная устойчивость и коагуляция
- •4.2.1 Теория устойчивости гидрофобных золей длфо
- •4.2.2 Факторы, определяющие агрегативную устойчивость
- •4.3. Коагуляция гидрофобных дисперсных систем
- •4.3.1 Коагуляция золей электролитами
- •Явление неправильных рядов
- •4.3.2 Кинетика коагуляции
- •Теория быстрой коагуляции Смолуховского
- •Константа скорости медленной коагуляции
- •Раздел V. Оптические свойства дисперсных систем
- •5.1. Рассеяние света
- •Теория светорассеяния Рэлея
- •5.2. Поглощение света и окраска золей
- •5.3. Оптические методы исследования коллоидных растворов
- •Раздел VI. Молекулярно-кинетические свойства
- •6.1. Броуновское движение
- •6.2. Диффузия
- •6.3. Осмос
- •Раздел VII. Виды дисперсных систем
- •7.1. Растворы высокомолекулярных соединений (вмс)
- •7.1.1. Классификация вмс
- •7.1.2. Особенности строения полимеров
- •7.1.3. Набухание вмс
- •Термодинамика набухания
- •Кинетика набухания
- •Факторы, влияющие на набухание
- •7.1.4. Свойства растворов вмс
- •7.2. Коллоидные пав. Мицеллообразование в растворах пав
- •Применение коллоидных пав
- •7.3. Эмульсии
- •7.3.1. Классификация эмульсий
- •7.3.2. Методы получения эмульсий
- •7.3.3. Устойчивость эмульсий
- •Типы эмульгаторов
- •7.3.4. Применение эмульсий
- •7.4. Пены
- •7.4.1. Основные характеристики и классификация пен
- •7.4.2. Устойчивость пен
- •7.4.3. Методы разрушения пен
- •7.4.4. Практическое применение пен
- •7.5. Золи и суспензии
- •7.6. Порошки
- •7.6.1. Основные свойства и устойчивость порошков
- •7.6.2. Практическое применение порошков
- •Раздел VIII. Структурообразование в дисперсных системах
- •8.1. Типы структур в дисперсных системах
- •8.2. Особенности структурообразования в растворах вмс. Студни и студнеобразование
7.2. Коллоидные пав. Мицеллообразование в растворах пав
Коллоидными ПАВ называют поверхностно-активные вещества, способные в растворах образовывать мицеллы, т.е. ассоциаты, состоящие из большого количества молекул ПАВ (от 20 до 100).
Способностью к мицеллообразованию обладают ПАВ с длинной углеводородной цепью, включающей 10 – 20 атомов углерода. Для коллоидных ПАВ характерно оптимальное соотношение между гидрофобной и гидрофильной частями, т.е ГЛБ 7.
При образовании мицелл в полярном растворителе, например, воде углеводородные цепи молекул ПАВ объединяются в компактное углеводородное ядро, а гидратированные полярные группы, обращенные в сторону водной фазы, образуют гидрофильную оболочку (рис. 54, а).
Мицеллы образуются и в неводных растворах ПАВ. Ориентация молекул ПАВ в неполярных растворителях противоположна, т.е. углеводородный радикал обращен к неполярной жидкости (рис. 54, б).
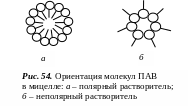
За счет высокой степени ассоциации молекул ПАВ в мицелле между нею и дисперсионной средой существует граница раздела. В связи с этим мицеллярные растворы ПАВ обнаруживают свойства, присущие коллоидно-дисперсным системам: светорассеяние, повышенную вязкость и т.п. Поэтому растворы коллоидных ПАВ относят к дисперсным системам.
К онцентрация
ПАВ, при которой в растворе возникают
мицеллы, называется критической
концентрацией мицеллобразования (ККМ).
Изотермы поверхностного натяжения
растворов коллоидных ПАВ вместо обычного
плавного хода, описываемого уравнением
Шишковского, обнаруживают при
с =
ККМ излом (рис. 55). При дальнейшем
увеличении концентрации выше ККМ
значения поверхностного натяжения
остаются практически неизменными.
онцентрация
ПАВ, при которой в растворе возникают
мицеллы, называется критической
концентрацией мицеллобразования (ККМ).
Изотермы поверхностного натяжения
растворов коллоидных ПАВ вместо обычного
плавного хода, описываемого уравнением
Шишковского, обнаруживают при
с =
ККМ излом (рис. 55). При дальнейшем
увеличении концентрации выше ККМ
значения поверхностного натяжения
остаются практически неизменными.
Коллоидные растворы ПАВ несмотря на гетерогенность и очень большую межфазную поверхность (а = 10-9 – 10-7 м, Sуд = 107 – 109 м) являются устойчивыми системами. Это объясняется тем, что молекулы ПАВ в мицеллах ориентируются полярными группами к полярной среде (или неполярными группами к неполярной среде), что обусловливает низкое межфазовое поверхностное натяжение. Следовательно, поверхностная энергия таких дисперсных систем очень мала, т.е. это типичные лиофильные золи.
Одним из характерных свойств растворов коллоидных ПАВ, связанных с их мицеллярным строением является солюбилизация – растворение в растворах коллоидных ПАВ веществ, которые в данной жидкости обычно нерастворимы.
М еханизм
солюбилизации заключается в проникновении
неполярных молекул веществ, добавленных
в раствор ПАВ в неполярное ядро мицеллы
(или наоборот: полярных – в полярное
ядро) (рис. 56). При этом углеводородные
цепи раздвигаются и объем мицеллы
увеличивается. В результате солюбилизации
в водных растворах ПАВ растворяются
углеводородные жидкости: бензин, керосин,
а также жиры, которые нерастворимы в
воде.
еханизм
солюбилизации заключается в проникновении
неполярных молекул веществ, добавленных
в раствор ПАВ в неполярное ядро мицеллы
(или наоборот: полярных – в полярное
ядро) (рис. 56). При этом углеводородные
цепи раздвигаются и объем мицеллы
увеличивается. В результате солюбилизации
в водных растворах ПАВ растворяются
углеводородные жидкости: бензин, керосин,
а также жиры, которые нерастворимы в
воде.
Другим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи (рис. 57). Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности.

