
- •260200 – Производство продуктов питания из растительного сырья;
- •260300 – Технология сырья и продуктов животного происхождения;
- •260500 – Технология продовольственных продуктов специального
- •Предмет коллоидной химии
- •Глава I. Дисперсные системы:
- •1.1 Основные свойства дисперсных систем
- •1.2 Классификация дисперсных систем
- •Классификация по степени дисперсности
- •Классификация по агрегатному состоянию
- •Классификация по структурно-механическим свойствам
- •Раздел II. Поверхностные явления. Адсорбция
- •2.1 Классификация поверхностных явлений
- •Классификация поверхностных явлений
- •2.2 Поверхностное явление – адсорбция
- •2.2.1 Основные понятия и определения
- •2.2.2 Адсорбция на границе жидкость-газ
- •2.2.3. Адсорбция на твердом адсорбенте
- •2.3 Адгезия и смачивание
- •Раздел III. Электрические свойства дисперсных
- •3.1 Возникновение электрического заряда
- •3.2 Современные представления о строении
- •3.3 Строение мицеллы гидрофобного золя
- •3.4. Факторы, влияющие на электрокинетический потенциал
- •3.4.1 Влияние температуры
- •3.4.2 Влияние электролитов
- •3.4.3 Влияние рН среды
- •3.4.4 Влияние природы дисперсионной среды
- •3.5 Электрокинетические явления
- •3.5.1 Электрофорез
- •3.5.2 Потенциал седиментации
- •3.5.3 Электроосмос
- •3.5.4 Потенциал течения
- •Раздел IV. Устойчивость и нарушение устойчивости лиофобных золей
- •4.1. Седиментационная устойчивость
- •4.2 Агрегативная устойчивость и коагуляция
- •4.2.1 Теория устойчивости гидрофобных золей длфо
- •4.2.2 Факторы, определяющие агрегативную устойчивость
- •4.3. Коагуляция гидрофобных дисперсных систем
- •4.3.1 Коагуляция золей электролитами
- •Явление неправильных рядов
- •4.3.2 Кинетика коагуляции
- •Теория быстрой коагуляции Смолуховского
- •Константа скорости медленной коагуляции
- •Раздел V. Оптические свойства дисперсных систем
- •5.1. Рассеяние света
- •Теория светорассеяния Рэлея
- •5.2. Поглощение света и окраска золей
- •5.3. Оптические методы исследования коллоидных растворов
- •Раздел VI. Молекулярно-кинетические свойства
- •6.1. Броуновское движение
- •6.2. Диффузия
- •6.3. Осмос
- •Раздел VII. Виды дисперсных систем
- •7.1. Растворы высокомолекулярных соединений (вмс)
- •7.1.1. Классификация вмс
- •7.1.2. Особенности строения полимеров
- •7.1.3. Набухание вмс
- •Термодинамика набухания
- •Кинетика набухания
- •Факторы, влияющие на набухание
- •7.1.4. Свойства растворов вмс
- •7.2. Коллоидные пав. Мицеллообразование в растворах пав
- •Применение коллоидных пав
- •7.3. Эмульсии
- •7.3.1. Классификация эмульсий
- •7.3.2. Методы получения эмульсий
- •7.3.3. Устойчивость эмульсий
- •Типы эмульгаторов
- •7.3.4. Применение эмульсий
- •7.4. Пены
- •7.4.1. Основные характеристики и классификация пен
- •7.4.2. Устойчивость пен
- •7.4.3. Методы разрушения пен
- •7.4.4. Практическое применение пен
- •7.5. Золи и суспензии
- •7.6. Порошки
- •7.6.1. Основные свойства и устойчивость порошков
- •7.6.2. Практическое применение порошков
- •Раздел VIII. Структурообразование в дисперсных системах
- •8.1. Типы структур в дисперсных системах
- •8.2. Особенности структурообразования в растворах вмс. Студни и студнеобразование
3.4.2 Влияние электролитов
По характеру воздействия на потенциал ядра (0-потенциал) электролиты подразделяют на индифферентные и неиндифферентные.
Индифферентные (безразличные) электролиты не имеют ионов, способных достраивать кристаллическую решетку коллоидной частицы. Поэтому такие электролиты не могут сколько-нибудь существенно изменить потенциал ядра коллоидной частицы (0-потенциал).
Электролиты, добавление которых к золю, вызывает изменение потенциала ядра, называются неиндифферентными. Один из ионов неиндифферентных электролитов (неиндифферентный ион) способен достраивать кристаллическую решетку коллоидной частицы. Это ион либо входит в состав кристаллической решетки агрегата, либо образует малорастворимое соединение с потенциалопределяющим ионом.
Например, для положительного золя AgI
![]()
индифферентными электролитами являются KNO3, NaNO2, неиндифферентными – NaCl, KI, AgNO3.
Влияние индифферентных электролитов.
При добавлении к золю индифферентных электролитов потенциал ядра 0 не изменяется, следовательно, общее число противоионов, необходимых для его компенсации, останется прежним, но изменится их распределение в ДЭС. С ростом концентрации электролита, количество противоионов в адсорбционном слое возрастает при неизменной толщине слоя, в диффузном, напротив, уменьшается. В результате диффузный слой сжимается, -потенциал понижается (рис. 29).
При определенной концентрации электролита ДЭС сжимается до толщины адсорбционного слоя, диффузный слой исчезает, т.е. все необходимое для компенсации потенциала ядра количество противоионов сконцентрировано в адсорбционном слое. -потенциал становится равным нулю, что отвечает изоэлектрическому состоянию системы.
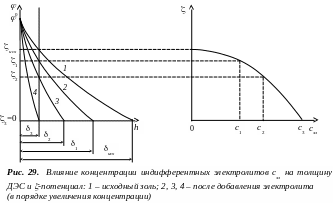
Если в золь вводится ион, адсорбционная способность которого значительно выше, чем у противоиона мицеллы (например, больше заряд), возможна перезарядка коллоидной частицы, т.е. -потенциал изменит свой знак при постоянном значении 0-потенциала.
Например, если к отрицательному золю AgI
![]()
добавить Fe(NO3)3, ионы железа Fe3+ будут конкурировать с ионами калия К+ за нахождение в адсорбционном слое. Адсорбционная способность Fe3+ значительно выше, чем у К+. В результате ионного обмена в адсорбционном слое (К+ на Fe3+) ионов Fe3+ может оказаться столько, что они не только полностью компенсируют заряд потенциалопределяющих ионов, но и окажутся в избытке, придавая -потенциалу положительный заряд. Потенциал ядра останется прежним, так как ион Fe3+ не способен достраивать кристаллическую решетку AgI и, следовательно, выступать в роли потенциалопределяющих ионов.
Влияние неиндифферентных электролитов.
При введении в золь неиндифферентных электролитов возможны два случая.
1 случай – в золь вводится электролит, содержащий потенциалопределяющий ион (неиндифферентный ион). Второй ион в электролите обязательно индифферентный. Поэтому одновременно будет возрастать концентрация и потенциалопределяющих ионов и противоионов. Это обуславливает появление двух противоположных тенденций: с одной стороны, увеличение концентрации потенциалопределяющих ионов приводит к росту потенциала ядра, а, следовательно, и -потенциала, с другой – возрастающая концентрация противоионов вызывает сжатие ДЭС и снижение -потенциала.
П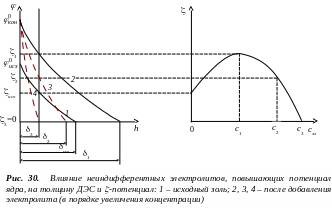 ри
малых концентрациях электролита
преобладает первая тенденция. Адсорбция
потенциалопределяющих ионов продолжается
до достижения предельной адсорбции и
-потенциал по
абсолютному значению возрастает. После
достижения предельной адсорбции
потенциал ядра остается неизменным, но
за счет влияния индифферентных
противоионов ДЭС сжимается,
-потенциал
уменьшается (рис. 30).
ри
малых концентрациях электролита
преобладает первая тенденция. Адсорбция
потенциалопределяющих ионов продолжается
до достижения предельной адсорбции и
-потенциал по
абсолютному значению возрастает. После
достижения предельной адсорбции
потенциал ядра остается неизменным, но
за счет влияния индифферентных
противоионов ДЭС сжимается,
-потенциал
уменьшается (рис. 30).
Например, для положительного золя AgI неиндифферентным электролитом первого типа является AgNO3, для отрицательного золя AgI – NaCl, KI (Сl- и I- – изоморфные ионы).
2 случай – в систему вводится электролит, содержащий ион, способный образовывать с потенциалопределяющим ионом малорастворимое соединение. В этом случае возможна перезарядка золя.
Например, в положительный золь AgI вводится KI
.
Ион I-, вводимый с KI, будет образовывать с потенциалопределяющими ионами Ag+ малорастворимое соединение AgI. В результате по мере увеличения концентрации KI количество потенциалопределяющих ионов будет уменьшаться, следовательно, будет уменьшаться и потенциал ядра, что приведет к сжатию ДЭС и снижению -потенциала. Этот процесс будет продолжаться до тех пор, пока все ионы Ag+ не свяжутся с ионами I-, 0- и -потенциалы при этом достигнут нулевого значения (рис. 31).
Сэл
0





1
![]()
2

1
3=0
Сэл
0



2
4

![]()
5
![]()
А
Рис. 31.
Влияние неиндифферентных электролитов,
нейтрализующих потенциал ядра, на
толщину ДЭС и -потенциал
После введения в систему избытка йодида калия потенциалопределяющим ионом станет ион I-, а противоионом – ион К+. Сами же частицы золя приобретут отрицательный заряд. Кроме того, нитрат серебра, содержащийся в дисперсионной среде, вступит в реакцию с введенным йодидом калия, в результате чего в системе образуется дополнительное количество отрицательно заряженной дисперсной фазы.
Формула мицеллы золя йодида серебра после перезарядки
.
При дальнейшем введении KI имеет место первый случай: адсорбция ионов йода будет продолжаться до достижения предельной адсорбции, вызывая повышение по абсолютному значению - и -потенциалов, после чего превалирующее влияние начнет оказывать индифферентный ион К+, рост концентрации которого в золе приведет к снижению -потенциала при неизменном потенциале ядра.
