
6. Растворимость твердых веществ в жидкостях.
Растворимость твердых веществ также определяется природой растворителя и растворенного вещества и также зависит от температуры. В отличие от растворимости газов, растворимость твердых тел сравнительно мало изменяется с давлением.
Различия в растворимости твердых тел можно иллюстрировать примерами. В 100 г воды при 25°С растворяется 257 г AgNO3 и лишь 3•10-20 HgI. Вода — хороший растворитель сахара, а спирт его практически не растворяет. Нафталин очень хорошо растворяется в спирте и не растворим в воде.
Следует заметить, что вследствие отсутствия общей теории растворов вопрос о зависимости растворимости от физико-химических свойств растворителя и растворенного вещества еще нельзя считать до конца решенным, и конкретные сведения о растворимости твердых тел целиком основаны на опытных данных.
В настоящее время установлен ряд правил о растворимости веществ, но они не обладают универсальностью, не свободны от различного рода исключений и потому носят в большинстве случаев качественный характер. Например, было замечено, что неполярные растворители, как правило, хорошо растворяют полярные вещества и плохо неполярные. Неполярные растворители, наоборот, хорошо растворяют, неполярные, вещества и плохо — полярные. В том случае, если один из компонентов раствора полярен, а второй неполярен, растворимость бывает незначительной.
Растворимость большинства твердых веществ с повышением температуры увеличивается. однако бывают и исключения. Так, растворимость СаCrО4 и Са(ОН)2 в воде с повышением температуры уменьшается.
Зависимость
растворимости от температуры обычно
изображают в виде кривых растворимости.
На
рис. 4
СЛ. 6
приведены кривые растворимости некоторых
солей в воде.
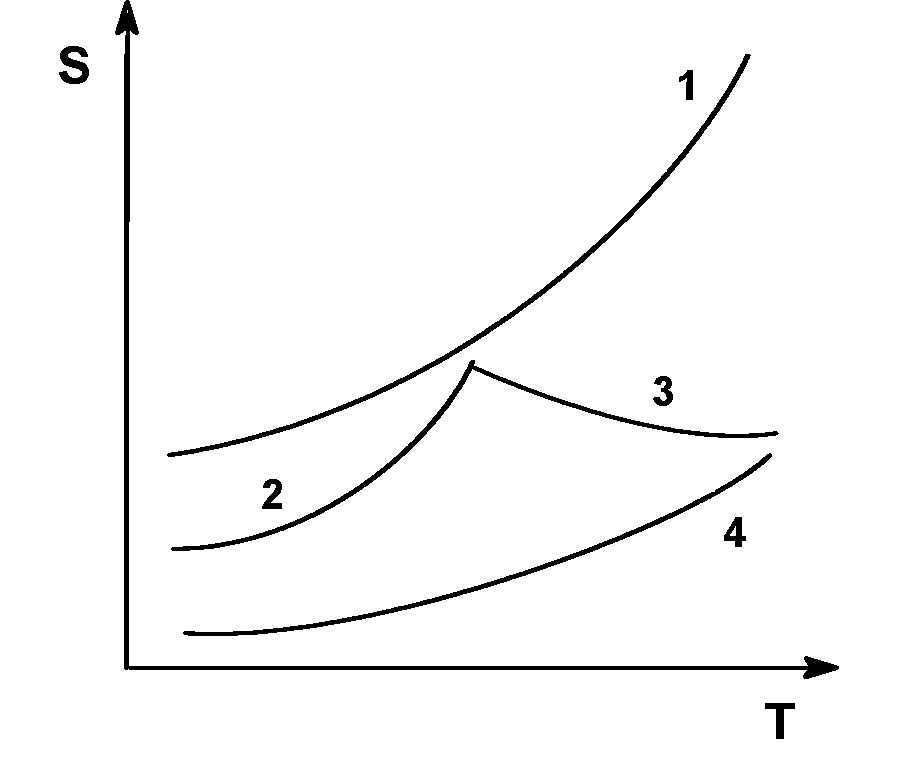
Рис. 4. Зависимость растворимости солей в воде от температуры. 1 – KNO3, 2 – Na2SO4*10H2O, 3 – Na2SO4, 4 – Ba(NO3)2.
Резкий излом на кривой растворимости сульфата натрия соответствует превращению Na2SO4•10Н2O в безводный Na2SO4. Растворение кристаллогидрата Na2SO4•10Н2O сопровождается поглощением тепла, а растворение безводной соли идет с выделением тепла.
Если
соль способна к образованию кристаллогидратов
(рис.
5
СЛ. 7),
то химический состав и область
существования каждого кристаллогидрата
можно сравнительно легко определить
по характерным кривым растворимости:
каждой точке перехода соответствует
излом на кривой растворимости.
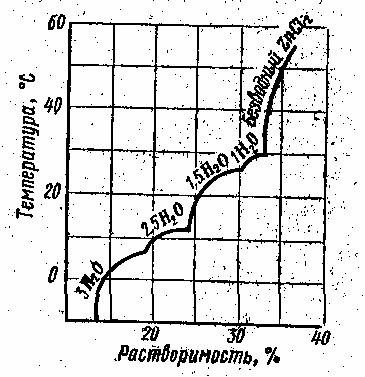
Рис. 5. Зависимость растворимости ZnCl2 в воде от температуры.
Изменением растворимости с температурой часто используются для очистки веществ путем перекристаллизации. При остывании горячего насыщенного раствора, какой либо соли, загрязненной примесями, значительная часть соли выделится осадок, а загрязняющие примеси остаются в растворе, так как последний даже на холоде не будет насыщенным раствором по отношению к примесям.
Самостоятельно
1. Растворы и их классификация
Растворами называют гомогенные системы, состоящие из двух или нескольких компонентов, состав которых может изменяться в довольно широких пределах. Свойства растворов(S, t0k, t03, вязкость) изменяются плавно.
Растворы сходны как с механическими смесями частиц, так и с химическими соединениями. От первых они отличаются тем, что любой взятый малый объем обладает теми же физическими свойствами и составом, что и весь объем раствора.
От химических соединений растворы отличаются тем, что их состав может изменяться в зависимость от количества взятых компонентов, и они не подчиняются законам кратных отношений. Если соединениям характерны наличия ионных и ковалентных связей, то для растворов характерны Ван-дер-Вальсовы связи.
В отличие от простого смешивания, при растворении происходит взаимодействие между частицами.
Вещество, которое входит в раствор без изменения агрегатного состояния или в преобладающем количестве называется растворителем. Соответственно другое – (другие вещества) растворенным веществом.
По агрегатному состоянию растворы делят на три группы:
Растворы газов в газах (воздух).
Жидкие растворы.
Твердые растворы (сплавы Ме).
Мы будем рассматривать только жидкие растворы.
Жидкие растворы подразделяются:
- Жидкости в жидкостях;
- Твердые тела в жидких;
- Газы в жидкостях.
