
- •Рекомендуемая литература
- •Содержание
- •1 Общие признаки массообменных процессов
- •2. Основные законы массообмена
- •3. Правило фаз гиббса применение к процессам массообмена
- •4 Сущность процесса ректификации
- •5 Изобарные температурные кривые
- •6 Энтальпийная диаграмма
- •7 Уравнение и кривая равновесия фаз бинарной смеси
- •8 Уравнение рабочей линии
- •8.2 Уравнение рабочей линии нижней части колонны
- •I — равновесная кривая; 2 — рабочая линия верхней части колонны 3 — рабочая линия нижней части колонны;
- •9 Определение числа теоретических тарелок графическим методом
- •9.1 Расчет числа тарелок в концентрационной части колонны
- •9. 2 Расчет числа тарелок в отгонной части колонны
- •10 Эффективность тарелки
- •11 Способы создания орошения в колонне
- •11.1 Отвод тепла в парциальном конденсаторе (рисунок 13.1,а)
- •11.2 Отвод тепла холодным испаряющимся орошением (рисунок 13.1,б)
- •11.3 Отвод тепла циркуляционным неиспаряющимся орошением (рисунок13.1 ,в)
- •12 Способы подвода тепла в нижнюю часть колонны
- •12.1 Подвод тепла в подогреватель с паровым пространством (рисунок14.1 , а)
- •12.2 Подвод тепла горячей струей (рисунок 14.1 ,б)
- •13 Закономерности процесса ректификации
5 Изобарные температурные кривые
. Построим изобары жидкости и пара ( при постоянном давлении).По оси абсцисс отложены концентрации жидкой и паровой фаз, по оси ординат - температура (рисунок 5.1) . Получаются две кривые, которые имеют две общие точки: точку Апри , отвечающую температуре кипения бензола и точкуВпри , соответствующая температуре кипения толуола. КриваяАА1А2В, определяющая зависимость между температурой системы и составом жидкой фазы, называется линией кипения. КриваяАВ1В2В, определяющая зависимость между температурой системы и составом паровой фазы, называется линией конденсации или насыщенных паров.
Пары жидкости могут быть насыщенными и перегретыми. Насыщенным называется пар, находящийся в равновесии с жидкостью. Чем выше температура, тем выше давление, при котором находится данная равновесная система. Для насыщенных паров существует однозначная зависимость между давлением паров и температурой. Ненасыщенными (перегретыми) парами называются пары, которые при данных температуре и давлении образуют однофазную систему. Жидкая фаза отсутствует.
Равновесные паровая и жидкая фазы имеют одинаковые температуру и поэтому на изобарных температурных кривых равновесные составы фаз будут определяться точками пересечения горизонталей, с линиями кипения и конденсации, эти горизонтальные отрезки называются конодами (например А1В1).
Область диаграммы, лежащая под кривой АА1А2В, отвечает некипящей жидкости (точкаF).Область диаграммы выше кривой конденсацииАВ1В2В,отвечает перегретым парам (точкаЕ).
Любая точка, лежащая между кривыми конденсации и кипения, например точка C, характеризует двухфазную систему (пар-жидкость)
Изобарные кривые можно построить экспериментально, а также расчетным методом.
Точка А1 на кривой кипения жидкости может быть найдена по закону Рауля. Парциальное давление компонентаpi идеального раствора равно произведению давления насыщенных паровPiпри данной температуре на мольную концентрацию компонента в жидкой фазеx’:
![]() ( 20 )
( 20 )
Давление насыщенных паров каждого компонента вычисляют по эмпирическим формулам. Например, по формуле Антуана
![]() ( 21 )
( 21 )
где А, В, С- константы, зависящие от свойств вещества и определяемые экспериментально;
t температура.
Известно, что жидкость начинает кипеть при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
Условие кипящей жидкости:
![]() ( 22 )
( 22 )
Откуда
![]() - получили уравнение нижней изобары.
( 23 )
- получили уравнение нижней изобары.
( 23 )
По закону Дальтона парциальное давление компонента газовой смеси равно произведению давления в системе на мольную долю компонента в газовой смеси
![]() ( 24 )
( 24 )
Объединенный закон Рауля-Дальтона
pi = PБ x’i=P y’i. ( 25 )
![]() ,
-уравнение верхней изобары ( 26
).
,
-уравнение верхней изобары ( 26
).
Следовательно, при данных температуры и давления системы равновесные составы паровой и жидкой фаз однозначно определяются давлениями насыщенных паров компонентов смеси.
6 Энтальпийная диаграмма
Для анализа и расчета процессов перегонки и ректификации используют энтальпийные диаграммы, дающие взаимосвязь составов жидкой и паровой фаз с их энтальпиями.
Энтальпия (или теплосодержание) жидкости равна количеству тепла, необходимого для нагрева жидкости от 0оС до заданной температуры.. Энтальпия пара равна количеству тепла, необходимого для нагрева вещества от 0оС до заданной температуры учетом тепла испарения и перегрева паров.
Величина энтальпии определяется
эмпирически по таблицам или по
приближенным формулам:![]()
 ( 27 )
( 27 )
![]() ( 28 )
( 28 )
Энтальпийные диаграммы используют при расчетах перегонки и ректификации, когда необходимо одновременно учитывать материальные и тепловые потоки.
На энтальпийной диаграмме приведены кривые энтальпии кипящей жидкости и энтальпии насыщенных паров в зависимости от концентрации.
Любая точка А на энтальпийной диаграмме, лежащая ниже кривой энтальпии жидкой фазы характеризует систему, состоящую только из жидкой фазы. Любая точка А4, лежащая выше кривой энтальпии паровой фазы, состоит из перегретых паров. Точки, расположенные между кривыми, напримерА2характеризует двухфазные системы.
Вертикальные отрезки между кривыми энтальпий паровой и жидкой фаз отвечают скрытой теплоте испарения (конденсации) смеси определенного состава.
Физический смысл величины скрытой теплоты испарения
Т.к. скрытая теплота испарения у разных веществ не совпадают, то энтальпийные кривые жидкости и пара не параллельны.
На энтальпийной диаграмме коноды изображаются наклонными прямыми. Поскольку на графиках изобар коноды располагаются горизонтально, т.е. положение их легко определить, а на энтальпийной диаграмме - наклонно под разными углами к оси абсцисс, то для удобства построений энтальпийную диаграмму обычно совмещают с графиком изобарных температурных кривых (рисунок 6.2) .
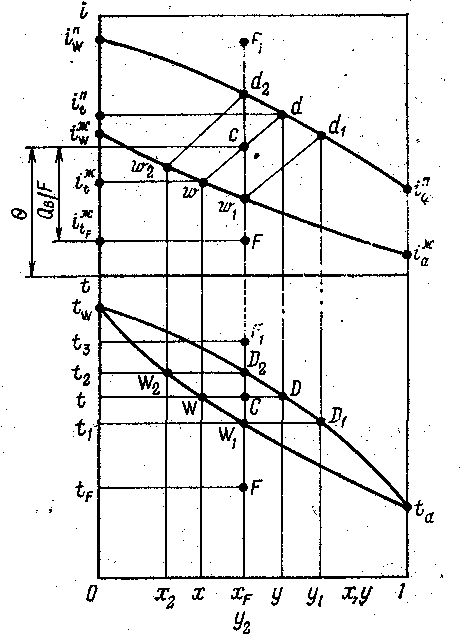
Рис.6.2. Представление процесса ОИ (ОК) бинарной смеси на изобарных температурных кривых и энтальпийной диаграмме
