
- •Алканы План.
- •Изомерия. Номенклатура.
- •Методы получения алканов.
- •Физические свойства алканов
- •Химические свойства алканов
- •1. Реакция гидрирования
- •2. Реакции электрофильного присоединения по двойной связи алкенов.
- •3. Взаимодействие с катионами металлов.
- •4. Гидроборирование алкенов.
- •5. Взаимодействие с с-электрофилами.
- •6. Реакции циклоприсоединения.
- •7. Реакции окисления алкенов.
- •8. Реакции полимеризации.
- •9. Гидроформилирование или оксосинтез
- •10. Радикальные реакции алкенов.
9. Гидроформилирование или оксосинтез
Этим способом в промышленности получают альдегиды, которые затем перерабатывают в спирты

В качестве катализатора этой реакции используют комплексное соединение - гидрокарбонил кобальта HCo(Co)4.
Катализ предполагает внедрение алкена в качестве лиганда в координационную сферу гидрокарбонила

с последующим взаимодействием образующего -комплекса с реагентами.
10. Радикальные реакции алкенов.
Выше уже упоминались радикальные реакции алкенов, такие как гидробромирование в присутствие пероксидов и радикальная полимеризация. Другими радикальными реакциями с участием алкенов являются:
а) теломеризация
Теломеризация – олигомеризация алкенов в присутствии веществ – передатчиков цепи (телогенов). В результате реакции образуется смесь олигомеров (теломеров), концевые группы которых представляют собой части телогена. Например, в реакции CCl4 с этиленом телогеном является CCl4.
CCl4 + nCH2=CH2 Cl(CH2CH2)nCCl3
Инициирование этих реакций может осуществляться радикальными инициаторами или -излучением. Это обусловливает свободнорадикальный характер реакций теломеризации:
Инициирование:
![]()
Развитие цепей:
CH2=CH2 + CCl3 CH2CH2CCl3
CH2CH2CCl3 + CH2=CH2 CH2CH2CH2CH2CCl3
Передача цепи:
CH2CH2CH2CH2CCl3 + CCl4 CCl3 + Cl-CH2CH2CH2CH2CCl3
б) Присоединение H2S и RSH в присутствии инициаторов радикальных реакций.

Можно видеть, что такое присоединение идет против правила Марковникова. Обоснование такого порядка присоединения такое же, как и в случае свободнорадикального гидробромирования алкенов. (см. выше)
Гидробромирование, тиогидратацию и другие подобные реакции алкенов следует проводить в условиях избытка аддента (т.е. вещества, присоединяющегося к алкену), чтобы подавить побочную реакцию полимеризации. Необходимость такого решения можно проиллюстрировать на примере реакций тиогидратации:
Инициирование:
I2 2I
I + H2S HI + HS
Развитие цепей (тиогидратация)

Развитие цепи (полимеризация)

В кратком виде конкуренция реакций тиогидратации и полимеризации может быть представлена схемой:

Из этой схемы очевидно вытекает необходимость применения избытка адденда для подавления побочной реакции полимеризации.
в) Галогенирование кратной связи.
Cl2 и Br2 могут присоединяться по двойной связи алкена по свободноразикальному механизму. Эти реакции протекают гораздо быстрее, чем реакции ионного галогенирования, но требуют химического или фотохимического инициирования.
Механизм этих реакций можно проиллюстрировать на примере бромирования:
Инициирование:
![]()
Развитие цепей:

Обрыв цепей:
Br + Br Br2

г) Аллильное замещение галогенами.
В условиях высоких температур (300-400оС) пропен и другие алкилзамещенные алкены хлорируются в паровой фазе в аллильное положение.
CH2=CH-CH3 + Cl2 CH2=CH-CH2Cl + HCl
Такое направление хлорирования связано со стабильностью аллильного радикала, образующегося при реализации радикально-цепного процесса:
Инициирование:
Cl2 + M 2Cl + M
Развитие цепей:

Обрыв цепей:

В то же время возможность присоединительного хлорирования путем реализации последовательности реакций

практически исключена, поскольку высоко-экзотермическое равновесие присоединения хлор-радикала к двойной связи в условиях высоких температур практичеки нацело смещено в левую строну.
Аллильное бромирование можно провести в лабораторных условиях, используя N-бромсукцинимид и инициатор свободнорадикальных реакций
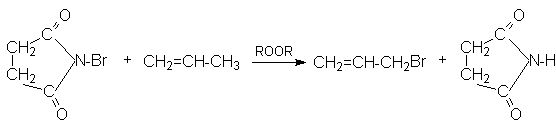
Лекция №14
АЛКАДИЕНЫ
План
Типы алкадиенов.
Номенклатура.
Методы синтеза1,3-алкадиенов.
Физические свойства 1,3-алкадиенов и их строение.
Химические свойства 1,3-алкадиенов и их применение.
Аллены.
Углеводороды с открытой цепью, содержащие две двойные связи, называются алкадиенами. В зависимости от взаимного расположения двойных связей различают следующие типы алкадиенов. Если двойные связи располагаются у одного атома углерода, то они называются алкадиенами – 1,2 или алленами, например:
СН2=С=СН2 пропадиен–1,2, аллен
а расположенные таким образом двойные связи называются кумулированными.
Если между двумя двойными связями находится одна одинарная связь, то такие алкадиены называются алкадиенами-1,3 или сопряженными диенами, например,
СН2=СН–СН=СН2 бутадиен-1,3.
Алкадиены с изолированными связями - такие алкадиены, у которых две двойные связи разделены двумя или более одинарными углерод-углеродными связями.
При наименовании алкадиенов используют номенклатуру IUPАC и тривиальные названия. Согласно номенклатуре IUPАC, родоначальная структура представляет собой самую длинную углеродную цепь, содержащую обе двойные связи. Нумерация этой цепи начинается с конца, которому соответствует меньшая сумма локантов. Название диена производится от корня родоначальной структуры путем добавления к нему суффикса “диен” с указанием положения двойных связей в цепи, например 3,7–диметилоктадиен–2,5.

За рядом первых алкадиенов устойчиво сохраняются тривиальные названия:
СН2=СН–СН=СН2 дивинил
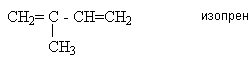
СН2=С=СН2 аллен
СН3СН=С=СН2 метилаллен
СН3–СН=СН–СН=СН2 пиперилен
Наиболее важными с научной и практических точек зрения являются алкадиены–1,3. Поэтому им в данном разделе уделяется наибольшее внимание.
Методы синтеза 1,3-алкадиенов
1. Дегидрирование алканов
а) дегидрирование бутан-бутеновой фракции

б) Дегидрирование изопентан-изопентеновой фракции

Рассмотренные методы имеют промышленное значение
2. Дегидратация гликолей

Дегидратация может быть осуществлена по методу Реппе

3. Дегидратация ненасыщенных спиртов

Исходный спирт может быть получен конденсацией карбонильных соединений с ацетиленом по методу Фаворского с последующим селективным гидрированием

4. Реакции сочетания винилгалогенидов

Винилгалогениды вступают также в реакцию сочетания под действием Cu2Cl2, Zn в присутствии NiCl2, н-бутиллития в присутствии MnCl2.
5. Димеризация ацетилена с последующим селективным гидрированием

6. Метод C.В. Лебедева

Этот метод был первым процессом получения бутадиена-1,3, освоенным в промышленном масштабе. В настоящее время он вытесняется более прогрессивным методом дегидрирования бутан-бутеновой фракции.
7. Расщепление 4,4-диметил-1,3диоксана, который получают конденсацией изобутена и формальдегида:

+ H2O + CH2O
Метод имеет ограниченное промышленное применение.
Физические свойства и строение алкадиенов–1,3
Алкадиены–1,3 являются бесцветными веществами. Первые члены гомологического ряда - газы или низкокипящие жидкости. Для алкадиенов –1,3 характерна повышенная молекулярная рефракция. В расчете на одну кратную связь она оказывается R(c=c) = 6,33, т.е. больше, чем у тройной связи. Это характерно для систем сопряженных связей.
Теплота гидрирования алкадиенов –1,3 на 13-16 кДж меньше, чем теплота гидрирования отдельных двойных связей. Это свидетельствует о большей стабильности сопряженных систем на величину энергии сопряжения.
Структурные исследования молекулы бутадиена–1,3 методом электронографии показывает, что все ее атомы лежат в одной плоскости. Наиболее энергетически выгодным и поэтому наиболее вероятным является расположение двойных связей в транс-конформации по отношению к одинарной связи. Длина связей С–С (0,146 нм) отличается от длины связи С=С в этилене (0,133 нм) и С–С в этане (0,154 нм). Эти данные являются дополнительным аргументом в пользу сопряжения двух -связей в алкадиенах–1,3.
Важные выводы о строении сопряженной системы дают результаты квантово-химических расчетов.
В сопряженную систему бутадиена каждый углеродный атом отдает один -электрон

Молекулярные орбитали (МО) сопряженной системы получают линейной комбинацией атомных орбиталей (АО) 1, 2, 3, и 4:
j = Cj1 1 + Cj2 2 + Cj3 3 Cj4 4
В результате решения волнового уравнения получают четыре МО (J=1,2,3,4), каждый из которых соответствует свое значение Еj и выражено для j. Энергетические уровни Еj представлены ниже. Для сравнения здесь же даны энергетические уровни для МО этилена
бутадиен-1,3 |
этилен |

Можно видеть, что четыре -электрона молекулы бутадиена размещаются на двух заполненных МО, а две остальные остаются незаполненными.
Первая МО (1) полностью делокализована и охватывает все четыре углеродных атома

Вторая МО (2) имеет узловую плоскость между вторым и третьим углеродным атомом. Она участвует в образовании связей между С1 и С2, С3 и С4. 2 является высшей заполненной МО (ВЗМО).

Третья МО (3) является низшей свободной МО (НСМО). Она имеет два узловые плоскости

Четвертая МО (4) имеет три узловые плоскости

ВЗМО и НСМО называются фронтальными орбиталями: они определяют реакционную способность сопряженной системы. Энергия ВЗМО по абсолютной величине соответствует ионизации орбиталей и определяет электронодонорные свойства и, соответственно, из способность к взаимодействию с электрофильными реагентами.
Более высокий энергетический уровень этой орбитали по сравнению с энергией связывающей -орбитали этилена обусловливает более высокую реакционную способность бутадиена в реакциях электрофильного присоединения.
Энергия НСМО определяет сродство к электрону, т.е. электроноакцептоные свойства, их способность к взаимодействию с нуклеофильными реагентами. Более низкий энергетический уровень орбитали по сравнению с энергией разрыхляющей -орбитали этилена обусловливает более высокую реакционную способность бутадиена в нуклеофильных реакциях.
В молекуле бутадиена наибольшие электронные плотности во фронтальных орбиталях находятся на концевых атомах углерода. Это означает, что атака как электрофильных, так и нуклеофильных реагентов начинается с концевых (С1 и С4) атомов углерода.
Порядок -связей свидетельствует, что для бутадиена характерны значительно выравненные (делокализованные) связи. Это подтверждается их длиной.
Энергия возбуждения -связей в сопряженных диенах Е=ЕВЗСМО – ЕНСМО. Сравнение с этиленом показывает, что для сопряженных систем Е меньше, чем для несопряженных, поэтому УФ-поглощения наблюдается при больших длинах волн – СН2= СН2 – 180-200 нм; СН2=СН–СН= СН2 – 217-220 нм.
Химические свойства алкадиенов–1,3
Характерными реакциями всех алкадиенов являются реакции присоединения. Наиболее важными среди них являются:
1. Реакции гидрирования.
Эти реакции имеют ступенчатый характер. Варьируя соотношение реагентов, может получать либо алкен, либо алкан в соответствии со схемой
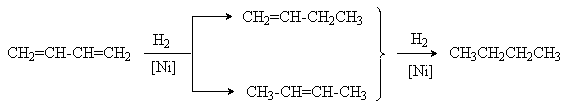
Катализаторами этих реакций являются Ni, Pt, Pd. Особенностью этих реакций является конкуренция 1,4– и 1,2–присоединения. Это связано с наличием двух реакционных центров у поверхностного интермедиата, образующегося в результате реализации механизма реакции

где S – свободная поверхность катализатора.
2. Реакции электрофильного присоединения
а) Галогенирование
При реализации этой реакции образуется смесь продуктов 1,2– и 1,4–присоединения, например:

Образование продуктов конкурирующего галогенирования объясняется следующим механизмом:

Можно видеть, что промежуточный карбкатион имеет два реакционных центра, что и обусловливает образование продуктов конкурентного галогенирования.
При углублении реакции образуются продукты исчерпывающего галогенирования:

Изменение состава продуктов первичного галогенирования при изменении температуры обусловлено изменением характера факторов, определяющих соотношение продуктов. Так, в области высоких температур конкурирующие реакции быстро достигают положения равновесия, и состав продуктов будет определяться соотношением их равновесных концентраций. Таким образом, в области высоких температур осуществляется термодинамический контроль состава продуктов. В области низких температур из-за высокой экзотермичности каждой из конкурирующих реакций их равновесия существенно смещены в сторону продуктов, а скорости их слишком малы, чтобы заметно приблизиться к состоянию равновесия. Поэтому обе реакции протекают в условиях практической необратимости, когда состав продуктов определяется соотношением их скоростей. Это область кинетического контроля состава продуктов.
Энергетический профиль реакции бромид-аниона с промежуточным карбкатионом иллюстрирует факторы, управляющие такого рода процессами.

Можно видеть, что образование продукта 1,4–присоединения термодинамические более выгодно, т.к. теплота Н1,4 – более электроотрицательна, чем Н1,2. Поэтому в области термодинамического контроля предпочтительно образуется продукт 1,4–присоединения. В то же время энергетический барьер образования продукта 1,2–присоединения (Е1,2) ниже, чем энергетический барьер образования продукта 1,4–присоединения (Е1,4). Поскольку система легче преодолевает более низкий барьер, то в области кинетического контроля преобладающим будет продукт 1,2–присоединения.
В целом вероятность термодинамического контроля возрастает с ростом температуры и времени реакции. Наоборот, вероятность кинетического контроля тем больше, чем ниже температура и время реакции.
б) Реакции гидрогалогенирования.
При реализации этих реакций образуются продукты конкурентного галогенирования:

Механизм образования продуктов может быть представлен следующими стадиями:

В области высоких температур состав продуктов определяется термодинамическим контролем и доминирующим продуктом является продукт 1,4–присоединения. В области низких температур состав продуктов определяется кинетическим контролем и основным продуктом является продукт 1,2–присоединения. Таким образом наблюдается полная аналогия между реакциями галогенирования и гидрогалогенирования 1,3-алкадиенов.
в) Полимеризация
Стехиометрически полимеризация сопряженных алкадиенов описывается следующими уравнениями

Полимеризация сопряженных алкадиенов имеет важное практическое значение для синтеза каучуков. Реакция может осуществляться по свободнорадикальному, карбанионному и карбкатионному механизмам в зависимости от типа инициирующей системы. В промышленной практике наиболее широко реализуется стереорегулярная полимеризация под действием катализаторов Циглера-Натта.
Механизм радикальной полимеризации может быть представлен на примере 1,4–присоединения.
Инициирование
I2 2I
Развитие цепей

Таким образом, в результате актов многократного присоединения растущего радикала к алкадиену происходит рост цепи будущего полимера. Обрыв цепей осуществляется рекомбинацией или диспропорционированием макрорадикалов. Можно видеть, что растущие радикалы обладают двойственной реакционной способностью, что открывает возможность образования 1,4– и 1,2–полимера. Обычно при свободнорадикальной полимеризации доминирующим является 1,4–полимер с примесью 1,2–полимера, причем первый в основном состоит из транс-изомера. В качестве инициаторов этих реакций используют пероксиды или азобисизобутиронитрил.
В присутствии металлического натрия осуществляется полимеризация по анион-радикальному механизму:
![]()
Обозначая ![]()
можно представить последующий путь полимеризации совокупностью стадий:

Полимеризация обычно протекает на поверхности металла, поэтому из-за стерических требований к реакции преимущественно образуется 1,2–полимер.
Полимеризация по Циглеру-Натта приводит к образованию стереорегулярного каучука, причем в основном образуются цис-полиалкадиены.
Натуральный каучук представляет собой эластичную при низких температурах, пластичную и клейкую при более высоких температурах массу, которую получают при нагревании млечного сока растений – каучуконосов, таких как гевея. Первое практическое применение натурального каучука нашел Макинтош (1823) – при пропитывании тканей раствором каучука он получил водонепроницаемый материал. Наибольшее значение для широкого использования каучука имело открытие Гудьира (1839). Он обнаружил, что при обработке каучука серой или серосодержащими соединениями получается материал с превосходными механическими свойствами. Так была впервые получена резина. Сера, реагируя по аллильному водороду и двойной связи образует мостики, связывающие между собой полимерные цепи.

Этот процесс называется вулканизацией. При исследовании строения натурального каучука было показано, что он является полимером изопрена. Позже на основе рентгеноструктурного анализа было установлено, что натуральный каучук имеет строение цис-полиизопрена. В природе встречается также транс-полиизопрен, называемый гуттаперчей, который является твердым хрупким материалом и поэтому не находит широкого практического применения.
В СССР впервые синтетический каучук был получен на основе бутадиена–1,3 при катализе Na или K (1932) – метод С.В. Лебедева.
Промышленная партия стереорегулярного полиизопрена была выпущена у нас в стране в 1963 – так называемый каучук СКИ-3. По своим свойствам этот каучук не уступает натуральному.
В 1956 году под руководством советского химика Долгоплоска был разработан метод стереорегулярной полимеризации 1,3–бутадиена и получения на его основе цис-полибутадиенового каучука (дивинилкаучук, СКД). По эластичности СКД не уступает СКИ-3, но превосходит его в устойчивости при низких температурах и износостойкости.
Спектр практического использования каучуков существенно расширен за счет синтеза сополимеров бутадиена со стиролом, бутадиена с акрилонитрилом и др.
3. Реакции диенового синтеза
Алкадиены–1,3 могут присоединяться к двойной (или тройной) связи с образованием циклического продукта (циклоприсоединение [2+4]).

Такие реакции называются диеновым синтезом или реакцией Дильса-Альдера. Соединения, содержащие двойную или тройную связь и вступающие с 1,3–алкадиенами в реакцию диенового синтеза называются диенофилами. Реакционная способность диенофилов увеличивается при активировании их кратной связи электроноакцепторными группами.
В реакции Дильса-Альдера происходит исчезновение трех старых -связей и появление новых: одной -связи и двух -связей. Поскольку прочность -связей существенно выше, чем прочность -связей, реакция Дильса-Альдера экзотермична. Это обусловливает ее обратимость при высоких температурах.
Условием успешного протекания реакции является такая геометрия реагентов, при которой оба конца диена ориентированы на углеродные атомы кратной связи диенофила. При этом происходит согласованный процесс образования новых и разрыва старых связей с синхронным перемещением всех -электронов циклической системы

Поскольку диен может реагировать в s-цисоидной конформации, реакции некоторых диенов являются стерически запрещенными. Примером таких диенов являются приведенные ниже структуры

С точки зрения молекулярно-орбитального рассмотрения циклоприсоединение является согласованным, разрешенным по симметрии процессом. Из нижеприведенной молекулярно-орбитальной картины можно видеть, что симметрия ВЗМО бутадиена и НСМО этилена, а также ВЗМО этилена и НСМО бутадиена одинакова. В результате энергия возмущения велика и реакция циклизации может протекать как согласованный процесс.

Реакция Дильса-Альдера высокостереоспецифична, что проявляется в сохранении конфигурации диена и диенофила в продукте циклизации. Это наглядно видно на примере цис– и транс–дизамещенных алкенов, используемых в качестве диенофилов:

Области применения диенового синтеза
Реакция Дильса-Альдера находит широкое применение для синтеза сложных соединений. Это можно проиллюстрировать рядом реакций:


Как правило наиболее реакционноспособными диенофилами являются алкены, у которых двойная связь сопряжена с электроноакцепторными группами. К числу наиболее известных диенофилов относятся следующие соединения

Поскольку комплементарная электронная природа обоих реагентов является главным условием протекания реакции циклоприсоединения, то наиболее реакционноспособными диенами в реакциях с перечисленными диенофилами являются диены, содержащие при двойных связях электронодонорные группы.
Аллены
Способы получения
Дегалогенирование вицинальных дигалогеналкенов цинком

Изомеризация алкинов

Физические свойства и структура алленов
Аллены – бесцветные газы (С3, С4) или жидкости со слабым запахом.
Углеродные атомы в молекуле аллена находятся в различных состояниях гибридизации: средний атом углерода – в sp–состоянии, два кратных – в sp2–состоянии. Поэтому -связи, образуемые этими атомами с центральным находятся во взаимно перпендикулярных плоскостях

Благодаря такому строению все три атома углерода находятся на одной прямой, а заместители при крайних атомах углерода находятся во взаимно перпендикулярных плоскостях. В случае двузамещенных алленов для них возможны стереоизомеры.

Можно видеть, что структура II является зеркальным отражением структуры I.
Реакции алленов
Аллены активны в различных реакциях, особенно в реакциях присоединения и полимеризации, однако они более реакционноспособны, чем алкены из-за напряжения, связанного с наличием двух двойных связей при центральном углеродном атоме. Наиболее типичными реакциями алленов являются:
1. Каталитическое гидрирование

Cat: Ni, Pt, Pd
2. Изомеризация
![]()
3. Циклизация

4. Реакции электрофильного присоединения
В этих реакциях центром электрофильной атаки является один из крайних атомов углерода

5. Реакции карбонилирования

Получаемые при этом продукты используются в качестве мономеров при получении химических волокон и пластмасс.
Алкадиены с изолированными связями
Для алкадиенов этого типа характерны те же свойства, что и для алкенов, поскольку взаимное влияние двойных связей на расстоянии, более чем две С–С-связи пренебрежимо на фоне влияния ближнего структурного окружения двойной связи.
Лекция №15
АЛКИНЫ
План.
Изомеризация и номенклатура.
Методы синтеза.
Структура и физические свойства.
Химические свойства.
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой СnH2n-2. Первый член гомологического ряда – этин или ацетилен.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры
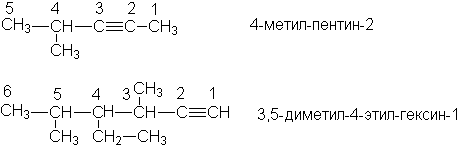
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HC C- этинил
СН3-С С- пропинил-1
НС С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
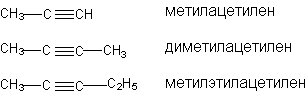
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
Методы синтеза алкинов
Реакции пиролиза метана или этана
2CH4![]() C2H2 +
3H2
C2H2 +
3H2
CH3 -
CH3![]() C2H2 +
2H2
C2H2 +
2H2
При пиролизе метана необходимо строго выдерживать время реакции. Для этого используется “закалка” - быстрый ввод на выходе реакционной зоны воды.
Карбидный метод
CaC2 + 2H2O C2H2 + Ca(OH)2 Аналогично реагируют карбиды стронция и бария SrC2, BaC2. Карбид магния с водой образует пропин
Mg2C3 +4 H2O CH3C CH + 2Mg(OH)2
Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
CH3-CHBr-CH2Br
+ 2NaOH ![]() CH3-C CH
+ 2NaBr + 2H2O
CH3-C CH
+ 2NaBr + 2H2O
CH3-BrC=CH2 + NaOH CH3-C CH + NaBr + H2O
Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
а) R-C CH + NaNH2 R-C C-Na+ + NH3
R-C CNa + R'Hal RC CR' + NaHal
б) R-C C-H +CH3-MgHal R-C C-MgHal + CH4
R-C C-MgHal + R’Hal R-C C-R’ + MgHal2
Физические свойства алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17 , алкины являются кристаллическими веществами.
Тройная связь представляет собой одну -связь С-С и две -связи. При переходе от двойной к тройной связи средняя энергия -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RC C = 5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации. Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена. Это обусловливает более высокую электрофильность алкенов по сравнению с алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных групп.
В электронных спектрах поглощения алкины имеют полосу поглощения при 170-180 нм, что соответствует - - переходу. В ИК спектрах характерны валентные колебания связи С С при 2100-2260 см-1 и связи С-Н при 3270-3330 см-1.
В спектрах ПМР химический сдвиг атома водорода С-Н равен 1,7-2 м.д.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
Реакция гидрирования.
Реакция имеет ступенчатый характер:

Сat: металлические Ni, Pl, Pd.
На первой стадии количественно образуется алкен, и после практического исчерпывания алкина начинается гидрирование алкена. Это связано с более высоким сродством алкинов к поверхности катализатора. Обычно реакция протекает нестереоселективно и образуется смесь цис- и транс-продуктов присоединения.
Модификация катализаторов приводит к стереоселективному синтезу. Так, промотируя палладий оксидом свинца (II) и CaCO3, получают катализатор Линдлара, на котором осуществляется стереоспецифичный синтез цис-изомера.
RCCR' + 2H2 |
|
RCH=CHR' |
|
|
цис-алкен |
К аналогичным результатам приводит катализатор Pd/BaSO4 в пиридине.
Стереоселективное восстановление тройной связи можно осуществлять, используя для этого соответствующие агенты. К этим реакциям относятся:
а) восстановление натрием или литием в жидком аммиаке или этиламине. При этом преимущественно образуется транс-изомер:

б) Гидроборирование. Алкины, подобно алкена, реагируют с гидридами бора, присоединяя их по тройной связи углерод-углерод

Первоначально образуется моноалкенильное производное бора, причем присоединение идет против правила Марковникова. Дальнейшее присоединение может происходить по двойной связи моноалкенильных производных бора. Однако если R2BH ( или RBH2) содержит объемные группы, то пространственные препятствия затрудняют вторую реакцию присоединения и достигается высокий выход моноалкенильного производного.
Реакции такого типа особенно важны для синтезов, поскольку моноалкенильные производные бора могут быть окислены щелочным раствором Н2О2 в альдегиды (если в исходном алкине тройная связь находиться на конце цепи) или в кетоны ( если тройная связь неконцевая)
2C4H9CCH
+ R4B2H2 2C4H9CH=CHB(R)2![]() 2C4H9CH=CH-OH
2C4H9CH=CH-OH
2C4H9CH2CHO

Моноалкенильные производные бора легко реагируют с уксусной кислотой в мягких условиях, образуя алкены. Весь этот процесс полностью стереоспецифичен, поскольку дизамещенные алкины дают только цис-алкены. Очевидно, что гидрид бора присоединяется к тройной связи цис-способом и образующийся моноалкенил бора реагирует далее с кислотой, образуя цис-алкен.

Реакции электрофильного присоединения.
Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:

Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
HC C-CH2-CH=CH2![]() HC C-CH2-CHBr-CH2Br
(90%)
HC C-CH2-CHBr-CH2Br
(90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям

Можно видеть, что винил-катион менее устойчив по сравнению с алкил-катионом, поэтому образование последнего характеризуется более низким энергетическим барьером. В целом механизм галогенирования алкина (на примере бромирования) может быть представлен следующими стадиями:

2. Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый характер.

Обе реакции идут по правилу Марковникова. Показано, что присоединение галогеноводородов к алкинам идет как транс-присоединение. Поскольку реакционная способность тройной связи меньше чем у алкенов, используют катализ: например HgCl2.

3. Реакция гидратации (Реакция Кучерова)

Механизм этой реакции можно представить последовательностью стадий:

При синтезе ацетальдегида протекают побочные реакции:
а) альдольная конденсация
CH3CHO+CH3CHO ![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO ![]() CH3CH=CH-CHO
альдегидные
смолы
CH3CH=CH-CHO
альдегидные
смолы
б) окисление
СH3CHO
+ 2Hg2+![]() 2Hg+ +
CH3COOH
+ 2H+
2Hg+ +
CH3COOH
+ 2H+
CH3CHO + Hg+ Hg + CH3COOH + 2H+
Подавление приведенных побочных реакций можно обеспечить путем увеличения скорости подачи ацетилена в реакционную зону. Благодаря этому образующийся альдегид отдувается из реакционной массы и степень его вовлечения в побочные реакции резко снижается.
4. Присоединение HCN.
![]()
5. Присоединение спиртов.

Кислотные свойства ацетилена и алкинов
с терминальной тройной связью.
Соединения этого типа являются С-Н – кислотами. Атом водорода, находящийся при углероде тройной связи обладает большей кислотностью, чем атом водорода алкенов и алканов. Объясняется это тем, что атомы С обладают большим s-характером и поэтому сильнее притягивают электроны, поэтому С-Н связи поляризованы и электроположительные атомы водорода в них проявляют большую кислотность. Кислотность ацетилена и -алкинов проявляется в следующих реакциях:
RC CH
+ K+NH2-![]()
![]() RC C-K+ +
NH3
RC C-K+ +
NH3
Амид-анион обладает высокой основностью, что обусловливает сдвиг равновесия в сторону образования ацетиленида. В то же время, вода, обладая более высокой кислотностью по сравнению с ацетиленом, вытесняет последний из ацетиленидов:
RC CК + H2O RC CH + КOH
Натриевые, калиевые и другие ацетилениды щелочных металлов являются истинными солями, состоящие из катиона металла и ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные соединения, нерастворимые в воде. Они осаждаются из водного раствора.
Осаждением ацетиленида серебра определяют наличие тройной связи или отделяют терминальные ацетилены от дизамещенных:
RC CH + [Ag(NH3)2]NO3 RC CAg + NH4NO3 + NH3
RC CR' + [Ag(NH3)2]NO3 реакция не идет
Монозамещенные ацетилены тяжелых металлов легко регенерируют из осадка под действием сильных минеральных кислот.
RC CAg + HNO3 RC CH + AgNO3
Аналогичное использование находят ацетилениды меди
RCCH + [Cu(NH3)2]Cl RCC-Cu + NH4Cl + NH3
RCC-Cu + HCl RCCH + CuCl
Ацетилениды магния (реактив ) имеют важное синтетическое значение. Их получают действием терминального алкина на магний органические соединения с предельными радикалами:
RCCH + CH3MgI CH4 + RCC-MgI
Благодаря этому реактиву можно получать спирты и карбоновые кислоты, содержащую тройную связь: а) RCC-MgI + CH2=O RCC-CH2-OMgI RCC-CH2OH + Mg(OH)I
первичный спирт
б)

вторичный спирт
в)

третичный спирт
г)

карбоновая кислота
Подобные синтезы можно осуществлять путем конденсации ацетилена или терминальных алкинов с альдегидами и кетонами (Фаворский)

Механизм:

+ OH-
Конденсация ацетилена с альдегидами в присутствии щелочей не дает желаемого результата из-за побочной реакции альдольной конденсации. В.Реппе осуществил ее разработав новый катализатор на основе ацетиленида меди, стабилизированного соединениями висмута:
СH CH
+ CH2O CH CH-CH2OH ![]() HO-CH2-C C-CH2-OH
HO-CH2-C C-CH2-OH
(бутиндиол-1,4)
Изомеризация алкинов
Алкины способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит на конец молекулы полученного ацетиленида. Действие спиртовых щелочей способствует переходу тройной связи с конца молекулы в центр. Промежуточными продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
CH3CH2CCH ![]() CH3CCCH3
CH3CCCH3
Окисление
RC CR'
+ KMnO4 ![]() RCOOH
+ R'COOH
RCOOH
+ R'COOH
RCCH ![]() RCOOH
+ CO2
RCOOH
+ CO2
RCCR' ![]() RCOOH
+ R'COOH
RCOOH
+ R'COOH
Окислительная конденсация терминальных алкинов.
2RCCH ![]() RCC-CCR
RCC-CCR
Полимеризация
1) Реакция Зелинского:

2) Димеризация:
2HCCH![]() HCC-CH=CH2
H2C=CH-CC-CH=CH2
HCC-CH=CH2
H2C=CH-CC-CH=CH2
винилацетилен дивинилацетилен Карбонилирование (Реппе)
CHCH + CO + H2O CH2=CH-COOH акриловая кислота
CHCH + CO + ROH CH2=CH-COOR эфир акриловой кислоты
CHCH + CO + NH3 CH2=CH-CONH2 амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля и кобальта.
