
- •Введение
- •Общие методические указания
- •1 Лабораторная работа №1. Определение газовой постоянной воздуха
- •1.1 Цель работы
- •1.2 Задание
- •1.3 Краткие теоретические сведения
- •1.4 Методика проведения работы и описание экспериментальной установки.
- •1.5 Порядок проведения работы и обработка результатов эксперимента
- •2 Лабораторная работа №2. Изотермическое сжатие воздуха
- •2.1 Цель работы
- •2.2 Задание
- •2.3 Краткие теоретические сведения
- •2.4 Методика проведения работы и описание экспериментальной установки
- •2.5 Порядок проведения работы и обработка результатов эксперимента
- •3 Лабораторная работа №3. Адиабатное расширение воздуха
- •3.1 Цель работы
- •3.2 Задание
- •3.3 Краткие теоретические сведения
- •3.4 Методика проведения работы и описание экспериментальной установки
- •3.5 Порядок проведения работы и обработка результатов эксперимента
- •4 Лабораторная работа №4. Измерение теплоемкости твердых тел
- •4.1 Цель работы
- •4.2 Задание
- •4.3 Краткие теоретические сведения
- •4.4 Методика проведения работы, описание и принцип работы прибора ит – с – 400.
- •4.5 Порядок проведения работы и обработка результатов эксперимента
- •23) Проводить расчет удельной массовой теплоемкости по формуле (4.14).
- •24) Построить зависимость удельной массовой теплоемкости испытуемого образца .
- •25) Максимальная относительная погрешность измерения удельной теплоемкости , оценивается по формуле
- •5.Лабораторная работа №5. Измерени теплопроводности твердых тел
- •5.1 Цель работы
- •5.2 Задание
- •5.3 Краткие теоретические сведения
- •5.4 Методика проведения работы, описание и принцип работы прибора ит – λ – 400
- •5.5 Порядок проведения работы и обработка результатов эксперимента
- •20) Проводить расчет теплопроводности в следующей последовательности:
- •22) Максимальная относительная погрешность измерения коэффициента теплопроводности λ оценивается с помощью уравнения
- •Список литературы
- •Приложение а
- •Приложение б
- •Приложение в
2 Лабораторная работа №2. Изотермическое сжатие воздуха
2.1 Цель работы
Цель работы – изучение закономерностей изменения параметров состояния идеального газа (воздуха) при изотермическом процессе, расчет работы процесса и изменений калорических функций (энтропии).
2.2 Задание
1) Получить
экспериментальную и расчетную
(теоретическую) зависимость объема газа
(воздуха) от давления в изотермическом
процессе V=![]() (P)
при Т=
(P)
при Т=![]()
2) Сравнить экспериментальную зависимость V= (P) (изотерму(кривую)) с теоретической рассчитанной по формуле (2.2).
3) Рассчитать экспериментальную и теоретическую работу изотермического сжатия в процессе двумя заданными состояниями по формуле (2.3) или (2.4).
4) Определить (экспериментально) показатель политропы процесса n в процессе двумя заданными состояниями по формуле (2.12).
5) Рассчитать (экспериментально) изменения энтропии в процессе между двумя заданными состояниями по формуле (2.7) или (2.9).
6) Вычислить относительную величину расхождения между значениями работы сжатия и давления, рассчитанную по экспериментальной и расчетной кривой по формулам (2.2) и (2.4).
2.3 Краткие теоретические сведения
Сухой воздух при давлениях, близких к атмосферному с достаточной степенью точности может считаться идеальным газом. В идеальных газах отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа. Связь между параметрами в двух состояниях 1 и 2 равновесного изотермического процесса идеального газа характеризуются уравнением Бойля-Мариотта
![]() (2.1)
(2.1)
или для m кг газа
![]() ,
(2.2)
,
(2.2)
где идеальный объем газа, ; V=m – объем газа, .
Экспериментальная работа изменения объема газа в изотермическом процессе между состояниями 1 и 2 определяется по формуле (для 1 кг газа)
![]() ,
Дж/кг
(2.3)
,
Дж/кг
(2.3)
или для m кг газа
![]() ,
Дж
(2.4)
,
Дж
(2.4)
где m (кг) масса рабочего тела в каждом опыте в бюретке 6, кг. Ее можно найти по уравнению состояния идеального газа:
m=![]() ,
кг
(2.5)
,
кг
(2.5)
где R =287 Дж/(кг·К)– газовая постоянная воздуха.
Внутренняя
энергия и энтальпия газа в изотермическом
процессе не меняется, поэтому из первого
закона термодинамики (![]() )
работа изменения объема и количество
теплоты, полученное телом, равны между
собой.
)
работа изменения объема и количество
теплоты, полученное телом, равны между
собой.
![]() ,
Дж.
(2.6)
,
Дж.
(2.6)
Изменение экспериментальной энтропии в изотермическом процессе, т.е. разность энтропии, соответствующих состояниям 1и 2 вычисляется следующим образом
![]() Дж/К
. (2.7)
Дж/К
. (2.7)
Формула (2.7) может быть приведена к другому виду. Из уравнения состояния идеального газа имеем
mR=PV/T . (2.8)
С учетом этого соотношения (2.6) приобретает вид
![]() Дж/К.
(2.9)
Дж/К.
(2.9)
Теплоемкость в изотермическом процессе
![]() .
(2.10)
.
(2.10)
Показатель политропы n любого политропного процесса 1-2 (из уравнения политропного процесса)
![]() ,
(2.11)
,
(2.11)
рассчитывается по формуле
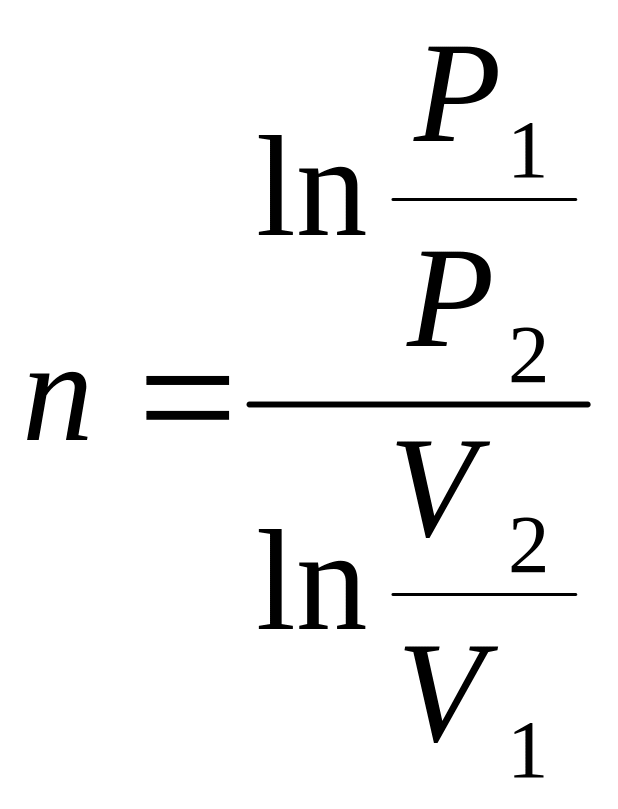 .
(2.12)
.
(2.12)
