
Политропный процесс.
Обобщенный процесс для идеального газа, включающий ряд термодинамических процессов как частные случаи, подчиняющийся уравнению
pvn = const ,
называют политропическим процессом, n – показатель политропы.
n = 0 – изобарный процесс, n – изохорный процесс (v = const),
(pvn = pv0n p1/nv = p1/nv0 v v0 = const при n )
n = – адиабатный процесс, n = 1 – изотермический процесс.
Политропный процесс характеризуется постоянной теплоемкостью Cn . Это второе (независимое) определение политропного процесса. Для идеального газа можно получить соотношение (получим на семинаре)
 (2)
(2)
Для теплового эффекта по второму определению политропного процесса, имеем
qn = CnT .
Соответственно для изменения внутренней энергии и работы имеем
u
= CvT
, ln
= qn
– u
= (Cn
– Cv)T
=
 ,
,
где учли формулу (2), уравнение Менделеева-Клапейрона и равенство T = T2 – T1 . В случае адиабаты Cn = 0 , имеем n = .
Уравнения для работы получаются из соответствующих уравнений для адиабатного процесса заменой n .
Дифференциальные уравнения идеального газа.
Для идеального газа имеем два соотношения: pv = RT и Tds = du + pdv
ds = CvdT/T + Rdv/v или ds = CpdT/T – Rdp/p . Здесь учтена зависимость для внутренней энергии u = CvT и соотношение Майера Cp = Cv + R .
Интегральный вид.
При достаточно высоких температурах выполняются соотношения: Cv = const , Cp = const
s = s2 – s1 = Cvln(T2/T1) + Rln(v2/v1) , s = s2 – s1 = Cpln(T2/T1) – Rln(p2/p1) .
Частные случаи:
v = const , s = Cvln(T2/T1) ; p = const , s = Cpln(T2/T1) .
При s = 0 (адиабатный процесс) получаем формулу pv = const .
Первый закон термодинамики для потока вещества.
Пусть идеальный, нетеплопроводящий газ ( = 0 , = 0 , – коэффициент динамической вязкости, – коэффициент теплопроводности) движется в однородном поле тяжести. В каждом сечении S трубки тока (см. рис. 1) выполняется локальное термодинамическое равновесие. Имеем следующий закон сохранения вещества при стационарном течении (уравнение расхода)
Рис. 1.
j = SW = SW/v = const .
За малое время t через любое сечение проходит M = jt количество вещества. Далее находим изменение различных видов энергии в трубке (разность между выходящим и входящим потоком энергии на торцах трубки тока)
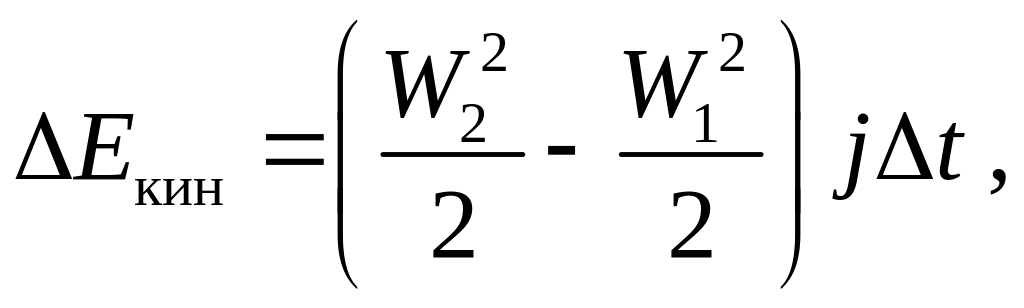
Eпот = g(z2 – z1)jt ,
Eвнут = (u2 – u1)jt ,
–Eвнеш = Wвнеш = F1l1– F2l2 = (p1S1)(W1t) – (p2S2)(W2t) = –(p2v2 – p1v1)jt .
Величина Wвнеш – работа внешних сил давления над газом за промежуток времени t , заставляющих его двигаться. В идеальной жидкости (газе) через боковую поверхность трубки обмена механической энергии нет. Из баланса энергии для вещества между сечениями S1 и S2 находим выражение для подведенной теплоты qjt после сокращения на величину jt :
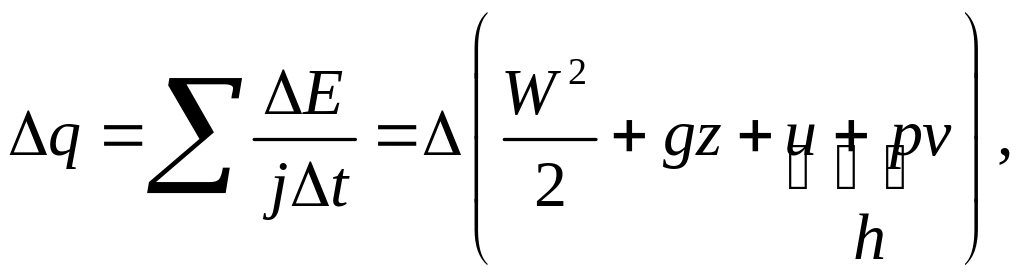
где учтено равенство h = u + pv . В дифференциальной форме имеем
dq = WdW + gdz + dh . (1)
Соотношение (1) показывает, почему в энергетическом балансе даже при медленных течениях (пренебрежении слагаемым WdW) и отсутствии перепада высоты dz = 0 используется энтальпия (dq = dh), а не внутренняя энергия, как это реализуется при отсутствии потоков (например, в периодических процессах).
Отметим, что при движении работа сил давления не равна pdv . Давление меняется от точки к точке и это существенно. При наличии потока вещества процесс не будет квазистатическим (обратимым) так как равновесие нарушено. Отметим также, что при выводе уравнения (1) не учтены возможные работы технических устройств и сил трения (идеальная жидкость). В ТТ уравнение (1) дополняют соответствующими слагаемыми: lтехн – технической работой и работой сил трения lтрен и используют следующее уравнение
q = WdW + gdz + du + d(pv) + lтехн + lтрен .
