
- •4. Растворы и реакции в растворах
- •4.2. Термодинамическое описание молекулярного раствора
- •4.3. Растворы электролитов
- •4.4. Электролитическая диссоциация
- •4.5. Ионные реакции и равновесия в растворах рассматриваются на основе:
- •4.6. Ионизация воды. PH и pOh
- •4.7. Влияние общих ионов
- •4.8. Буферные растворы.
- •4.9. Кислоты и основания
- •4.10. Нейтрализация и гидролиз
- •4.11. Амфотерные электролиты
- •4.12. Слабо растворимые соли
- •4.13. Факторы, обусловливающие более полную завершенность реакций.
4.8. Буферные растворы.
Особый случай влияния одинаковых ионов - так называемые буферные растворы (БР), образованные слабой кислотой и ее солью HA + KA (общий анион А) или слабым основанием и его солью KOH + KA (общий катион К):
При достаточно большом резерве ионных и молекулярных частиц такая система обладает способностью поддерживать почти постоянные значения рН при добавлении в нее сильной кислоты или сильного основания.
Рассмотрим количественный аспект буферной системы с общим ацетат-ионом А− ≡ CH3(CO)O−. |
CH3(CO)OH + NaCH3COO HA (0,1 М) NaA (0,1 М) |
С учетом пренебрежимо малой диссоциации HA и практически полной диссоциации NaA из условия электронейтральности:
[A−] = [H+] + [Na+] ≈ [NaA] = 0,1М,
поэтому в исходном буферном растворе
[H+] = [HA] Ka / [A−] ≈ Ka = 1,8·10-5 М, pH = 4,74.
Добавление 0,05 М сильной кислоты, например, HCl приводит к тому, что имеющийся там резерв (сильного основания (см. раздел 4.8)) обусловливает нейтрализацию большей части вновь появившихся ионов Н+. Оставшаяся часть ацетат-ионов несколько уменьшает Н+ подавляя диссоциацию уксусной кислоты CH3(CO)OH ↔ H+ + CH3(CO)O-.
[H+] = [HA] Ka / [A−] = (0,1 + 0,05 - [HA]) Ka / (0,05 + [H+]) = 0,15 · 1,8·10-5 / 0,05 = 5,4· 10-5 М, pH = 4,27. Δ(pH) = 4,27 – 4,74 = -0,47
Уменьшение рН незначительно по сравнению с его падением при переходе от воды к раствору [HCl] = 0,05М той же концентрации: Δ(pH) =- (lg(0,05)) -7 = 1,3 – 7 = -5,7.
Аналогичным образом может быть количественно охарактеризовано небольшое изменение рН при добавлении к БР сильного основания. Однако и в том и в другом случае добавление не должно превышать имеющиеся количества соответствующих ионов.
Таблица 4.2. Примеры систем со стабилизированными значениями рН.
Вещество |
рН |
Вещество |
рН |
Кровь человека (буфер: H2PO4-, HCO3-, белки) |
~7,4 |
Слезы (буфер: белки) |
~7,4 |
Слюна |
~6,6 |
Молоко |
6,6 – 6,9 |
Желудочный сок |
0,9 |
Яичный белок |
8,0 |
Моча |
4,8 – 7,5 |
Морская вода |
8,0 |
Буферные растворы играют жизненно важную роль, поддерживая приблизительно постоянное значение рН во многих биохимических реакциях. БР широко используются в аналитической химии и на производстве, когда осаждение, разделение, экстракция, ионный обмен и др. процессы возможны лишь в определенных пределах рН растворов.
4.9. Кислоты и основания
По протонной теории (классификации) Бренстеда – Лаури кислота – донор протона, а основание – акцептор протона. При этом кислота, теряя протон, превращается в сопряженное ей основание. Аналогичным образом основание, присоединяя протон, становится кислотой, сопряженной основанию.
+


(б) Основание2 + Н+ = Кислота2 пара
К-та1 + Осн-е2 = Осн-е1 + К-та2
Процесс нейтрализации – это реакция, в которой основания соревнуются за обладание протонами или реакция взаимного превращения более сильных кислот и оснований в суммарно более слабые, т.е. менее диссоциируемые соединения.
Рассмотрим количественный аспект протонной теории кислот и оснований. Напомним, что активность ai = γi mi = fi·[Ai].
+

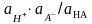
(б) (H2O + H+ = H3O+) − растворителю H2O, как слабому основанию
HA + H2O = A− + H3O+ соответствует сильная кислота H3O+.
(а) B + H+ = BH+
(б) (H2O = H+ + OH−) − вода (растворитель) играет роль слабой кислоты.
B + H2O = BH+ + OH- Kb = aBH+ ·aOH− / aB .
Для реакции, обратной (а) уравнение диссоциации кислоты ВН+, сопряженной основанию В имеет вид:
ВН+ = H+ + В Ка = аВ аН+/ aBH+.
Произведение Кb · Ка = aH+ ∙ ·aOH− = KW = 1,008 · 10-14 (рКW = 14,0).
Это количественное соотношение кроме водного раствора связывает силу сопряженных кислот и оснований в любом растворителе посредством ионного произведения растворителя с константой автопротолиза КS. Таким образом, ионы растворенного вещества при участии ионов растворителя соревнуются в химических реакциях за обладание протонами в стремлении образовать энергетически более выгодные, как правило, менее диссоциированные соединения. |
|
