
- •Федеральное агентство высшего образования Российской Федерации
- •Ангарская государственная техническая академия
- •Кафедра уат
- •Изучение диаграмм состояния двойных систем
- •Методическое указание к выполнению лабораторной работы по курсу «Материаловедение и технология конструкционных материалов»
- •Лабораторная работа. Изучение диаграммы состояния двойных сплавов.
- •I. Цель работы:
- •II. Материалы и оборудование:
- •III. Краткие теоретические сведения.
- •IV. Задание.
- •V. Методические указания.
- •VI. Порядок оформления отчета.
- •Материалы и оборудование.
- •VII. Контрольные вопросы.
- •VIII. Литература.
Федеральное агентство высшего образования Российской Федерации
Ангарская государственная техническая академия
Кафедра уат
Изучение диаграмм состояния двойных систем
Методическое указание к выполнению лабораторной работы по курсу «Материаловедение и технология конструкционных материалов»
А
Изучение диаграмм состояния двойных систем. Методическое руководство к выполнению лабораторной работы по курсу «Материаловедение и технология конструкционных материалов». Никанорова Л.В. Ангарская государственная техническая академия.- Ангарск, АГТА, 2008 – 14 с., 7 рис.
Рецензент: к.т.н., доцент кафедры МАХП Асламов А.А.
Рекомендовано к изданию учебно-методическим советом АГТА.
АГТА
Кафедра УАТ
Лабораторная работа. Изучение диаграммы состояния двойных сплавов.
I. Цель работы:
Определение основных линий диаграммы состояния.
Проведение структурного анализа всех областей диаграммы с описанием превращений, происходящих при охлаждении системы.
Определение количественного соотношения и структурных составляющих в сплаве определенного химического состава.
II. Материалы и оборудование:
Индивидуальные задания диаграмм состояния двойных сплавов.
Плакат диаграммы состояния системы Fe-C.
III. Краткие теоретические сведения.
Изучение структуры и свойств сплавов является важной составной частью металловедения. Чистые металлы применяются в технике значительно реже, чем сплавы, т.к. металлы обладают сравнительно низкими механическими свойствами и не могут обладать особыми свойствами, которыми отличаются сплавы.
Металлическим сплавом называется вещество, состоящее из двух и более компонентов (элементов) и обладающее металлическими свойствами. Обычным способом получения сплавов является сплавление, но иногда применяют спекание, электролиз или возгонку. Сплавы, полученные такими способами, называются псевдосплавами.
При изучении сплавов пользуются следующими терминами: компонент, фаза, система.
Компонентами называются вещества, образующие систему. Вещества являются самостоятельными составляющими, из которых при определенных условиях могут образовываться все фазы данной системы. Компонентами могут быть чистые элементы (металлы и неметаллы), а также устойчивые химические соединения.
Фазой называют однородные составные части системы, имеющие одинаковый состав, одно и то же агрегатное состояние, кристаллическую структуру и отделяющиеся от остальных частей (фаз) системы поверхностью раздела (границей), при переходе через которую скачкообразно меняются химический состав, агрегатное состояние или кристаллическая структура вещества. Фазами могут быть чистые металлы и неметаллы, возможные их аллотропические (полиморфные) модификации, химические соединения, жидкие и твердые растворы.
Системой называется совокупность фаз (твердых и жидких), находящихся в состоянии равновесия. В этом состоянии все внутренние (концентрация) и внешние (температура и давление) факторы системы уравновешены, т.е. все превращения совершаются обратимо. Это означает, что при изменении системы в одном направлении все процессы возмещаются процессами, происходящими при изменении системы в обратном направлении, т.е. состав и число фаз остается неизменным.
При образовании сплава атомы компонентов вступают в определенные взаимодействия друг с другом, иначе, компоненты растворяются.
В случае полной растворимости компонентов в жидком состоянии сплав представляет собой жидкий однофазный раствор.
В твердом состоянии компоненты могут иметь различные степени взаимной растворимости. В результате, могут образовываться следующие виды сплавов: твердые растворы, механические смеси и химические соединения.
Твердыми растворами называют сплавы, в которых один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы другого компонента (растворимого) располагаются в решетке первого компонента, искажая ее. Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки (элемента растворителя) и представляет собой одну фазу. Пропорции растворимого и растворителя могут меняться без нарушения однородности.
Структура твердого раствора, видимая под микроскопом, состоит, как и у чистых металлов, из однородных зерен.
α
Рис.1. Схема микроструктуры α - твердого раствора.
Обозначаются твердые растворы буквами греческого алфавита α, β, γ, δ и т.д.
В зависимости от характера распределения атомов растворимого в кристаллической решетке растворителя различают три типа твердых растворов: твердые растворы замещения, твердые растворы внедрения и твердые растворы вычитания.
Твердые растворы замещения (рис. 2 а) образуются путем замены атомов основного металла (растворителя А) в его кристаллической решетке атомами другого вещества (растворимого В).
а)
б)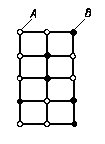
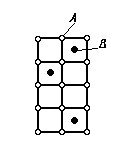
Рис. 2. Схема кристаллической решетки: а - твердого раствора замещения;
б - твердого раствора внедрения.
В случае, когда компоненты полностью растворяются друг в друге, образуется неограниченный твердый раствор, а при частичном растворении – ограниченный. Распределение атомов в решетке может быть упорядоченным или неупорядоченным. Большинство твердых растворов замещения имеют неупорядоченное строение, т.е. атомы растворимого вещества занимают случайные места в кристаллической решетке растворителя и, следовательно, распределяются статистически равномерно.
Твердые растворы с неограниченной растворимостью могут образовываться при соблюдении следующих условий:
Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками. Только в этом случае при изменении концентрации твердого раствора будет возможен непрерывный переход от кристаллической решетки одного компонента к решетке другого компонента.
Различие в атомных размерах R компонентов должно быть незначительным и не превышать 8 - 13% .
Компоненты должны принадлежать к одной и той же группе периодической системы элементов или к смежным родственным группам и в связи с этим иметь близкое строение валентной оболочки электронов в атоме.
Например, компоненты с ГЦК - решеткой: Ag - Au ( R = 0,2 %), Ni - Cu ( R = 2,7%), Ni - Rd ( R = 10,5%), с ОЦК - решеткой: Mo - W ( R = 9,9 %), V - Ti ( R = 2 %).
При замещении атомов одного компонента атомами другого компонента, учитывая различие в размерах атомов, происходит искажение кристаллической решетки. Это искажение тем больше, чем больше разница в размерах атомов и строении их кристаллических решеток. При чрезмерном искажении решетки дальнейшая растворимость становится невозможной. Наступает предельная растворимость, при которой дополнительно вводимые атомы не могут войти в решетку и образуют самостоятельную фазу.
Твердые растворы внедрения (рис. 2 б) образуются путем внедрения атомов растворяемого элемента в кристаллическую решетку растворителя и размещения их между атомами растворителя. Такими являются элементы, находящиеся в начале периодической системы Менделеева: углерод, водород, азот, бор. Внедрение происходит только в тех условиях, когда диаметр атома растворенного элемента намного меньше диаметра атома растворителя. Твердые растворы внедрения могут быть только ограниченными. Встречаются они преимущественно в компактных решетках: гексагональной и гранецентрированной кубической.
Твердые растворы вычитания образуются на базе химических соединений (TiC, NbC, FeO). Этот процесс сопровождается появлением свободных мест (вакансий) в узлах кристаллической решетки вследствие недостатка того или иного компонента при кристаллизации и вызывает искажения кристаллической решетки.
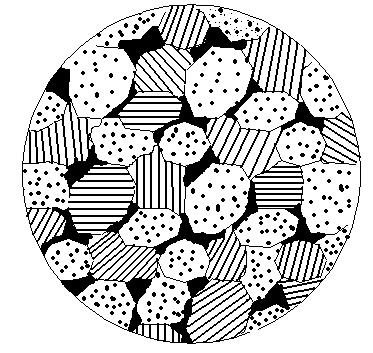
Механическими смесями называются сплавы, состоящие из компонентов, которые не способны к взаимному растворению в твердом состоянии и не образуют химических соединений. Они могут состоять из чистых компонентов, твердых растворов, химических соединений. Механические смеси образуются между элементами, значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше, чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов (рис. 3). Зерна механической смеси связываются между собой только общими границами. В сплавах сохраняются кристаллические решетки компонентов. Обозначаются механические смеси (А+В), (α + В), (А + АmBn) и т.п.

Рис. 3. Схема микроструктуры механической смеси (А+В).
Различают простую, эвтектическую и эвтектоидную механические смеси.
Простая смесь образуется при любом процентном соотношении компонентов и на практике встречается редко, например, (Fe+Pb), (Cu+Pb) и др.
Эвтектическая смесь образуется при постоянной температуре при переходе сплава из жидкого состояния в твердое строго определенного химического состава. Эвтектические сплавы обладают достаточно высокими литейными характеристиками, они легкоплавки.
Эвтектоидная смесь образуется при постоянной температуре при распаде твердого раствора определенного химического состава в процессе охлаждения.
Химическими соединениями называются сплавы, состоящие из компонентов, имеющих в твердом состоянии определенное соотношение элементов АmBn и специфическую кристаллическую решетку (рис. 4.). Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерные особенности химических соединений, образованных по закону нормальной валентности, приведены ниже.
Кристаллическая решетка химического соединения отличается от решеток компонентов, образующих его.
В соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой АmВn, где А и В - существующие элементы; m и n - простые числа (соотношение атомов компонентов).
Свойства соединения резко отличаются от свойств образующих их компонентов.
Температура плавления (диссоциации) постоянная.
Образование химического соединения сопровождается значительным тепловым эффектом.
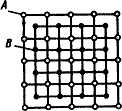
Рис. 4. Кристаллическая решетка химического соединения.
В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Например: Mg2Sn, M2Pb, Mg2P, Mg3Sb, Mg3Bi2, MgS и др.
Соединение одних металлов с другими носят общее название интерметаллиды, или интерметаллических соединений. Соединения металлов с неметаллами (карбиды, нитриды, бориды и т.д.), которые могут обладать металлической связью, нередко также называют металлическими соединениями.
Кроме твердых растворов, механических смесей и химических соединений в структуре могут быть фазы, которые нельзя отнести к перечисленным, их называют промежуточными фазами. К ним относятся: фазы внедрения, электронные соединения (фазы Юм-Розери), фазы Лавеса, сверхструктуры и т.д.
Фазы внедрения. Переходные металлы (железо, марганец, хром, молибден и др.) образуют с углеродом, азотом, бором и водородом, т.е. с элементами, имеющими малый атомный радиус, соединения: карбиды, нитриды, бориды и гидриды. Они имеют общность строения и свойств и часто называются фазами внедрения. Фазы внедрения имеют формулу Ме4Х, Ме2Х и МеХ, где Ме – металл, Х - металлоид. Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла и металла Rх и Rм. Если Rх / Rм 0, 59, то атомы металла в этих фазах расположены по типу одной из основных кристаллических решеток: кубической или гексагональной, в которую внедряются атомы неметалла, занимая в ней определенные поры. Фазы внедрения являются фазами переменного состава; карбиды и нитриды, относящиеся к фазам внедрения, обладают высокой твердостью.
Рассмотренные выше твердые растворы внедрения образуются при значительно меньшей концентрации второго компонента (C, N, H) и имеют решетку металла растворителя, тогда как фазы внедрения получают кристаллическую решетку, отличную от решетки металла. На базе фазы внедрения легко образуются твердые растворы вычитания, называемые иногда твердыми растворами с дефектной решеткой. В твердых растворах вычитания часть узлов решетки, которые должны быть заняты атомами одного из компонент, оказывается свободным. В избытке имеется другой компонент.
Электронные соединения. Эти соединения чаще всего образуются между одновалентными металлами или металлами переходных групп с одной стороны, и простыми металлами с валентностью от 2 до 5 с другой стороны. Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Так, существуют соединения, у которых это соотношение в одних случаях равно 3/2 (1,5), в других - 21/13 (1,62), в третьих - 7/4 (1,75). Соединения 3/2, обозначаются как - соединения с ОЦК - решеткой, 21/13 - - соединения со сложной кубической решеткой, 7/4 - - соединения, имеющие гексагональную плотноупакованную решетку.
Фазы Лавеса. Эти фазы имеют формулу АВ2 и образуются между компонентами типа А и В при соотношении атомных диаметров DА/DВ 1,11,6. Фазы Лавеса имеют решетку ГПУ или ГЦК.
Сверхструктура. В некоторых сплавах (например, медь - золото, железо - алюминий, железо - кремний, никель - марганец), образующих при высоких температурах растворы замещения, при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов, в результате которого атомы компонентов занимают определенные положения в кристаллической решетке. Такие растворы, устойчивые при сравнительно низких температурах, получили название упорядоченных твердых растворов или сверхструктур.
Диаграмма состояния системы компонентов.
Структура сплава и ее свойства во многом зависят от условий охлаждения. Если сплав выдерживать достаточно длительное время при определенной температуре и давлении, то он приблизится к равновесному состоянию. Поскольку равновесное состояние полностью определяется составом, давлением и температурой сплава, то можно построить диаграммы равновесия, указывающие структуру сплава в зависимости от этих переменных. Т.к. металлы и сплавы рассматриваются при атмосферном давлении, то при построении диаграмм состояния можно пренебречь его влиянием. Таким образом, равновесие между жидкой и твердой фазами можно изучать в зависимости только от температуры и химического состава (концентрации).
Итак, диаграмма состояния системы – это графическое изображение фазовых превращений системы компонентов в зависимости от температуры и концентрации компонентов.
Диаграмма состояния дает возможность определить оптимальную температуру заливки сплава, оценить его жидкотекучесть; определить фазовый состав сплава той или иной концентрации в условиях равновесия, дать количественную и качественную характеристики фаз (указать состав фаз и некоторые механические свойства).
Диаграмма состояния позволяет проследить за фазовыми превращениями, происходящими в сплаве при нагревании и охлаждении; процессами перекристаллизации в твердом состоянии; дать ожидаемую качественную характеристику структурных составляющих.
Большое значение диаграммы состояния имеют при проведении термической обработки сплавов. В этом случае по ним можно определить оптимальные температурные режимы для данного сплава, а также вид термической обработки, который может воспринимать этот сплав.
Таким образом, диаграммы состояния двойных и более сложных систем показывают графически, как с изменением температуры и концентрации изменяются количество, состав и структура фаз, находящихся в равновесном состоянии. Из этого следует, что любая точка диаграммы состояния системы показывает:
а) химический состав сплава;
б) температуру сплава;
в) фазовый состав;
г) структуру сплава.
Принцип построения диаграмм состояния следующий. Предположим, система состоит из двух компонентов А и В, неограниченно растворимых друг в друге. На оси абсцисс (рис. 5) располагается горизонтальная прямая АВ, принимаемая за 100% сплав (ось концентраций). Любая точка на этой прямой указывает состав двойного сплава в весовых процентах. Конечные точки А и В соответствуют чистым компонентам, т.е. 100% каждого из компонентов.
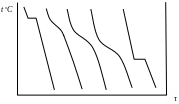
Рис. 6. Кривые
охлаждения чистых компонентов А и В,
их сплавов.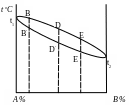


Количество компонента А увеличивается от точки В влево, т.е. от нуля в точке В до 100% в точке А; количество компонента В, наоборот, возрастает вправо, от нуля в точке А до 100% в точке В. Таким образом, прямая АВ, определяющая процентный состав любого сплава, состоящего из компонентов А и В, является осью концентраций.
Температуру откладывают на оси ординат. На ординате, соответствующей чистому компоненту А, откладывают температуру плавления (кристаллизации) компонента А (t1); на другой ординате – температуру плавления (кристаллизации) компонента В (t2).
Любая точка, расположенная между ординатами, показывает состав и температуру сплава.
Температуры кристаллизации сплавов отличаются от температур кристаллизации чистых компонентов. Чистые компоненты кристаллизуются при определенных температурах t1 и t2; прибавление одного компонента к другому вызывает повышение или понижение температуры кристаллизации. Этот процесс происходит в интервале температур, т.е. имеются точки начала и конца кристаллизации. Для получения этих и других точек необходимо построить для сплавов различного состава данной системы кривые охлаждения, т.е. графики изменения температуры сплавов во времени (рис.6).
Фазовые превращения, происходящие в сплавах при охлаждении, сопровождаются выделением скрытой теплоты кристаллизации, компенсирующей отвод тепла во внешнюю среду и замедляющей снижение температуры сплава. Поэтому превращения, происходящие при постоянной температуре, отмечаются на кривой охлаждения горизонтальной площадкой, а протекающие в интервале температур — точками перегибов в начале и в конце превращения.
Точки на диаграмме состояния, соответствующие температурам начала кристаллизации сплавов (В, Д, Е), соединенные между собой, образуют линию ликвидус1. Точки, соответствующие температурам конца кристаллизации (В', Д', Е'), соединенные между собой, образуют линию солидус2.
Структурный анализ диаграммы состояния системы.
Структурный анализ диаграммы начинается с определения типа диаграммы. Тип диаграммы состояния определяется характером взаимодействия веществ (компонентов), образующих систему сплавов. В случае полной растворимости компонентов в жидком состоянии сплав представляет собой жидкий однофазный раствор. В твердом состоянии компоненты могут иметь различные степени растворимости. Поэтому могут образовываться твердые растворы, механические смеси или химические соединения. В качестве примера на рис. 7 приведена диаграмма состояния для компонентов А и В.
Для данной системы компонентов линия АEFB является линией ликвидус, линия ACDJG – линией солидус.
Из диаграммы видно, что выше заштрихованных областей (выше линии ликвидуса) сплавы находятся в жидком состоянии; ниже заштрихованных областей (ниже линии солидуса) – в твердом состоянии.
В заштрихованных областях (области кристаллизации) присутствуют две фазы: жидкая и твердая фаза различного состава.
В рассматриваемой системе двух компонентов образуются следующие фазы:
твердые растворы , , на основе компонента А;
чистый компонент В.
Перечисленные фазы могут находиться как в структурно свободном состоянии, так и в различном сочетании друг с другом, образуя при этом механические смеси.
Предельная растворимость компонента В в А определяется линиями JS, CMH, PZ. По линиям JS и PZ видно, что с понижением температуры растворимость компонента В в А уменьшается.
На линии CDE происходит перитектическое превращение. Оно заключается в том, что кристаллы - твердого раствора путем взаимодействия с окружающей их жидкостью образуют кристаллы - твердого раствора. Это превращение можно выразить так:
С + жЕ D,
где С – твердый раствор концентрации точки С;
жЕ – жидкий раствор концентрации точки Е;
D – твердый раствор концентрации точки D.
На линии МNR происходит перитектоидное превращение. Оно заключается в том, что кристаллы - твердого раствора концентрации точки М путем взаимодействия с кристаллами - твердого раствора концентрации точки R образуют кристаллы - твердого раствора концентрации точки N. Это превращение можно выразить так:
М + R N .
На горизонтальной линии JFG происходит эвтектическое превращение: жидкий сплав концентрации точки F превращается в механическую смесь – эвтектику (смесь кристаллов - твердого раствора концентрации точки J и кристаллов компонента В):
жF (J + B).
Эвтектические сплавы более легкоплавки, чем все остальные сплавы этой системы.
На горизонтальной линии PSK происходит эвтектоидное превращение: - твердый раствор концентрации точки S превращается в механическую смесь – эвтектоид (смесь кристаллов - твердого раствора концентрации точки Р и кристаллов компонента В):
S (F + В)
В некоторых областях структурный состав будет отличаться от фазового состава:
а) структура доэвтектоидных сплавов (область 4) состоит из кристаллов - твердого раствора и эвтектоида;
б) структура заэвтектоидных сплавов (область 5) состоит из кристаллов компонента ВII и эвтектоида;
в) доэвтектические сплавы состоят из кристаллов - твердого раствора, компонента ВII и эвтектики (область 9), а так же из кристаллов компонента ВII, эвтектоида и эвтектики (область 6);

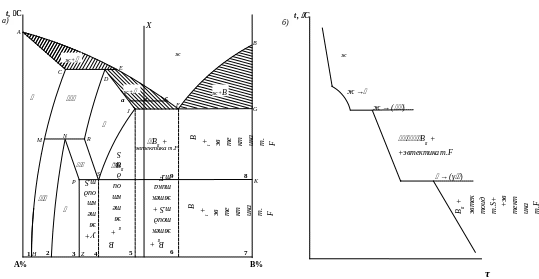
Рис. 7. Диаграмма
состояния системы компонентов А и В:
а) структурный
анализ;
б) кривая охлаждения
сплава Х;
в) схема структуры
сплава Х (при комнатной температуре).
г) структура заэвтектических сплавов (области 7 и 8) состоят из кристаллов компонента В и эвтектики.
В остальных областях диаграммы фазовый и структурный составы совпадают.
Правило фаз.
При рассмотрении процессов превращения в сплавах применяется «правило фаз», которое дает возможность теоретически обосновать направление протекания этих процессов в системе.
Состояние любой системы можно определить следующими величинами: температурой, давлением и концентрацией. Эти величины являются переменными факторами, определяющими состояние равновесия между отдельными фазами. Переменные факторы, которые могут изменяться независимо друг от друга, называются независимыми переменными. Число таких переменных называется числом степеней свободы, или вариантностью системы.
Число степеней свободы зависит от числа компонентов, числа фаз системы, и числа переменных внешних условий (температура и давление). Давление в практических условиях изменяется в небольших пределах, и не оказывает существенного влияния на процессы превращения в сплавах. При использовании правила фаз считают давление постоянным. Уравнение правила фаз имеет вид
С = К – Ф + 1, где
С – число степеней свободы;
К – число компонентов системы;
Ф – число фаз системы;
1 – внешний фактор (температура).
Когда С = 0, это означает, что ни один из факторов, определяющих состояние системы, не может быть изменен без нарушения равновесия. Такое состояние системы возможно только при определенных и единственных значениях внешних условий и состава фаз (например, при образовании эвтектики). Система нонвариантная.
Если С = 1, это означает, что система имеет возможность изменения одного из факторов, определяющих состояние системы, без изменения числа равновесных фаз. Таким фактором может быть температура. Система моновариантная.
Правило отрезков.
Диаграмма состояния системы дает возможность установить не только состав фаз в сплаве любой концентрации, но и определить весовые количества фаз. Для этого применяют так называемое «правило отрезков» или «правило рычага». Это правило говорит о том, что для определения твердой фазы необходимо взять отношение длины плеча, примыкающего к составу жидкой фазы, к длине всего рычага; для определения же количества жидкой фазы берется отношение длины плеча, примыкающего к составу твердой фазы, к длине всего рычага.
Для определения состава и количества фаз в заданном сплаве Х (рис. 7) при заданной температуре (точка «в») нужно провести горизонталь (конóду) через точку «в» до пересечения с линиями ликвидус и солидус диаграммы. Точки пересечения «а» и «с» будут определять составы фаз, а соотношения длин соответствующих отрезков на горизонтали к длине всей коноды позволят определить количество (вес) фаз.
Применяя «правило отрезков», получим выражения:
![]()
![]()
Соотношение между весом твердой фазы и весом жидкой фазы для сплава Х будет определяться пропорцией
![]()
