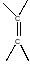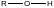- •Условные обозначения
- •Краткие сведения об основных термодинамических величинах
- •Химическое равновесие
- •Принципы определения термодинамических параметров химических реакций
- •Определение термодинамических параметров реакций модификации полимеров с использованием модельных превращений
- •Модификация карбоцепных ненасыщенных полимеров
- •Галобутилкаучуки
- •Гидрированные каучуки
- •Эпоксидированные каучуки
- •Присоединение меркаптанов
- •Модификация насыщенных карбоцепных полимеров
- •Хлорированный полиэтилен
- •Хлорсульфированный полиэтилен
- •Поливиниловый спирт
- •Модификация природных полимеров
- •Тринитроцеллюлоза
- •Триацетат целлюлозы
Эпоксидированные каучуки
Двойные углерод-углеродные связи в непредельных каучуках могут быть окислены до оксирановых фрагменов. Оксираны в соответствии с тривиальной номенклатурой называются эпоксидами. В качестве окисляющих агентов могут выступать различные соединения: гидроперекиси алкилов, надкислоты, пероксосоединения неорганических кислот, диоксиран, перекись водорода и т.д.:
|
+ |
|
|
|
+ |
|
|
|
|||||
|
|
|||||
|
|
|||||
|
|
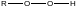
Наибольшее применение в последние годы в качестве окисляющего агента находит перекись водорода. Реакции проводят в присутствии катализаторов, которыми служат обычно гетерополикислоты и четвертичные аммонийные соли. Процессы ведут в водно-органических двухфазных средах. Перекись водорода находится в водной фазе. Роль гетерополикислот в этих процессах заключается в том, что они первоначально взаимодействуя в водной фазе с перекисью водорода образуют пероксосоединения, которые затем переносятся четвертичными аммонийными катионами в органическую фазу. В органической фазе в виде раствора находятся непредельные каучуки. Четвертичные аммонийные соли в этом процессе служат катализаторами межфазного переноса.
Интерес к эпоксидированным каучукам очень велик. В настоящее время изучению методов их получения, характеристике свойств, описанию сфер применения эпоксидированных каучуков посвящено почти 12 000 публикаций. Наибольшее внимание привлекает эпоксидирование полимеров на основе бутадиена, изопрена. В ходе эпоксидирования возможно регулирование количество оксирановых фрагментов в структуре модифицированного полимера. Иногда степень эпокисдирования доводят до 50% от теоретически от возможного.
Оксирановый цикл является сильно напряженным. В нем валентные углы деформированы со 1090 до 600. Раскрытие эпоксидного цикла термодинамически является очень выгодным процессом. При этом выделяется энергия напряжения. Это обстоятельство приводит к тому, что реакции раскрытия эпоксидного кольца протекают с повышенным выделением энергии, и, соответственно, имеют большие отрицательные величины свободных энергий превращений.
Одной из технологий получения «зеленых» шин является их производство с использованием эпоксидированных каучуков и двуокиси кремния, которая используется в различных модификациях. Поверхность двуокиси кремния, содержащая гидроксильные группы, является гидрофильной. Поэтому двуокись кремния плохо совмещается с гидрофобными каучуками. Ситуация коренным образом меняется при использовании эпоксидированных каучуков. Их оксирановые фрагменты способны химически взаимодействовать с поверхностными гидроксильными группами двуокиси кремния. Ниже приведена схема взаимодействия эпоксидированного фрагмента полибутадиенового каучука с поверхностной гидроксильной группой кремнезема:
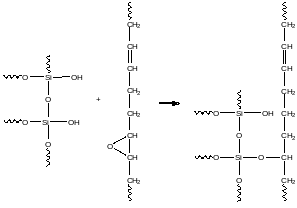
В результате этого взаимодействия возникают химические связи между частицами двуокиси кремния и эпоксидированным каучуком. В ходе этого взаимодействия возникает новый гибридный органо-неорганический материал. В нем неорганический полимер – двуокись кремния, и органический полимер – эпоксидированный каучук, образуют новое химическое соединение, которое не может быть разделено обратно на составные части простыми физическими методами. Двойные связи в этой новой макромолекуле используются для осуществления вулканизации, например, серной. Эти гибридные материалы проявляют уникальные физико-механические свойства. Прогресс в области производства шин нового поколения связан именно с получением указанного типа гибридных материалов.
Эпоксидированные каучуки используются в качестве компонент эпоксидных смол, они применяются как пластификаторы-стабилизаторы в композициях с поливинилхлоридом. Старение поливинилхлорида сопровождается выделением хлористого водорода, который оказывает автокаталитическое действие на дальнейшее развитие его деструкции. Эпоксидные фрагменты эпоксидированного каучука, химически связывая хлористый водород, делают невозможным развитие автокаталитической деструкции:
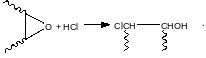
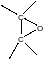
Эпоксидированные каучуки сами используются для дальнейших модификаций. Ниже на примере окиси этилена показаны некоторые типы химических превращений, которые реализованы для модификации эпоксидированных каучуков.
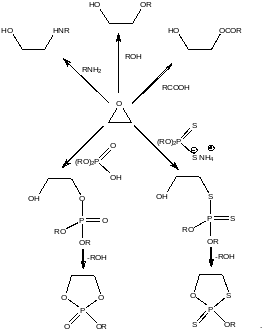
Эпоксидированные каучуки позволили решить проблему включения атомов фосфора в полимерную цепь. Этот элемент придает полимерам свойство самозатухания при их горении. Были сделаны многочисленные попытки получения фосфорсодержащих полимеров методом полимеризации непредельных фосфорсодержащих мономеров, однако они закончились неудачно. Оксирановые фрагменты в эпоксидированном каучуке взаимодействуя с диалкоксифосфорными кислотами на первой стадии образуют полные эфиры фосфорной кислоты, которые содержат в своей структуре спиртовую гидроксильную группу. На второй стадии этой реакции происходит внутримолекулярная переэтерификация, которая приводит к диоксафосфолановому циклу. Реакция с аммонийными солями диалкоксидитиофосфорных кислот протекает аналогично, при этом в структуре каучука появляются дитиофосфолановые фрагменты.
В настоящее время полными термодинамическими данными охарактеризовано ограниченное количество эпоксидов. Это сужает возможность проведения широко анализа процессов эпоксидирования модельных непредельных соединений. Тем не менее основные представления о термодинамике этих процессов можно получить на основе анализа процесса эпоксидирования этилена и пропилена перекисью водорода.
В таблице 17 приведены термодинамические параметры образования этилена, пропилена, их окисей, а также перекиси водорода и воды.
В таблицах 18 и 19 приведены термодинамические параметры реакций эпоксидирования этилена и пропилена.
Таблица 17.
Термодинамические параметры образования этилена, пропилена, их окисей, перекиси водорода и воды в состоянии идеального газа
Соединение |
|
|
|
|||||
298К |
400К |
298К |
400К |
298К |
400К |
|||
Этилен |
52.45 |
55.87 |
12.50 |
11.77 |
-54.64 |
-53.52 |
||
Пропилен |
63.80 |
68.83 |
4.88 |
3.76 |
14.99 |
18.62 |
||
Окись этилена |
57.94 |
61.82 |
-12.58 |
-13.51 |
-3.13 |
0.25 |
||
Окись пропилена |
68.53 |
74.31 |
-22.17 |
-23.39 |
-6.16 |
-0.50 |
||
Перекись водорода |
55.66 |
58.88 |
-32.53 |
-32.84 |
-25.21 |
-22.66 |
||
Вода |
45.1 |
47.49 |
-57.80 |
-58.04 |
-54.64 |
-53.52 |
||
Таблица 18.
Термодинамические параметры реакции:
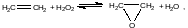
в газовой фазе
Параметр |
298К |
400К |
|
-48.84 |
-48.30 |
|
-50.35 |
-50.48 |
|
-5.07 |
-5.44 |
Kc |
8.871035 |
3.061026 |
Таблица 18.
Термодинамические параметры реакции:

в газовой фазе
Параметр |
298К |
400К |
|
-50.58 |
-49.98 |
|
-52.50 |
-52.33 |
|
-5.83 |
-5.91 |
Kc |
1.691037 |
2.551027 |
Из данных таблиц 17 и 18 видно, что эпоксидирование непредельных соединений сопровождается очень большим выделением тепла. Величины энтропий реакций незначительны и близки к нулю. Это обусловлено тем, что в ходе реакции не происходит потеря ни поступательных, ни вращательных степеней свободы движения. Величины свободных энергий практически полностью определяются энтальпийным членом. Для данных реакций характерны большие отрицательные величины свободных энергий превращений, что приводит к очень большим константам равновесия. Хотя с повышением температуры константы равновесия убывают, тем не менее, их значения обеспечивают практически необратимое протекание взаимодействий даже при повышенных температурах.
Для характеристики термодинамических закономерностей реакций раскрытия эпоксидных колец рассмотрим модельные реакции гидрирования и гидратации окиси этилена. Обе эти реакции также используются для химической модификации эпоксидированных каучуков.
В таблице 19 приведены термодинамические параметры образования реагентов и продуктов упомянутых реакций.
Таблица 19.
Термодинамические параметры образования окиси этилена, этилового спирта, гликоля, водорода и воды в газовой фазе в состоянии идеального газа
Соединение |
|
|
|
|||||
298К |
400К |
298К |
400К |
298К |
400К |
|||
Окись этилена |
57.94 |
61.82 |
-12.58 |
-13.51 |
-3.13 |
0.25 |
||
Этиловый спирт |
67.54 |
72.67 |
-56.12 |
-57.32 |
-40.22 |
-34.60 |
||
Гликоль |
77.33 |
84.71 |
-93.05 |
-93.83 |
-72.77 |
-65.71 |
||
Водород |
31.21 |
33.25 |
0 |
0 |
0 |
0 |
||
Вода |
45.10 |
47.49 |
-57.80 |
-58.04 |
-54.64 |
-53.52 |
||
В таблице 20 приведены термодинамические параметры реакции гидрирования окиси этилена, а в таблице 21 – реакции гидратации окиси этилена.
Таблица 20.
Термодинамические параметры реакции гидрирования окиси этилена:
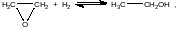
в газовой фазе
Параметр |
298К |
400К |
|
-37.09 |
-34.85 |
|
-43.54 |
-43.81 |
|
-21.61 |
-22.40 |
Kc |
1.601027 |
1.101019 |
Таблица 21. Термодинамические параметры реакции гидратации окиси этилена:

в газовой фазе
Параметр |
298К |
400К |
|
-15.00 |
-12.44 |
|
-22.67 |
-22.28 |
|
-25.71 |
-24.60 |
Kc |
1.001011 |
6.27106 |
Гидрирование окиси этилена (таблица 20) протекает с большим выделением тепла. Энтропии превращения, как это и следовало ожидать, являются большими отрицательными величинами. Это обусловлено тем, что в ходе взаимодействия теряются три поступательные и две вращательные степени свободы движения. Высокая экзотермичность обсуждаемой реакции приводит к тому, что стандартные свободные энергии гидрирования окиси этилена тоже характеризуются большими отрицательными числами. Это приводит к большим константам равновесия в реакции гидрирования в рассмотренном интервале температур. Гидрирование окиси этилена является практически необратимой реакцией
Гидратация окиси этилена (таблица 21), в отличие от гидрирования, протекает с существенно меньшим тепловым эффектом, однако эта реакция тоже имеет большие отрицательные величины энтропии превращения. Поэтому процесс гидратации, в отличие от гидрирования, характеризуется менее отрицательными величинами свободной энергии реакции. Это приводит к тому, реакция гидратации по сравнению с процессом гидрирования имеет меньшие величины констант равновесия. При высоких температурах выраженность обратимости реакции гидратации существенно возрастает.