
- •Условные обозначения
- •Краткие сведения об основных термодинамических величинах
- •Химическое равновесие
- •Принципы определения термодинамических параметров химических реакций
- •Определение термодинамических параметров реакций модификации полимеров с использованием модельных превращений
- •Модификация карбоцепных ненасыщенных полимеров
- •Галобутилкаучуки
- •Гидрированные каучуки
- •Эпоксидированные каучуки
- •Присоединение меркаптанов
- •Модификация насыщенных карбоцепных полимеров
- •Хлорированный полиэтилен
- •Хлорсульфированный полиэтилен
- •Поливиниловый спирт
- •Модификация природных полимеров
- •Тринитроцеллюлоза
- •Триацетат целлюлозы
Триацетат целлюлозы
Очень широко распространенным методом модификации целлюлозы является ее ацетилирование. При взаимодействии гидроксильных групп глюкопиранозных циклов целлюлозы с такими соединениями, как кетен, ацетилхлорид, уксусный ангидрид, образуются сложные эфиры уксусной кислоты. Наибольшее применение в качестве ацилирующего агента находит уксусный ангидрид. В современных технологиях ацилирование проводят без применения растворителя. Ацетилирование целлюлозы ведут газообразным уксусным ангидридом. Схема превращения описывается уравнением:
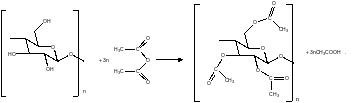
Ацетаты целлюлозы очень широко применяют в производстве ацетатных волокон, пленок различного назначения, этролов, лаков, мембран. Мировое производство ацетатов целлюлозы составляет около 600 тыс.тонн в год.
В ходе ацилирования элементарных звеньев целлюлозы в реакцию вступают две вторичные спиртовые группы и одна первичная. Моделями этих реакций могут служить взаимодействия этилового и изопропилового спиртов с уксусным ангидридом:
(СН3СО)2О + СН3СН2ОН → СН3СООСН2СН3 + СН3СООН ,
(СН3СО)2О + (СН3)СНОН → СН3СООСН(СН3)2 + СН3СООН .
В таблице 39 приведены термодинамические параметры образования участников данных превращений.
Таблица 39.
Термодинамические параметры образования уксусного ангидрида, этанола, изопропанола, их эфиров и уксусной кислоты в состоянии идеального газа
Соединение |
|
|
|
|||||
298К |
400К |
298К |
400К |
298К |
400К |
|||
Уксусный ангидрид |
93.20 |
101.2 |
-137.6 |
-139.0 |
-113.9 |
-105.6 |
||
Уксусная кислота |
67.52 |
72.72 |
-103.9 |
-104.8 |
-90.03 |
-85.14 |
||
Этанол |
67.54 |
72.67 |
-56.12 |
-57.32 |
-40.22 |
-34.60 |
||
Изопропанол |
74.07 |
81.09 |
-65.15 |
-66.65 |
-41.49 |
-33.17 |
||
Этилацетат |
86.70 |
95.47 |
-105.9 |
-107.36 |
-78.25 |
-68.58 |
||
Изопропилацетат |
96.94 |
- |
-115.1 |
- |
- |
- |
||
В таблицах 40 и 41 приведены термодинамические параметры рассматриваемых реакций.
Таблица 40.
Термодинамические параметры реакции ацилирования этанола:
(СН3СО)2О + СН3СН2ОН СН3СООСН2СН3 + СН3СООН ,
в газовой фазе
Параметр |
298К |
400К |
|
-14.13 |
-13.51 |
|
-16.07 |
-15.78 |
|
-6.62 |
-5.69 |
Kр |
2.31·1010 |
2.41·107 |
Таблица 41. Термодинамические параметры реакции ацилирования изопропанола:
(СН3СО)2О + (СН3)СНОН СН3СООСН(СН3)2 + СН3СООН
в газовой фазе при 298 К
Параметр |
Величина |
|
-15.46 |
|
-16.30 |
|
-2.81 |
Kр |
2.18·1011 |
Из приведенных в таблицах 40 и 41 данных следует, что обе рассматриваемые реакции протекают со значительным выделением тепла. Энтропии реакций представляют собой малые величины. Основной вклад в свободные энергии реакций вносит энтальпийный член. Константы равновесия сохраняются большими даже при повышенных температурах, что обеспечивает практическую необратимость данных превращений.
