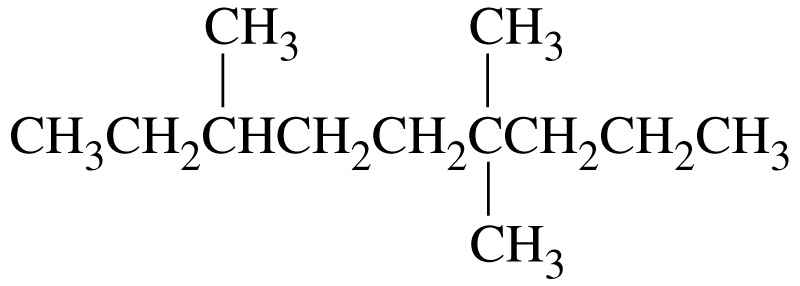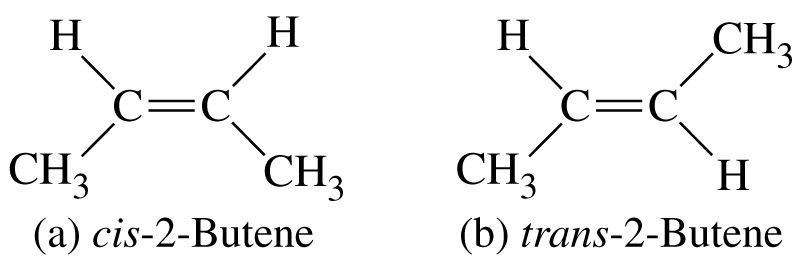- •Ізомеризація алканів:
- •Електроліз по Кольбе:
- •Циклоалкани
- •Механізм реакції електрофільного приєднання
- •Зсув подвійного зв’язку:
- •Алкадієни
- •Піроліз нафтопродуктів або горючих газів:
- •Взаємодія дигалогенопохідних алканів зі спиртовим розчином лугу.
- •Взаємодія солей ароматичних кислот і натронного вапна:
- •Багатоядерні арени
- •Правила заміщення в бензеновому ядрі
- •Галогенопохідні вуглеводнів
- •Заміщення Гідрогену вуглеводнів галогеном:
- •Приєднання галогенів і галогенводню до ненасичених вуглеводнів:
- •Заміщення гідроксильної групи спирту атомом галогену:
- •Окремі представники галогенпохідних вуглеводнів
Миколаївський державний коледж економіки та харчових технологій
Циклова комісія природничо-наукових дисциплін

Органічна хімія
Опорні лекції
Вуглеводні та їх галогенопохідні
|
|
|
|
Миколаїв-2011
Вуглеводні – клас органічних речовин, молекули яких мають лише атоми двох хімічних елементів – Карбону і Гідрогену.

Алкани
Алкани (насичені вуглеводні, парафіни) – сполуки Карбону і Гідрогену, в молекулах яких всі валентності насичені атомами Гідрогену.
Загальна формула гомологічного ряду алканів: СnH2n+2
Формула |
Напівструктурна формула н-алкану |
Назва н-алкану |
Формула радикалу |
Назва радикалу |
СН4 |
СН4 |
метан |
‑СН3 |
метил |
С2Н6 |
СН3 – СН3 |
етан |
‑С2Н5 |
етил |
С3Н8 |
СН3 – СН2 ‑ СН3 |
пропан |
‑ С3Н7 |
пропіл |
С4Н10 |
СН3 – СН2 ‑ СН2 ‑ СН3 |
бутан |
‑ С4Н9 |
бутил |
С5Н12 |
СН3 – СН2 ‑ СН2 ‑ СН2 ‑ СН3 |
пентан |
‑ С5Н11 |
аміл |
С6Н14 |
СН3 – (СН2)4 ‑ СН3 |
гексан |
‑ С6Н13 |
гексил |
С7Н16 |
СН3 – (СН2)5 ‑ СН3 |
гептан |
‑ С7Н15 |
гептил |
С8Н18 |
СН3 – (СН2)6 ‑ СН3 |
октан |
‑ С8Н17 |
октил |
С9Н20 |
СН3 – (СН2)7 ‑ СН3 |
нонан |
‑ С9Н19 |
ноніл |
С10Н22 |
СН3 – (СН2)8 ‑ СН3 |
декан |
‑ С10Н21 |
децил |
Ізомерія ‑ структурна ізомерія (ізомерія Карбонового ланцюга) – з С4Н10.
Номенклатура ІЮПАК:
Назви всіх алканів закінчуються суфіксом –ан.
В основу назви алкану покладено найменування вуглеводню з самими довгим карбоновим ланцюгом.
Розміщення бокових відгалужень у вигляді радикалів визначається порядковим номером атомів Карбону карбонового ланцюга.
Нумерацію атомів Карбону в головному карбоновому ланцюзі починають з ближнього кінця, де розміщується замісник – радикал.
Положення кожного замісника в ланцюзі позначають арабськими цифрами, а кількість однакових замісників – префіксами (два – ди-, три – три-, чотири – тетра-, п’ять – пента-).
При наявності в молекулі алкану декількох радикалів спочатку називають найбільш прості замісники, потім – складні і, нарешті – вуглеводень.
Цифри, які показують положення радикалів у найбільш довгому карбоновому ланцюзі, відокремлюють одну від одної комами, а від назви радикала – дефісами.
|
|
|
|
|
|
2,2,4 - триметилпентан |
|
|
|
|
4-ізобутил-2-метилгептан |
|
|
|
|
|
|
|
|
|
|
|
Дайте назву вуглеводню! |
УНКаХіТерН рекомендує при визначенні алфавітного порядку позначення бічних відгалужень множинні префікси не враховувати. Зокрема, диметил, триметил розглядаються як такі, що починаються з літери м, а діетил, триетил тощо – як такі, що починаються з літери е.
СН3 – СН ‑ СН – СН2 ‑ СН ‑ СН3 3-етил-2,5-диметилгексан
│ │ │ 2,5-диметил-3-етилгексан (ІЮПАК)
СН3 С2Н5 СН3
Будова алканів
Sp3 – гібридизація, тетраедричне розміщення атомних орбіталей карбону, кут між зв’язками гібридних орбіталей – 109,280. Форма молекули метану – тетраедр, гомологи метану – сполучення тетраедрів. Групи СН3 можуть обертатися відносно зв’язку С – С, утворюючи різні геометричні форми ‑ конформації.
Фізичні властивості
Перші чотири представники гомологічного ряду метану – гази, від С5Н12 до С15Н32 – рідини, починаючи з С16Н34 – тверді речовини. Із зростанням кількості атомів Карбону в молекулі нормальних алканів поступово зростають температури плавлення і кипіння. Температура кипіння вуглеводнів з розгалуженим ланцюгом нижча, ніж температура кипіння їх ізомерів з нормальним ланцюгом. Метан та етан не мають запаху, пентан і гексан мають запах бензину і керосину, вищі алкани запаху не мають. Алкани легші за воду, практично не розчинні в ній (відсутні водневі зв’язки). Добре розчиняються в органічних розчинниках, а рідкі алкани є добрими розчинниками.
Хімічні властивості
Для алканів характерна мала реакційна здатність, що пояснюється сполученням атомів С ‑ С, С – Н міцними σ - зв’язками (Езв. = 376,2 кДж/моль).
Основні реакції – реакції заміщення: нітрування, хлорування, сульфування, крекінг і горіння. Зв’язки С ‑ С, С – Н є мало полярними, тому характерні реакції, що проходять за радикальним механізмом і супроводжуються гомолітичним розривом зв’язку. Радикальні реакції алканів ініціюють радикали, пероксиди, УФ-випромінювання, нагрівання.
Залежно від характеру розриву зв’язків у насичених вуглеводнях розрізняють два типи хімічних реакцій:
І. Реакції заміщення водню (з розривом С – Н зв’язку):
реакція радикального галогенування (Ж-Б. Дюма, 1834), реакція металепсії.
Умови: сонячне світло, в темряві при 250 – 4000С або при наявності каталізаторів (СuCІ2, SnCI2). Утворюється суміш галогенопохідних алканів (кожний з продуктів можна виділити). Легше всього проходить заміщення атому Гідрогену при третинному атомі Карбону.
За реакційною здатністю галогени розміщуються у такий ряд: F>CI>Br (Йод не вступає у дану реакцію).
1 стадія: СН4 + СІ2 → СН3СІ + НСІ хлорметан
2 стадія: СН3СІ + СІ2 → СН2СІ2 + НСІ дихлорметан
3 стадія: СН2СІ2 + СІ2 → СНСІ3 + НСІ трихлометан
4 стадія: СНСІ3 + СІ2 → ССІ4 + НСІ тетрахлорметан
реакція нітрування (реакція Коновалова, 1889) – реакція заміщення Гідрогену на нітрогрупу.
Умови:13% НNO3, t = 130 – 1400C, Р= 15 – 105 Па. У промисловому масштабі нітрування алканів проводять у газовій фазі при 150 – 1700С оксидом нітрогену (ІV) або парами нітратної кислоти.
СН4 + НО – NO2 → CН3 – NO2 + Н2О
нітрометан
*реакція сульфування (для алканів з С8 >), відбувається при слабкому нагріванні, димляча сульфатна кислота:
С8Н18 + НО – SO3H → С8Н17 SO3H + H2O
сульфооктан
*реакція сульфохлорування ‑ дія на алкани С8 – С20 сумішшю SO2 та СІ2. Каталізатори – пероксиди або УФ-випромінювання.
Реакцію використовують для одержання СМЗ (детергентів).
С12Н26 + SO2 + CI2 → С12Н25 ‑ SO2CI + HCI
дидекансульфохлорид
С12Н25 ‑ SO2CI + NaOH → С12Н25 ‑ SO2 Na + H2О + HCI
дидекансульфонат натрію
ІІ. Реакції розщеплення:
дегідрування вуглеводнів (відщеплення водню), утворюється алкен.
Умови: нагрівання (t = 4600C), каталізатор Сr2О3.
СН3 – СН2 ‑ СН2 ‑ СН3 → СН2 = СН ‑ СН2 ‑ СН3 + Н2
бутан бутен-1
реакція розщеплення за рахунок розриву С – С – зв’язку (крекінг), відбувається під дією високих температур, утворюються алкани та алкени з меншим числом атомів Карбону.
С4Н10 → СН4 + С3Н6 або С4Н10 → С2Н6 + С2Н4
реакція розкладання (піроліз), відбувається при t > 10000С, утворюються вуглець і водень. Всі вуглеводні розкладаються при нагріванні, але при різній температурі.
С2Н6 → 2С + 3Н2
Піроліз метану (утворюється ацетилен): 2СН4 → С2Н2 + 2Н2
ІІІ. Реакції окислення:
При кімнатній температурі алкани стійкі до дії окислювачів тому забарвлення перманганату калію при додаванні алканів не змінюється.
Алкани згорають на повітрі з виділенням значної кількості теплоти. На реакції горіння ґрунтується застосування алканів як палива.
СН4 + 2О2 → СО2 + 2Н2О
При наявності каталізаторів (солі Мn2+) та нагріванні алкани можна окислити до карбонових кислот:
СН3 – (СН2)8 ‑ СН3 + [О] → СН3 – СН2 ‑ СООН + СН3 – (СН2)5 – СООН
декан пропанова кислота гептанова кислота
Методи одержання алканів
Відновлення галогенопохідних. Відновники: Н2, НІ. Каталізатор: Рt, Pd. Можна одержати вуглеводні з тим же числом атомів Карбону, що у вихідній сполуці.
СН3СІ + Н2 → СН4 + НСІ
СН3І + НІ → СН4 + НІ
Реакція Вюрца – дія металічного натрію на галогенопохідні вуглеводнів. При взаємодії двох різних галогенопохідних утворюється суміш вуглеводнів, яка може бути розділена перегонкою.
СН3І + 2 Na + СН3І → С2Н6 + 2 NaІ
Гідрування ненасичених вуглеводнів. Умови: t = 150 – 3000C, каталізатор ‑ Рt, Pd, Nі.
СН2=СН2 + Н2 → С2Н6
Оксосинтез – одержання насичених вуглеводнів з СО2 та Н2. Залежно від обраного каталізатора та умов реакції одержують суміш вуглеводнів різного складу і будови.
4 СО + 3Н2 → С2Н6 + 2СО2
Ізомеризація алканів:
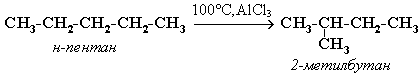
Прямий метод одержання метану – у вольтовій дузі між вугільними електродами у присутності водню утворюється метан. Умови: t = 5000C, каталізатор ‑ Nі.
С + 2Н2 → СН4
Електроліз по Кольбе:
2RCOONa + 2H2О → R – R + 2 СО2 (на аноді) + Н2 + 2NaОН (на катоді)
Розкладання карбіду алюмінію водою (одержання метану):
АІ4С3 + 12Н2О → 3 СН4 + 4АІ(ОН)3↓
Сплавляння ацетату натрію з лугом (натронним вапном – суміш NaOH i Ca(OH)2) – реакція Дюма:
СН3СООNa + NaOH → СН4 + Na2СО3
Окремі представники
Метан СН4 – головний компонент природних і попутних газів, утворюється в результаті метанового бродіння різних органічних речовин на дні природних водойм (болотний газ). Крім того, утворюється в передшлунках жуйних і кишках тварин при бродінні рослинного корму. Складає третину загальної газової маси передшлунків. Цінна сировина для одержання метанолу, формальдегіду, хлороформу, пластмас.
н-Бутан С4Н10 та ізобутан є сировиною для одержання багатьох органічних сполук: бутадієну-1,3 (вихідної речовини для добування синтетичного бутадієнового каучуку), оцтової кислоти.
Ізооктан С8Н18 – 2,2,4-триметилпентан. Є компонентом пального (авіаційного бензину). За кількісним відношенням якої до н-гептану в пальному визначають якість останнього за допомогою октанового числа.
ВМС алкани – складові хімічні компоненти вазелінового масла (до С16), вазеліну (С12 – С25). Парафін (С19 – С36) використовують у парафінотерапії і для виготовлення побутових свічок.
Циклоалкани
Циклоалкани (поліметиленові вуглеводні, циклопарафіни, насичені аліциклічні вуглеводні, поліметилени, циклани) – вуглеводні кільчастої будови, цикли молекул яких побудовані лише з атомів Карбону, зв’язаних між собою простими зв’язками.
Загальна формула гомологічного ряду циклоалканів: СnH2n
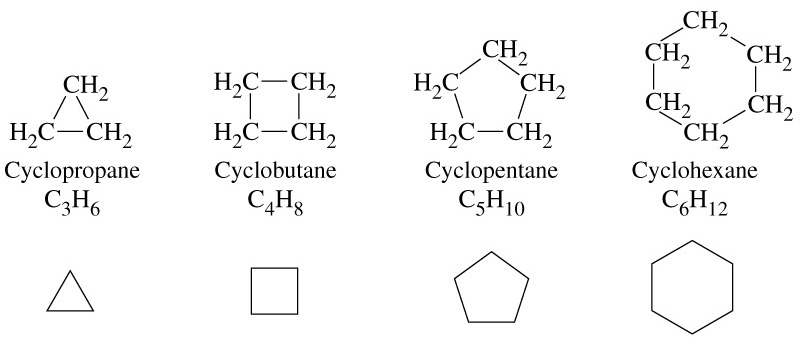
циклопропан циклобутан циклопентан циклогексан
Номенклатура
Назва утворюється від відповідного за кількістю атомів Карбону алкану з додаванням префікса цикло-. Якщо в молекулі є замісник і вигляді радикала, то цифрою вказують місце його розміщення і назву. При нумерації атомів Карбону кільця спочатку нумерують і називають найбільш прості радикали, а потім більш складні.
Ізомерія: структурна і просторова.
ізомерія циклів для циклоалканів з однаковою молекулярною формулою:
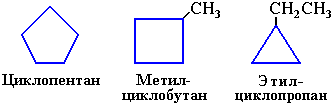
ізомерія радикалів, сполучених з циклами:
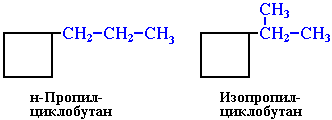
н-пропілциклобутан ізопропілциклобутан
ізомерія радикалів у циклі (положення замісників в циклі):
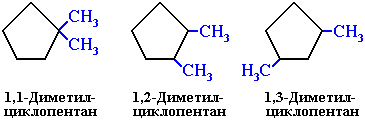
міжкласова ізомерія з алкенами:
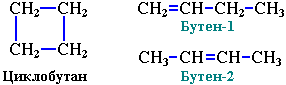
просторова ізомерія замісників (цис- або транс-положення) відносно площини кільця:

оптична ізомерія у деяких дизаміщених циклах: транс-1,2-диметилциклопропан може існувати у вигляді двох оптичних ізомерів:
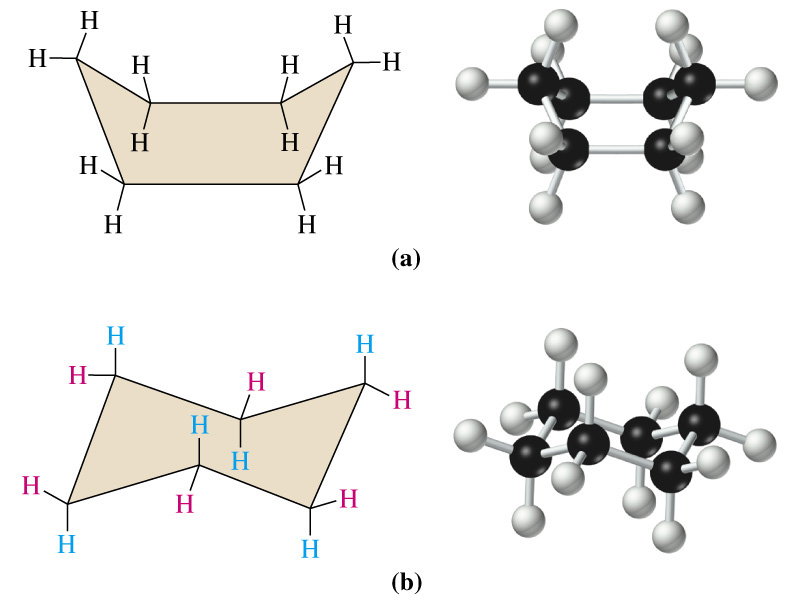
поворотна ізомерія виникає внаслідок повороту за σ-зв’язками і спричиняє виникнення конформацій з різною енергією (з найменшою енергією – найбільш стійкі). У циклогексані найбільш стійкою є конформація «крісла» (b).
Фізичні властивості
Циклопропан і циклобутан – гази, циклопентан і циклогексан – рідини, вищі циклопарафіни – тверді речовини. Циклоалкани плавляться і киплять при більш високих температурах, ніж відповідні їм алкани, що обумовлено більш щільною упаковкою і більшими міжмолекулярними силами. Циклоалкани нерозчинні у воді і добре розчиняються в органічних розчинниках.
Будова та хімічні властивості циклоалканів
Sp3 – гібридизація АО Карбону, тетраедричне розміщення АО.
Атоми карбону сполучені між собою за допомогою σ-зв’язків. Перекривання електронних хмар відбувається в області, зсунутій ззовні за рахунок їх взаємного відштовхування, що добавляє зв’язкам ненасиченого характеру внаслідок розміщення максимальної густини за межами С – С-зв’язку. Валентні кути в циклопропані і циклобутані значно менші за нормальний тетраедричний кут (109,280).
Найбільша зігнутість зв’язків спостерігається у циклопропану, середня – у циклобутану, найменша – у циклопентану та циклогексану. Це спричиняє підвищення напруженості в трьох-та чотирьохчленних циклах та їх розкриття під дією реагентів (реакції приєднання до циклопропану, циклобутану та їх похідних).
Для малих циклів (С3 – С4) характерні реакції приєднання.
приєднання водню (гідрування), цикли розмикаються, утворюються відповідні алкани:

приєднання галогенів і галогенводнів, супроводжується розмиканням циклу, утворюються дигалогенопохідні алканів (приєднання галогенів), або моногалогенопохідні алканів (приєднання галоген водню):
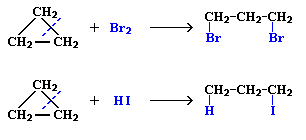
Для інших циклів (С5 і вище) характерні реакції заміщення.
хлорування циклогексану відбувається за ланцюговим механізмом (аналогічно реакціям заміщення в алканах):

Реакції дегідрування циклогексану та його похідних:


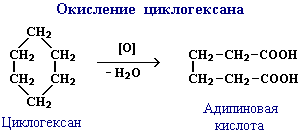
Реакція окислення циклогексану (з утворенням адипінової кислоти):
Методи одержання циклоалканів
Циклоалкани містяться у нафті деяких копалин (природна назва – нафтени). При переробці нафти виділяють в основному Циклоалкани С5 – С7.
Дія активних металів на дигалогенопохідні алканів (внутрішньо молекулярна реакція Вюрца) призводить до утворення циклоалканів. Використовують металічний натрій або порошковий цинк.
![]()
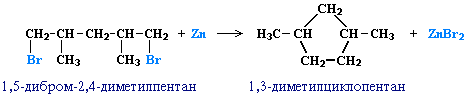
Дегідроциклізація алканів – важливий промисловий метод одержання циклоалканів С5 і С6:

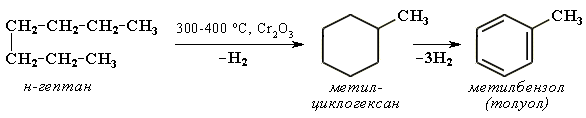
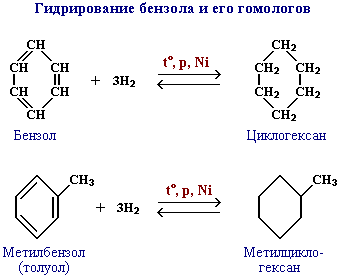
Гідрування бензолу (бензену) та його гомологів, які є продуктами переробки нафти:
Алкени
Алкени (етиленові вуглеводні, олефіни) – ненасичені вуглеводні, в молекулах яких між двома атомами Карбону є один подвійний зв'язок.
![]()
етен 1-бутен
Загальна формула гомологічного ряду алкенів: СnH2n
Номенклатура алкенів
За основу номенклатури береться назва алкану, що має найбільш довгий карбоновий ланцюг, в якому суфікс -ан замінюється на суфікс -ен, а цифрою, що стоїть перед назвою алкену вказується місце розміщення подвійного зв’язку в карбоновому ланцюзі. Нумерацію карбонового ланцюга починають з того боку, до якого ближче розміщений подвійний зв’язок. У назві алкену перед коренем зазначають бічні замісники (радикали), перед якими ставлять цифру, що вказує їх положення.
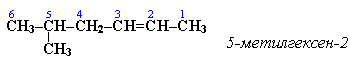 5-метил-2-гексен
5-метил-2-гексен
Найбільш часто використовують одновалентні радикали алкенів:
![]()
‑ вініл ‑ аліл
Будова алкенів
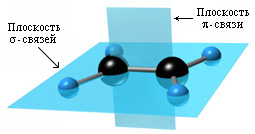
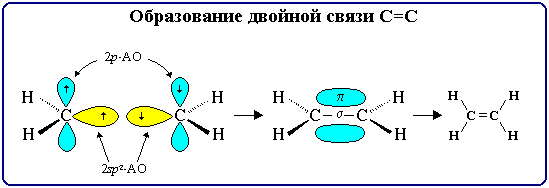
Типовим представником алкенів є етилен: СН2 = СН2. У кожного ненасиченого атома Карбону відбувається Sр2–гібридизація, одна р-орбіталь (гантель) залишається негібридизованою, що забезпечує максимальну віддаленість гібридизованих електронних орбіталей, осі яких утворюють кути 1200.
Отже, молекула етилену має п’ять σ-зв’язків, розміщених в одній площині під кутом 1200. р-електрони утворюють π-зв’язок між двома р-орбіталями має вигляд об’ємної вісімки, перпендикулярної площині розміщення σ-зв’язків.
Ізомерія алкенів: структурна і геометрична.
ізомерія розміщення подвійного зв’язку:
![]()
ізомерія карбонового ланцюга:
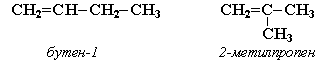
ізомерія гомологічних рядів (алкени ізомерні циклоалканам).

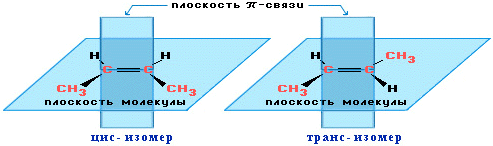
геометрична ізомерія (цис- і транс- ізомерія) обумовлена неоднаковим розміщенням замісників по відношенню до площини подвійного зв’язку:
|
|
цис-2-бутен транс-2-бутен |
Фізичні властивості
У етиленових вуглеводнів фізичні властивості поступово змінюються із зростанням кількості атомів Карбону. Перші три представники гомологічного ряду алкенів – гази, С5Н10 – С17Н34 ‑ рідини, С18Н36 і вище – тверді речовини. Алкени погано розчиняються у воді, добре – в органічних розчинниках. Температури кипіння і плавлення алкенів нормальної будови збільшуються із збільшенням молекулярної маси. Ізомери киплять при більш низьких температурах, ніж відповідні алкени з нормальною будовою карбонового ланцюга.
Етилен і пропен горять кіптявим полум’ям, з повітрям утворюють вибухову суміш.
Хімічні властивості
Алкени виявляють високу реакційну здатність, що зумовлена наявністю в їх молекулах подвійного зв’язку. Алкени здатні вступати в реакції електрофільного приєднання за рахунок розриву π-зв’язку. Приєднання відбувається за гетеролітичним типом, супроводжується утворенням іонів через проміжний π-комплекс.