
- •4. Термодинамічні властивості реальних газів і водяної пари
- •4.1 Рівняння стану реальних газів
- •4.2 Водяна пара та її характеристики
- •4.3 Три стадії отримання перегрітої пари
- •4.3.1. Перша стадія - процес підігріву води до температури насичення
- •4.3.2. Друга стадія - процес пароутворення
- •7.3.3 Третя стадія - перегрів пари
- •4.4. Використання „h-s” діаграми для процесів з водяною парою
4.3 Три стадії отримання перегрітої пари
При аналізі особливостей трьох стадій отримання перегрітої пари необхідно:
визначити параметри початкового і кінцевого станів речовини;
розрахувати зміни питомих калоричних параметрів
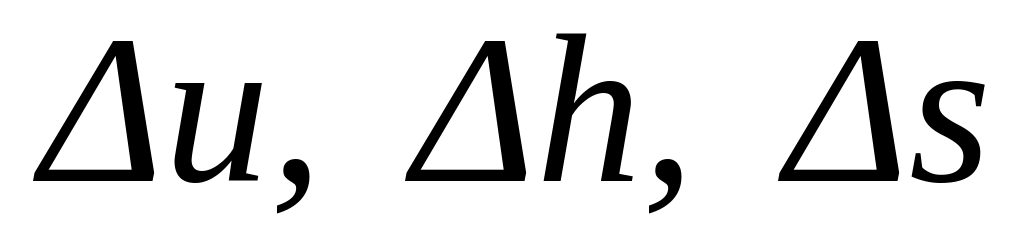 ;
;визначити питому кількість теплоти Δq, яку на кожному етапі на кожному етапі отримує пара.
Слід мати на увазі,
що для реального газу
![]() ,
оскільки його питома внутрішня енергія
залежить не лише від температури, але
й від об’єму.
,
оскільки його питома внутрішня енергія
залежить не лише від температури, але
й від об’єму.
Використовуючи рівняння першого закону термодинаміки для ізобарного процесу, зміни питомих внутрішньої енергії Δu і ентальпії Δh в процесі отримання водяної пари можна визначити за формулами
![]() (5)
(5)
![]() →
→
![]() (6)
(6)
Зміну питомої ентропії при переході від стану 1 до 2 розраховують за виразом
![]() (7)
(7)
У виразі (7) мається на увазі, що початковий стан 1 відповідає холодній воді, а кінцевий 2 – перегрітій парі.
4.3.1. Перша стадія - процес підігріву води до температури насичення
 За
початкову температуру води, яка подається
у котлоагрегат, при довільному тиску,
приймаємо tа
= 0 ºС.
Тоді лінія АА1
на рис. 7.4а відповідає станам холодної
рідини
при різних тисках і при температурі 0
ºС (ізотерма
холодної рідини).
Питомий об’єм води при цій температурі
За
початкову температуру води, яка подається
у котлоагрегат, при довільному тиску,
приймаємо tа
= 0 ºС.
Тоді лінія АА1
на рис. 7.4а відповідає станам холодної
рідини
при різних тисках і при температурі 0
ºС (ізотерма
холодної рідини).
Питомий об’єм води при цій температурі
![]() м3/кг.
Через незначну стискуваність води лінія
АА1
майже вертикальна. Лівіше від неї є зона
рівонаодитьав
такодамиа вняння стану формулюються у
статистичній
фізиці.
м3/кг.
Через незначну стискуваність води лінія
АА1
майже вертикальна. Лівіше від неї є зона
рівонаодитьав
такодамиа вняння стану формулюються у
статистичній
фізиці.
Початком відліку u = 0, h = 0, s = 0 для води прийнято вважати потрійну точку, в якій речовина може одночасно бути у твердому, рідкому і газовому станах (точка А на рис. 7.4а). Параметри стану у потрійній точці для води такі:
рА = 0,00061 МПа, ТА = 273,16 К, vА = 0,001 м3/кг.
Процес пароутворення при тиску рА = 0,00061 МПа показаний на діаграмі 7.4б ізобарою (ізотермою) АВ.
Нехтуючи впливом тиску на зміну об’єму води, приймають для всіх станів на лінії АА1 : v0 = 0,001 м3/кг, u0 = 0, h0 = 0, s0 = 0 .
Кінцевий стан води на стадії підігріву (точка b) визначається досягненням при заданому тиску рн температури насичення tн = f(pн). Ця залежність дається у таблицях, або інтерполяційними формулами. Стани киплячої води при різних тисках відповідають граничній кривій рідини АК, яка відображає залежність питомих об’ємів киплячої води v' від тиску. На граничній кривій рідини х = 0.
Параметри киплячої рідини позначаються відповідними буквами з штрихами (v', u', h', s', і т. д.) і подані у таблицях в залежності від тиску рн або температури tн. Питома кількість теплоти, яка необхідна для реалізації першої стадії отримання перегрітої пари, називається питомою теплотою рідини, за (7.6)
![]() (7.8)
(7.8)
або, врахувавши, що h0 = 0, і використавши середню теплоємність cр = ср mр,,
![]() (7.9)
(7.9)
Зміна питомої внутрішньої енергії при підігріві води за (7.5)
![]()
Зміна питомої ентропії води на ділянці ab
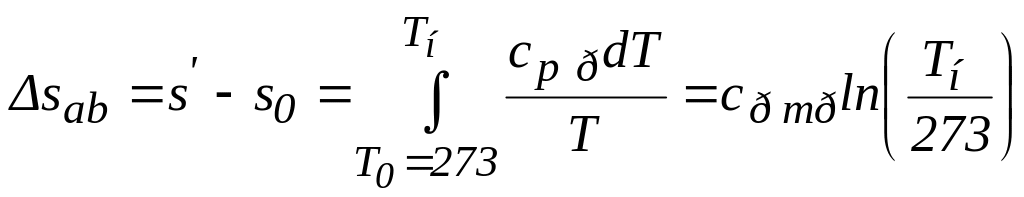 ,
(7.10)
,
(7.10)
тобто на „T-s” діаграмі, див. рис.7.4б, ізобарний процес зміни стану води зображається логарифмічною кривою ab. Оскільки питома ентропія води при 0 ºС умовно рівна нулю, точка а на осі ординат буде знаходитися на 273 ºС вище від абсолютного нуля.
Реальні ізобари підігріву води на „T-s” діаграмі мають складніший вигляд і розташовуються лівіше граничної кривої х = 0. Однак для спрощення аналізу будемо вважати їх суміщеними з кривою х = 0, що мало вплине на точність розрахунку. В цьому випадку ізобара води ркр проходить по лінії АК, а потім (після критичної точки К ) переходить в ізобару перегрітої пари.
