
- •Студентами заочної форми навчання, напряму підготовки
- •6.050503 “Машинобудування”
- •1. Теоретична частина
- •1. 1. Рівняння стану ідеального газу
- •1.2. Газові суміші
- •1.3. Перший закон термодинаміки
- •1.4. Теплоємність газів. Кількість теплоти, що надається газу
- •Можна також записати .
- •Якщо ввести позначення , то формула (12) запишеться як
- •1.5. Термодинамічні процеси
- •Політропний процес - це будь-який процес, який можна описати рівнянням
- •1.6. Витікання через короткі канали
- •1.7. Розрахунок компресора
- •1.8. Розрахунок циклів двигунів внутрішнього згорання (двз)
- •1.9. Теплопередача
- •Задача 4. 0,5 м3 повітря при тиску р1 і температурі t1 розширюється політропно з показником політропи n до тиску р2. Знайти кінцевий об’єм і кінцеву температуру, роботу розширення і підведену теплоту.
- •3. Приклад розв’язку контрольної роботи Задача 1
- •Задача 2
- •Задача 3
- •Задача 5
- •Задача 6
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Література
1.2. Газові суміші
В технічній практиці часто використовують газові суміші. Зокрема повітря теж є сумішшю газів. Згідно закону Дальтона тиск суміші дорівнює сумі парціальних тисків складових суміші
 ,
(3)
,
(3)
Якщо
маса суміші М, а Мі
– маса і-того газу, то
 - масова частка і-го газу в суміші.
- масова частка і-го газу в суміші.
Якщо із суміші газу видалити всі гази за виключенням одного і стиснути при незмінній температурі газ, що залишився, до тиску р, який мала суміш, то об’єм який буде займати газ називається парціальний об’єм (Vi).
Рівняння стану Мі кг і-того газу суміші, яке написане через його парціальний об’єм Vi має вигляд
 ,
(4)
,
(4)
Vі – об’єм суміші, м3;
Ri – газова стала і-того газу, Дж/(кг·К);
Т – температура суміші, К.
Повний об’єм суміші виражається через парціальні об’єми
V = V1 + …+ Vn . (3a)
Підсумувавши рівняння (4) за всіма компонентами суміші, отримаємо
pV
=
 ,
,
 .
(5)
.
(5)
Rc – питома газова стала суміші газів.
1.3. Перший закон термодинаміки
Перший
закон термодинаміки є частковим випадком
закону збереження енергії і має таке
формування: підведена
до газу теплота
 затрачається на зміну його внутрішньої
енергії
затрачається на зміну його внутрішньої
енергії
 і на виконання роботи
і на виконання роботи
 .
.
 .
(6)
.
(6)
Для процесу 1-2 маємо
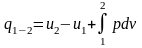 ;
(7)
;
(7)
або, згадавши, що ентальпія i = u + pv, отримуємо
 ;
(8)
;
(8)
 ,
(9)
,
(9)
 -
зміна ентальпії газу.
-
зміна ентальпії газу.
1.4. Теплоємність газів. Кількість теплоти, що надається газу
Кількість теплоти, що підводиться до газу в процесі 1-2 можна визначити за формулою
 ,
(10)
,
(10)
 -
істинна теплоємність газу, індекс х
означає, при яких умовах змінювалась
температура тіла
-
істинна теплоємність газу, індекс х
означає, при яких умовах змінювалась
температура тіла
 .
Якщо замість х стоїть р - то це відбувалось
при постійному тиску, і теплоємність
називається «ізобарна теплоємність»,
а якщо
.
Якщо замість х стоїть р - то це відбувалось
при постійному тиску, і теплоємність
називається «ізобарна теплоємність»,
а якщо
 - то температура газу змінювалась при
постійному об’ємі, і теплоємність
називається «ізохорна теплоємність».
- то температура газу змінювалась при
постійному об’ємі, і теплоємність
називається «ізохорна теплоємність».
Нехай для підвищення температури 1кг газу від t1 до t2 затрачена теплота q1-2, тоді величина
 (11)
(11)
називається
середньою (ставиться індекс
 )
для даного температурного інтервалу
теплоємністю.
)
для даного температурного інтервалу
теплоємністю.
Можна також записати .
В загальному випадку теплоємність газу залежить від температури. При лінійній залежності теплоємності від температури кількість теплоти, яка підводиться до газу визначається за формулою
 .
(12)
.
(12)
Якщо ввести позначення , то формула (12) запишеться як
 .
(13)
.
(13)
1.5. Термодинамічні процеси
Ізохорний процес - це процес, який відбувається при постійному об’ємі (v=const). Для цього процесу маємо
 .
(14)
.
(14)
Ізобарний процес - це процес який відбувається при сталому тиску (р=const). Для цього процесу маємо
 .
(15)
.
(15)
Ізотермічний процес - це процес який відбувається при сталій температурі (t=const). Для цього процесу маємо
 .
(16)
.
(16)
Адіабатний процес - це процес, який відбувається без теплообміну з навколишнім середовищем. Цей процес описується рівнянням
 ,
(17)
,
(17)
де
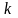 - показника адіабати,
- показника адіабати,
 .
.
