
- •Подготовка к коллоквиуму
- •1.3. Определение точки эквивалентности в титриметрических методах
- •Основные расчетные формулы в титриметрии
- •Приемы титрования
- •Методы титриметрического анализа
- •Титрование сильной кислоты сильной щелочью и наоборот:
- •Титрование слабой кислоты сильной щелочью:
- •Титрование слабого основания сильной кислотой:
Основные расчетные формулы в титриметрии
Так как количество эквивалентов связано с нормальной концентрацией соотношением то из уравнения принципа эквивалентности можно получить уравнение, называемое основным соотношением титриметрического анализа:
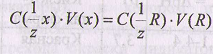
где С( 1/z х) - нормальная концентрация определяемого раствора (концентрация, которую необходимо определить); V(x) объем анализируемого раствора
(известная величина); С(1/z R)- нормальная концентрация титранта (известная величина); V(R) - объем титранта (измеряемая величина).
Следовательно
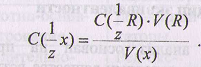
Формула для расчета массы анализируемого вещества:
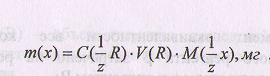 или
или
![]()
Приемы титрования
Прямое титрование основано на непосредственном взаимодействии определяемого вещества х и титранта (R):
![]()
Массу анализируемого вещества находят по формуле
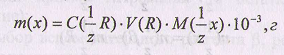
Если титруется часть раствора, то расчет массы вещества ведут по формуле:
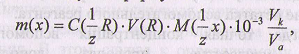
где Vk - объем мерной колбы; VA - объем аликвоты (пипетки).
Титрование по остатку (обратное титрование) проводят, когда невозможно прямое титрование. В этом случае к определяемому веществу добавляют вспомогательный реагент β, взятый в избытке:
![]()
Остаток непрореагировавшего вспомогательного реагента оттитровывают стандартным раствором титранта:
![]()
В момент эквивалентности все количество вспомогательного реагента р затрачено на реакции с определенным веществом х и титрантом R:
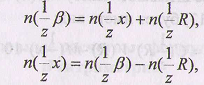
Расчет массы анализируемого веществапроизводят по формуле
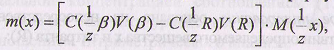
где
![]() -
нормальная
концентрация вспомогательного реагента;
V(β)
- объем вспомогательного реагента,
взятый для определения; V(R)
- объем титранта, пошедший на титрование
остатка вспомогательного реагента.
-
нормальная
концентрация вспомогательного реагента;
V(β)
- объем вспомогательного реагента,
взятый для определения; V(R)
- объем титранта, пошедший на титрование
остатка вспомогательного реагента.
Когда точная концентрация вспомогательного реагента неизвестна, проводят дополнительное титрование, устанавливая соотношение между вспомогательным реагентом, взятым в том же объеме, что и при определении анализируемого образца, и титрантом:
![]()
В этом случае, учитывая соотношение
![]() ,
рассчитывают массу определяемого
вещества х
следующим
образом:
,
рассчитывают массу определяемого
вещества х
следующим
образом:
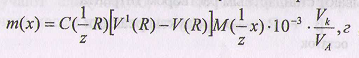
где V1(R) - объем титранта, пошедший на титрование вспомогательного реагента в отсутствие анализируемого вещества.
Титрование заместителя применяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае к определяемому веществу х добавляют вспомогательный реагент β, с которым определяемое вещество образует стехиометрическое количество нового соединения, называемого заместителем у. Вспомогательный реагент выбирают с таким расчетом, чтобы получаемый заместитель было удобно определять прямым титрованием:
![]()
Так как
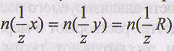 то массу анализируемого вещества
рассчитывают по формуле
то массу анализируемого вещества
рассчитывают по формуле
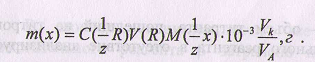
Методы титриметрического анализа
Титриметрический анализ можно проводить двумя методами: методом отдельных навесок и методом пипетирования.
Метод отдельных навесок. На аналитических весах берут 5-6 навесок определяемого вещества А, каждую из которых растворяют в небольшом количестве дистиллированной воды, и полученные растворы титруют раствором титранта. Массу анализируемого вещества для каждой отдельной навески рассчитывают по формуле
![]()
Из среднего арифметического всех найденных значений определяют содержание анализируемого вещества и рассчитывают погрешность.
Метод пипетирования (метод аликвот). Метод пипетирования заключается в том, что на титрование отбирают пипеткой только часть анализируемого раствора Va. Навеску анализируемого вещества растворяют в мерной колбе объемом VK. Массу навески рассчитывают таким образом,
чтобы она была в (VK / Va.) раз больше, чем масса определяемого вещества, необходимая на отдельное титрование.
Следовательно, при расчете массы по результатам титрования
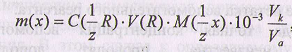
По сравнению с методом отдельных навесок в методе пипетирования существуют дополнительные случайные отклонения, возникающие в результате погрешностей измерения объемов пипетки и мерной колбы, в которой готовят стандартный раствор. Кроме того, ошибка при взвешивании определяемого вещества может привести к неверным результатам за счет систематической погрешности. Однако ввиду большей длительности и трудоемкости определения по методу отдельных навесок на практике чаще используют метод пипетирования.
В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами:
Н+ + ОН- = Н2О, Н3О+ + ОН- = 2Н2О
При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.).
В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH).
В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот,
Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром. В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту.
Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований.
В кислотно-основном методе титрования различают три случая титрования:
