
- •Подготовка к коллоквиуму
- •1.3. Определение точки эквивалентности в титриметрических методах
- •Основные расчетные формулы в титриметрии
- •Приемы титрования
- •Методы титриметрического анализа
- •Титрование сильной кислоты сильной щелочью и наоборот:
- •Титрование слабой кислоты сильной щелочью:
- •Титрование слабого основания сильной кислотой:
1.3. Определение точки эквивалентности в титриметрических методах
Точку эквивалентности в процессе титрования можно определить различными способами.
1) по изменению окраски растворов в случае использования окрашенных веществ (титранта илиопределяемого вещества). Такой способ установления точки эквивалентности называется безиндикаторным.
2) с применением физико-химических методов исследования.
3) с использованием индикаторов.
Индикаторы - это вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. При этом они переходят в другую равновесную форму, изменяя окраску, люминесценцию или образуя осадок. Точка при титровании, в которой наблюдается резкое изменение окраски индикатора и заканчивается титрование, называется конечной точкой титрования (КТТ)
Обычно индикаторы по своей природе идентичны либо определяемому веществу, либо титранту. Действие индикатора основано на смещении равновесия:
![]() ,
,
где X - продукт превращения индикатора, отражающий специфику реакции, в которой он участвует; Ind1, Ind2 - две сопряженные формы индикатора.
Индикатор характеризуют интервалом перехода окраски АрХ и показателем титрования рТ.
Интервал перехода окраски АрХ - это интервал рН (кислотно-основные индикаторы), интервал потенциала (ред-окс индикаторы) либо интервал рМе (металлоиндикаторы), в котором индикатор меняет окраску. АрХ зависит от природы самого индикатора. В интервале перехода окраски индикатора указывают две цифры, при которых отчетливо видна окраска формы Ind1 и формы Ind2
Показатель титрования (рТ) - это величина рН, величина потенциала либо рМе, при достижении которых происходит резкое изменение окраски индикатора и титрование заканчивается (достигается конечная точка титрования).
Для правильного выбора индикатора в различных случаях титрования необходимо знать предел скачка рН на кривой титрования. Для каждого случая титрования пригодны только те индикаторы, показатели титрования которых входят в пределы скачка рН на кривой.

При выборе индикатора интервал перехода окраски индикатора или хотя бы его часть должны совпадать со скачком на кривой титрования изучаемой системы. Оптимальный случай - когда показатель титрования индикатора рТ совпадает со значением изучаемого свойства в точке эквивалентности. Чаще всего изменение цвета индикатора происходит не точно в точке эквивалентности. Это вызывает систематическую (индикаторную) погрешность.
Способы приготовления растворов с точно известной концентрацией -титрантов
Существуют следующие способы приготовления растворов с точно известной концентрацией:
1) растворение точно взвешенной массы чистого реагента и разбавление до точно известного объема;
2) приготовление раствора приблизительной концентрации и установление его точной концентрации с помощью первичного стандартного вещества;
3) метод фиксаналов.
Фиксаналы представляют собой запаянные стеклянные ампулы, содержащие определенную массу вещества. Для приготовления титранта ампулу фиксанала разбивают над специальной воронкой с пробивным устройством и содержимое ее смывают растворителем (водой) в мерную колбу объемом 1 литр. Полученный раствор затем разбавляют растворителем до метки. Концентрация полученного раствора указывается на .ампуле.
При использовании первых двух вариантов приготовления титрантов требуется химическое соединение высокой степени чистоты, называемое первичным стандартом. Вещество, которое может рассматриваться как хороший первичный стандарт, должно удовлетворять ряду важнейших требований:
быть химически чистым (содержание примесей не должно превышать 0,05 %);
быть устойчивым и сохраняться без изменений как на воздухе, так и в растворе (т.е. вещество не должно быть гигроскопичным, окисляться, взаимодействовать с диоксидом углерода, терять кристаллическую воду);
быть легкодоступным;
иметь достаточно высокую эквивалентную массу (масса вещества, требующегося для определения, тем больше, чем выше молярная масса эквивалента).
Концентрации стандартных растворов (С) выражают в моль/л (М), в моль/л эквивалента вещества (н.), в г/мл (титр ТА).
В методах кислотно-основного титрования и окисления-восстановления удобнее выражать концентрацию стандартных растворов в моль/л эквивалента. Нормальный раствор вещества А — раствор, в 1 л которого содержится количество вещества, равное молярной массе его эквивалента,
соответственно п — нормальный раствор содержит пМ.зка г вещества.
П![]() ри
массовых анализах для упрощения расчетов
концентрацию стандартного раствора
выражают так же через титр по определяемому
веществу
ри
массовых анализах для упрощения расчетов
концентрацию стандартного раствора
выражают так же через титр по определяемому
веществу
число г вещества В, соответствующее 1 мл раствора титранта А.
Следующие соотношения связывают различные способы выражения концентраций раствора


Расчет навески а при приготовлении V мл раствора стандартного вещества А заданной концентрации СА или НА проводится по формуле


Эти же формулы позволяют рассчитать концентрации стандартных растворов, приготовленных по точной навеске вещества А (а), растворенной в V мд воды.
При определении концентрации раствора А(НА) по результатам титрования стандартного вещества В вычисление производится по формуле
![]()
b — навеска стандартного вещества В, Vа количество раствора А, израсходованное на титрование, мл.
Если для определения концентрации раствора А используется стандартный раствор вещества В, концентрация которого равна нв, а на титрование VA мл раствора А расходуется VB мл раствора В, то нА рассчитывается из соотношения
![]()
Произведение HV представляет собой число миллимолей эквивалента.
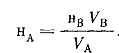
Расчеты в титриметрическом анализе
Титриметрический анализ основан на принципе эквивалентности, согласно которому вещества вступают в реакции друг с другом в эквивалентных количествах, т.е.

![]() количество
эквивалентов определяемого вещества
количество
эквивалентов определяемого вещества
![]() количество
эквивалентов титранта
количество
эквивалентов титранта
