
- •Учебно-методический комплекс по дисциплине «органическая химия»
- •Предисловие
- •Содержание
- •Раздел I Основы строения и реакционная способность органических соединений…………………………………………………………………………...7
- •Раздел II Насыщенные, ненасыщенные и ароматические ув……………15
- •Раздел III Производные ув…………………………………………………30
- •Содержание дисциплины «органическая химия»
- •Краткий курс лекций
- •Раздел I Основы строения и реакционная способность органических соединений
- •1.1 Теория строения органических соединений
- •1.2 Классификация органических соединений
- •1.3 Изомерия органических соединений
- •1.4 Строение атома углерода. Типы гибридизаций
- •1.5 Классификация органических реакций
- •Раздел II Насыщенные, ненасыщенные и ароматические ув
- •2.1 Алканы (предельные ув)
- •2.2 Циклоалканы
- •2.3 Алкены (непредельные ув, олефины)
- •3. Гидрирование алкинов:
- •2.4 Алкины (ненасыщенные ув)
- •2.5 Алкадиены
- •2.6 Арены (ароматические ув)
- •Раздел III Производные ув
- •3.1 Кислородсодержащие производные ув
- •3.1.1 Спирты
- •2) Взаимодействие с аммиаком с образованием аминов (300ºС).
- •3.1.2 Альдегиды (оксосоединения)
- •2. Циклическая полимеризация (тримеризация, тетрамеризация).
- •3.1.3 Карбоновые кислоты
- •2. Взаимодействие с аммиаком с образованием амидов кислот.
- •1. Общие способы получения:
- •3.1.4 Сложные эфиры. Жиры
- •Получение жиров.
- •3.2 Галогенпроизводные ув
- •3.3 Азотсодержащие производные ув
- •3.3.1 Амины. Анилин
- •3.3.2 Аминокислоты
- •Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1. Качественный элементный анализ органических соединений
- •Экспериментальная часть.
- •Экспериментальная часть
- •Экспериментальная часть.
- •Экспериментальная часть.
- •Методические указания для самостоятельной работы студентов Задания в тестовой форме для самоконтроля
- •1 Предельные, непредельные и ароматические ув
- •2 Кислородсодержащие производные ув: спирты, карбонильные соединения, карбоновые кислоты.
- •30. Определите промежуточное вещество х в синтезе ацетона по схеме: пропен → х → ацетон
- •3 Азотсодержащие производные ув: амины, нитросоединения, аминокислоты
- •4 Высокомолекулярные соединения
- •Перечень контрольных вопросов
- •Список рекомендуемой литературы
3.3.2 Аминокислоты
Аминокислоты можно рассматривать как производные углеводородов, содержащие аминогруппы (–NH2) и карбоксильные группы (–CООН).
Общая формула: (NH2)mR(COOH)n,
Номенклатура.
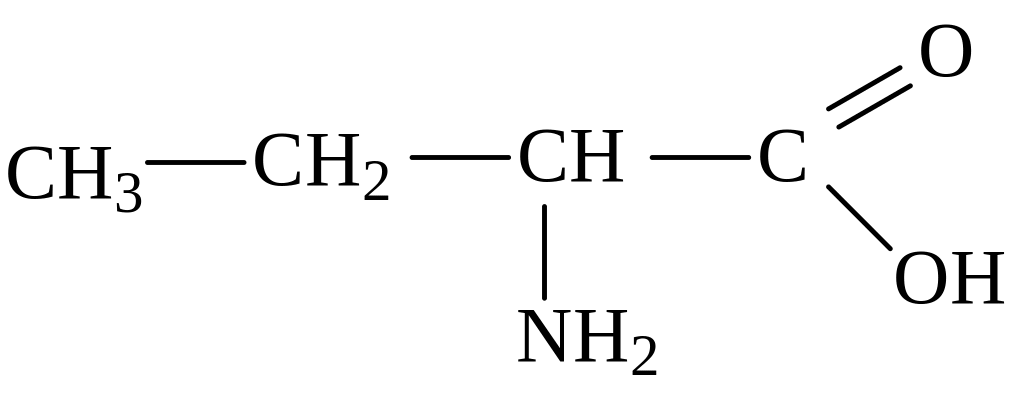
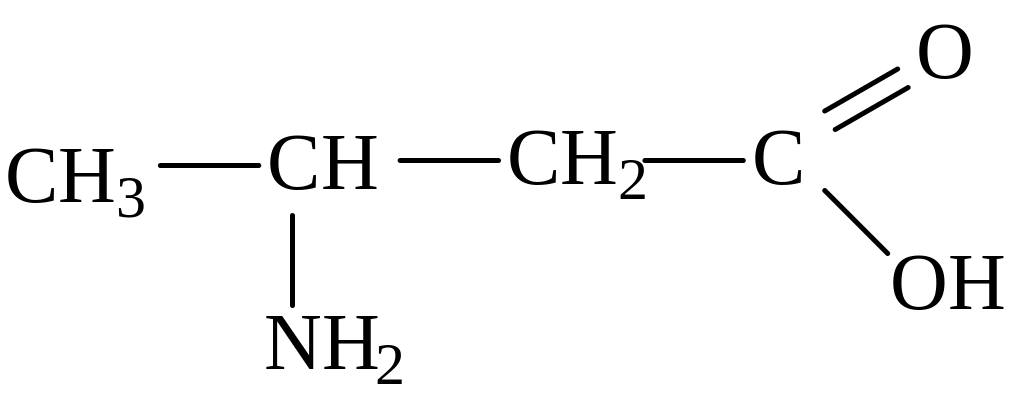
2-аминобутановая кислота 3-аминобутановая кислота
(α-аминобутановая) (β-аминобутановая)
Остатки около 20 различных α-аминокислот входят в состав белков.
Химические свойства. Аминокислоты являются полифункциональными соединениями. Вступают в реакции, характерные для аминов и карбновых кислот (см. химические свойства карбоновых кислот и аминов).
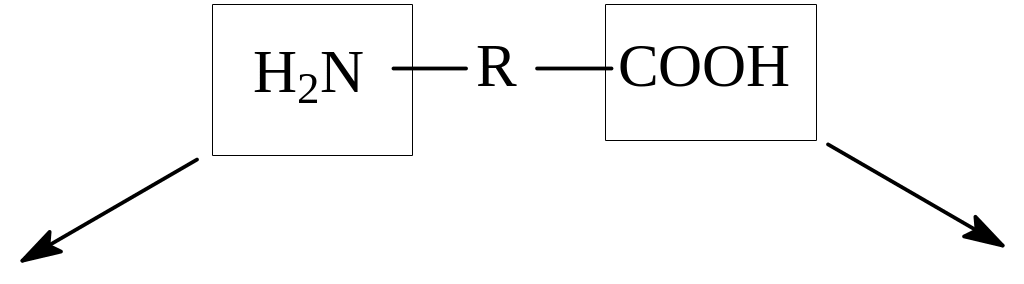
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
![]()
амфотерные свойства
I. Амфотерные свойства.
1. Кислотные свойства (участвует карбоксильная группа):

глицин глицинат натрия (соль)
2. Основные свойства (участвует аминогруппа):
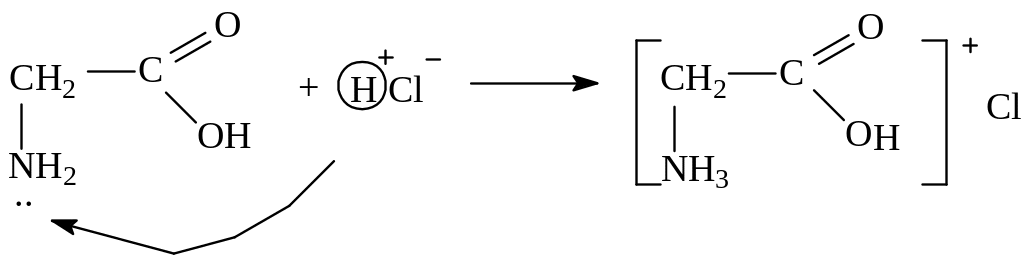
солянокислый глицин (соль)
II. Образование внутренних солей.
Моноаминомонокарбоновые кислоты (нейтральные кислоты):
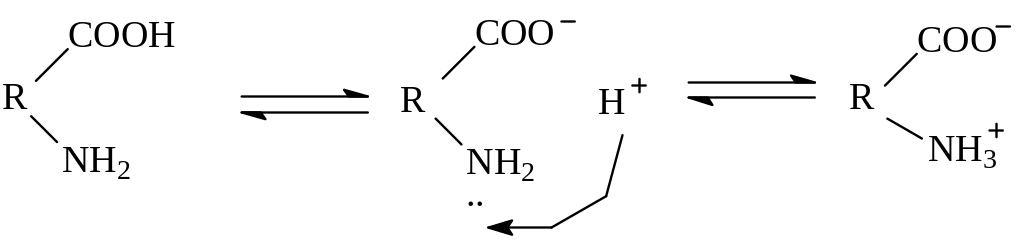
внутренняя соль
(биполярный ион, или цвиттер-ион)
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН = 7). Водные растворы моноаминодикарбоновых кислот имеют рН < 7, так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+. Водные растворы диаминомонокарбоновых кислот имеют рН > 7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН-.
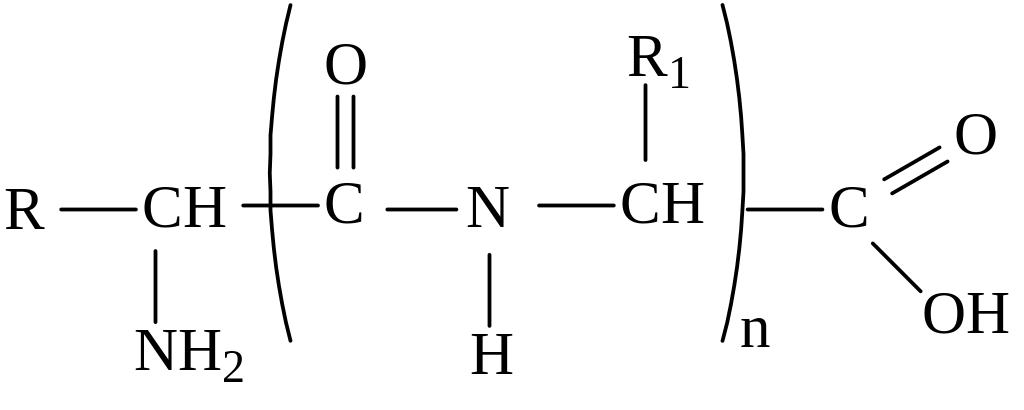
III. Взаимодействие аминокислот друг с другом – образование пептидов.
Две аминокислоты образуют дипептид, три – трипептид, n - полипептид:

пептидная связь (амидная связь)
глицин аланин глицилаланин
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Общая формула пептидов:
Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
Задание 1. Напишите структурные формулы четырех веществ, содержащих карбонильную группу и относящихся к четырем различным классам органических соединений.
Решение.
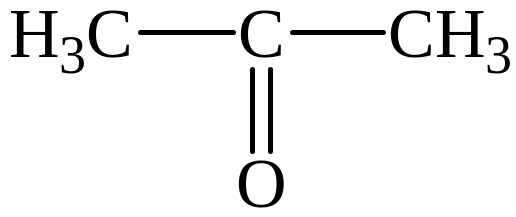 кетон
кетон
![]() альдегид
альдегид
![]() карбоновая
кислота
карбоновая
кислота
![]() сложный
эфир
сложный
эфир
Задание 2. Напишите структурную формулу и назовите углеводород, молекула которого содержит 5 первичных, 2 вторичных, 1 третичный и 1 четвертичный атомы углерода.
Задание 3. Напишите формулу и назовите углеводород, который содержит четыре sp2-гибридизованных атома углерода и один sp3-гибридизованный атом углерода.
Решение.
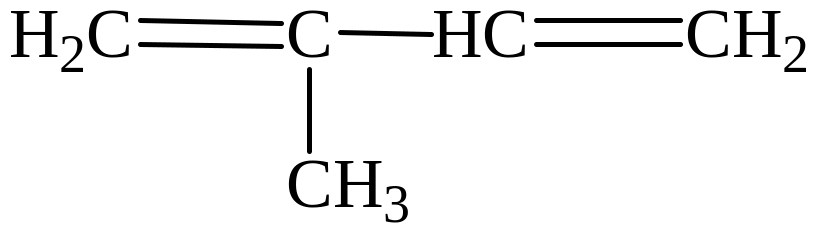 2-метил-бутен-1,3
2-метил-бутен-1,3
Задание 4. Напишите полную структурную формулу вещества CF3–CHBrCI и полные структурные формулы не менее трех изомеров вещества.
Задание 5. Сколько видов структурной изомерии представлено формулами.
Решение.
1) СН2 = СН – СН2 – СН3;
2) СН2 = СН – (СН2)2 – СН3;
3) СН3 – СН = СН – СН3;
4)
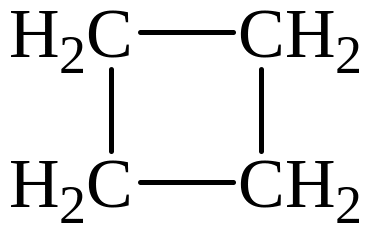
5)
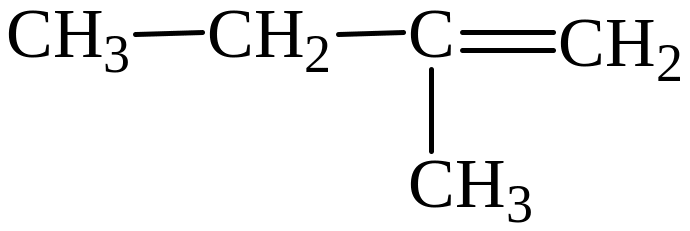
Изомеры 1) и 3) представляют изомерию положения двойной связи; изомеры 2) и 5) – изомерию углеродного скелета; изомеры 1) и 4) – межклассовая изомерия (алкены и циклоалканы).
Задание 6. К какому типу относятся реакции:
1) C2H5Cl + H2O → C2H5OH + HCl;
2) С6Н6 + 3Cl2 → C6H6Cl6;
3)
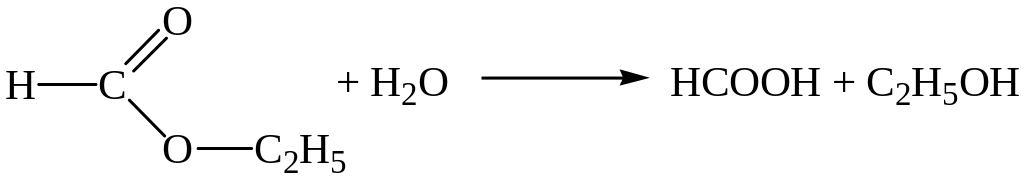
4)
![]()
5)
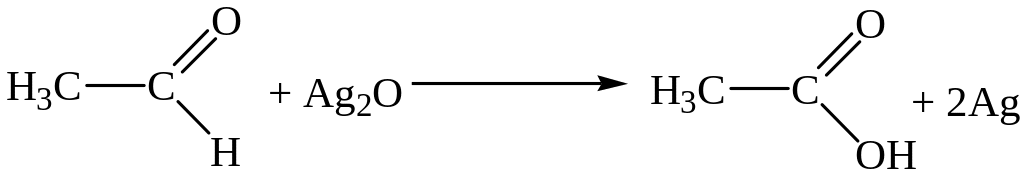
6) C6H5 – CH3 + Cl2 → C6H5 – CH2 – Cl + HCl
Решение. Реакции 1) и 6) относятся к реакциям замещения; реакция 2) – реакция присоединения; реакция 3) – разложения; реакция 4) – отщепления; реакция 5) – окисления.
Практическое занятие № 2. Определение химической формулы вещества
Для установления химической формулы вещества недостаточно знать массовые доли элементов. В этом случае можно установить лишь простейшую. Например, в веществах, имеющих молекулярные формулы С2Н2 (ацетилен) и С6Н6 (бензол), соотношение числа атомов углерода и числа атомов водорода одинаково и равно 1:1. Поэтому массовые доли углерода и водорода в этих веществах также одинаковы. Таким образом, простейшая химическая формула, которую можно установить, исходя из массовых долей элементов, это СН. Понятно, что эта формула противоречит понятиям о валентности элементов, тем не менее, именно она выражает простейшее целочисленное отношение между числами атомов углерода и водорода в обоих веществах. Для установления истинной формулы необходимо знать его молекулярную массу.
Задание 1. Путем анализа установлено, что в состав данного вещества входят элементы водород и кислород, массовые доли которых, соответственно, равны 5,88 % и 94,12 %. Молекулярная масса вещества равна 34. Определить простейшую и молекулярную формулы этого вещества.
Решение. Задачи этого типа можно решать двумя способами.
I способ. Пусть молекулярная формула вещества НхОу. По условию задачи Мг(НхОу) = 34, следовательно, М(HxOy) = 34 г/моль.
Зная массовые доли элементов, рассчитываем массы водорода и кислорода в 1 моле вещества:
m(Н) = М(НхОу) · W(Н) = 34 · 0,0588 = 2 г;
m(O) = М(НхОу) · ω(O) = 34 · 0,9412 = 32 г.
Определяем число молей атомов водорода и кислорода в 1 моле вещества:
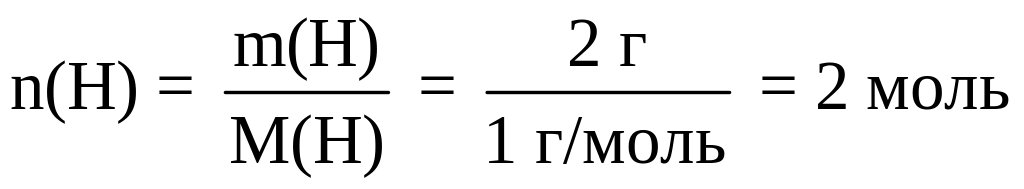 ;
;
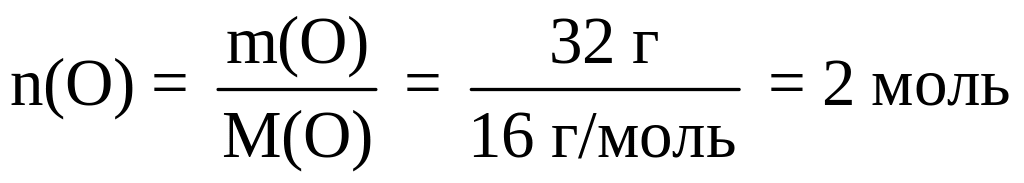
В одном моле НхОу содержится 2 моля атомов Н и 2 моля атомов О. Следовательно, в одной молекуле содержится 2 атома водорода и 2 атома кислорода: Н2O2.
II способ. Пусть масса вещества равна 100 г. Массы элементов водорода и кислорода в этой массе вещества равны соответственно:
m(Н) = 5,88 г; m(О) = 94,12 г.
Простейшее целочисленное отношение между числами молей атомов водорода и кислорода в данном веществе равно:
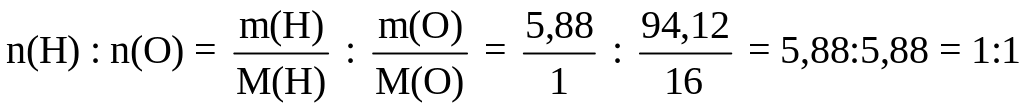
Таким образом, соотношение между числами атомов водорода и кислорода равно 1 : 1, и простейшая формула вещества – НО. Молекулярная масса, соответствующая этой формуле, Мг(НО) = 1 + 16 = = 17. Данная в условии задачи молекулярная масса вещества в два раза больше (34:17 = 2). Следовательно, индексы в простейшей формуле нужно удвоить; молекулярная формула вещества Н2O2.
Часто в задачах, связанных с установлением молекулярных формул газообразных веществ, не приводятся их молекулярные массы, но указывается относительная плотность этих веществ по какому-либо газу.
Согласно следствию из закона Авогадро, относительная плотность Х по газу У, обозначаемая Dy(X), равна отношению молекулярных (или молярных) масс этих газов:
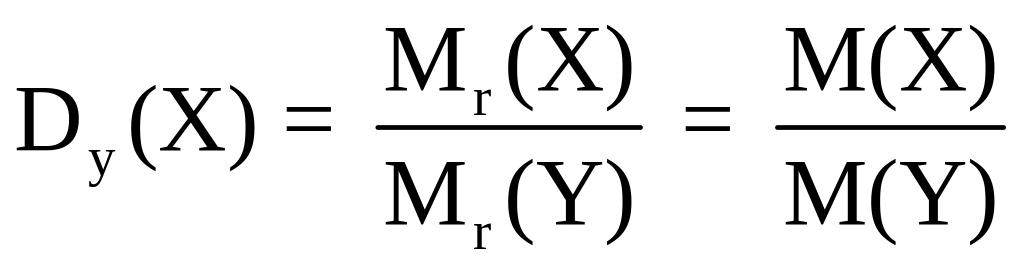
Если известны плотности газов по водороду или по воздуху, то молекулярные массы этих газов легко рассчитываются по формулам:
Мг(газа) = Мг(Н2) · DН2(газа) = 2 · DH2(газа);
Мг(газа) = Мг(возд) · Dвозд(газа) = 29 · Dвозд(газа).
Задание 2. Массовые доли углерода, водорода и кислорода в некотором веществе равны 40,00, 6,67 и 53,33 % соответственно. Плотность паров этого вещества по водороду равна 30. Установите молекулярную формулу вещества.
Решение. Массы элементов в 100 г вещества равны: m(С) = 40,00 г, m(Н) = 6,67 г, m(О) = 53,33 г.
Числа молей атомов данных элементов относятся друг к другу как:
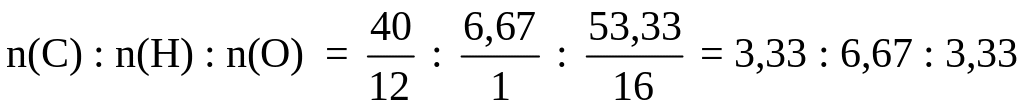
Чтобы получить простейшее целочисленное отношение, разделим полученные числа на меньшее из них:
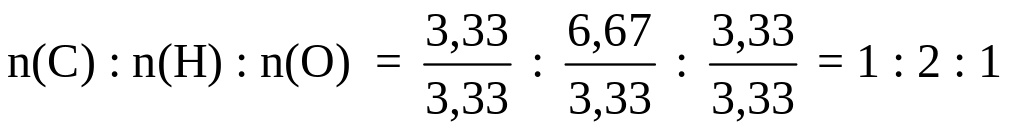
Простейшая формула вещества: СН2O.
Зная плотность паров вещества по водороду, рассчитаем молекулярную массу вещества:
Мг(газа) = Мг(Н2) · DН2(газа) = 2 · 30 = 60.
Молекулярная масса, вычисленная для простейшей формулы, М(СН2O) = 12 + 2 + 16 = 30, что в 2 раза меньше, чем истинная молекулярная масса вещества. Поэтому индексы в простейшей формуле нужно удвоить:
С2Н4O2 – молекулярная формула.
В определенных задачах по выводу формул горючих веществ вместо массовых долей элементов приводятся данные о массах (количествах, объемах) продуктов сгорания. На основании этих данных достаточно просто рассчитываются массовые доли элементов или число молей атомов в сгоревшем веществе.
Задание 3. Вещество состоит из углерода, водорода и хлора. При сжигании 0,956 г его получено 0,352 г углекислого газа и 0,0720 г воды. Молекулярная масса вещества 119,5. Найти его формулу.
Решение. Пусть вещество имеет формулу CxHyClz.
Запишем схему реакции сгорания этого вещества:
CхHуClz, + O2 → СO2 + Н2O + С12
Из схемы видно, что все атомы углерода из CxHyClz переходят в СO2, а все атомы водорода – в молекулы воды Н2O.
Находим количества вещества СО2, Н2О:
n(CO2) = m(CO2) / M(CO2) = 0,352 / 44 = 0,008 моль;
n(H2O) = m(H2O) / M(H2O) = 0,0720 / 18 = 0,004 моль.
Находим число атомов углерода и водорода:
n(С) = n(СO2) = 0,008 моль;
n(Н) = 2n(Н2O) = 2 · 0,004 = 0,008 моль.
Массы элементов углерода и водорода в исходном веществе:
m(С) = n(С) · М(С) = 0,008 · 12 = 0,096 г;
m(H) = n(Н) · M(H) = 0,008 · 1 = 0,008 г.
Находим массу и число атомов хлора в веществе:
m(С) + m(Н) = 0,096 + 0,008 = 0,104 г;
m(С1) = m (в-ва) – 0,104 = 0,956 – 0,104 = 0,852 г;
n(Cl) = m(Cl) / M(Cl) = 0,852 / 35,5 = 0,024 моль.
Простейшее целочисленное отношение чисел молей атомов в данном веществе равно:
n(С) : n(Н) : n(С1) = 0,008 : 0,008 : 0,024 = 1:1:3.
Простейшая формула вещества: СНС13.
Молекулярная масса простейшей формуле, Мr(СНС13) = 12 + 1 + 3 × 35,5 = 119,5, что совпадает с приведенной в условии молекулярной массой вещества. Таким образом, молекулярная и простейшая формулы идентичны.
Задание 4. При сжигании 12 г органического соединения образовались 14,4 г воды и углекислый газ, при пропускании которого через раствор гидроксида кальция образовалось 60 г осадка. Определите истинную (молекулярную) формулу исходного соединения, если относительная плотность его паров по воздуху равна 2,069.
Решение. Находим число атомов водорода:
n(Н2O) = m(Н2O) / M(Н2O) = 14,4 / l8 = 0,8 моль;
n(Н) = 2n(Н2O) = 2 · 0,8 = 1,6 моль;
m(Н) = n(Н) · М(Н) = 1,6 · 1 = 1,6 г.
Находим число атомов углерода. Количество СO2 определяем по массе осадка СаСO3, который образуется в результате реакции:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
n(СO2) = n(СаСO3) = m(СаСO3) / M(СаСO3) = 60 / 100 = 0,6 моль.
n(С) = n(СO2) = 0,6 моль;
m(С) = n(С) · М(С) = 0,6 · 12 = 7,2 г.
Сумма масс элементов водорода и углерода равна:
m(Н) + m(С) = 1,6 + 7,2 = 8,8 г.
Эта сумма меньше массы сгоревшего вещества. Следовательно, в состав этого органического вещества входит также элемент кислород; рассчитаем его массу и количество атомов:
m(O) = m (в-ва) – 8,8 = 12 – 8,8 = 3,2 г;
n(О) = m(O) / M(О) = 3,2 / l6 = 0,2 моль.
Простейшее целочисленное отношение количеств атомов С, Н и О в данном веществе равно:
n(С) : n(Н) : n(О) = 0,6 : 1,6 : 0,2 = 3 : 8 : 1.
Простейшая формула вещества С3Н8O, Мг(С3Н8O) = 60.
Рассчитаем истинную молекулярную массу вещества, исходя из плотности его паров по воздуху:
Мг(в-ва) = 29 · Dвозд(в-ва) = 29 · 2,069 = 60.
Следовательно, молекулярная формула вещества совпадает с простейшей – С3Н8О.
Задания для самоконтроля.
1. Определите формулу углеводорода, массовая доля углерода в котором 80 %.
2. Плотность углеводорода по кислороду равна 1,75, массовая доля водорода в нем равна 14,3 %. Определите молекулярную формулу углеводорода.
3. Массовая доля кислорода в предельном одноатомном спирте равна 18,18 %. Установите молекулярную формулу спирта.
4. При взаимодействии ацетиленового углеводорода с избытком раствора хлора образуется соединение, массовая доля хлора в котором 63,39%. Установите молекулярную формулу исходного алкина.
5. При каталитическом гидрировании 23,2 г альдегида было получено 24 г соответствующего спирта. Определите исходный альдегид.
6. При дегидратации 18,5 г предельного одноатомного спирта образовался алкен, объем которого (н.у.) равен 3,36 л. Выход в реакции дегидратации составил 60 %. Определите молекулярную формулу исходного спирта.
7. При дегидратации предельного одноатомного спирта объемом 66 мл (р = 0,85 г/мл) образовалось 46,2 г неразветвленного алкена симметричного строения. Назовите исходный спирт.
8. Альдегид, образовавшийся при окислении 15 г предельного одноатомного спирта с выходом 80 %, окислили аммиачным раствором оксида серебра. Реакция прошла с выходом 80 %, и образовалось 34,56 г серебра. Назовите исходный спирт.
9. При сгорании алкана образуется 94,08 л (н.у.) углекислого газа и 86,4 г воды. Определите молекулярную формулу алкана.
10. При сгорании арена массой 32,2 г выделилось 107,8 г оксида углерода (IV). Установите формулу арена.
11. При сгорании алкена образуется 40,32 л углекислого газа (н.у.) и 32,4 г воды. Такое же количество этого углеводорода обесцвечивает 3200 г бромной воды с массовой долей брома 3 %. Определите молекулярную формулу углеводорода.
12. При реакции циклоалкана с хлороводородом образуется вторичное галогенпроизводное, массовая доля хлора в котором 38,38 %. Определите структурную формулу циклоалкана и назовите его по систематической номенклатуре.
13. При сгорании смеси двух изомерных алканов образовалось 58,24л (н.у.) углекислого газа и 58,5 г воды. Сколько атомов углерода в молекулах изомеров.
14. При сгорании 18,4 г органического соединения образовалось 17,92 л (н.у.) углекислого газа и 21,6 г воды. Определите простейшую формулу соединения.
15. К 11,1 г одноосновной органической кислоты добавили сначала 14 г 20 %-ного раствора гидроксида натрия, а затем избыток раствора карбоната калия. При этом выделилось 896 мл (н.у.) газа. Назовите кислоту.
16. Для получения 58,68 г монобромпроизводного циклоалкана неизвестного строения использован раствор, содержащий 96 г брома, причем реакция протекала с выходом 60 %. Установите число изомерных циклоалканов, удовлетворяющих данному условию.
17. При монобромировании ароматического углеводорода в присутствии железного катализатора выделился бромоводород, на нейтрализацию которого потребовалось 80 г 10 %-ного раствора гидроксида натрия. При сгорании того же количества этого арена выделилось 35,84 л (н.у.) оксида углерода (IV). Установите число изомеров, которые имеет этот арен.
18. При бромировании гомолога бензола в присутствии железа образовалось 95,52 г монобромпроизводного и выделился бромоводород, на нейтрализацию которого потребовалось 80 мл (р = 1,2 г/мл) раствора с массовой долей гидроксида натрия 20 %. Определите структурную формулу арена. Название его, если известно, что при бромировании в указанных условиях образуется только 1 изомер монобромпроизводного.
19. Отношение молярных масс монохлорпроизводного алкана и полученного из него при действии водного раствора щелочи спирта равно 1,578. Установите формулу галогеналкана.
20. 30 г моноаминомонокарбоновой кислоты прореагировало с 16 г гидроксида натрия. Назовите исходную кислоту.
21. При сжигании 6,9 г газа, плотность которого (н.у.) 2,054 г/л, получено 13,2 г оксида углерода (IV) и 8,1 воды. Определите структурную формулу данного вещества.
22. Смесь этиленового углеводорода и водорода пропустили над платиновым катализатором. При этом реакция прошла с выходом 80 %, и объем смеси уменьшился на 4,48 л (н.у.). При пропускании такого же количества исходной смеси через колбу с бромной водой весь углеводород прореагировал, и масса содержимого колбы увеличилась на 10,5 г. Установите формулу исходного алкена.
23. При сгорании 44,5 г органического соединения выделилось 31,5 г воды и 39,2 л (н.у.) газа. Газ был пропущен через избыток раствора гидроксида натрия, при этом его объем уменьшился в 7 раз. Определите число изомеров, которое может иметь данное соединение, учитывая, что оно способно вступать в реакции с соляной кислотой и раствором гидроксида натрия.
24. Смесь равных количеств двух различных алканов имеет плотность по водороду, равную 15. Установите формулы данных алканов.
25. При гидрировании алкена образовался алкан, массовая доля водорода в котором на 5,714 % больше, чем в исходном алкене. Определите формулу алкена.
26. В некотором органическом веществе массовая доля углерода равна 85,71 %, водорода – 14,29 %. 42 г этого вещества при температуре 127 0С и давлении 5 атм. занимают объем 3,28 л. Определите молекулярную формулу вещества.
27. При сгорании 2,3 г органического вещества образовалось 4,4 г углекислого газа и 2,7 г воды. 2,3 г паров сгоревшего вещества при температуре 40 0С и давлении 1,5 атм. занимают объем 0,855 л. Определите молекулярную формулу вещества.
Практическое занятие № 3. Важнейшие классы органических соединений. Генетическая связь между классами органических соединений
Задание1. На вещество А состава С6Н10Сl4 подействовали при нагревании водным раствором щелочи. Продукт реакции Б не дает положительную реакцию на пробу Бейльштейна. При окислении Б в жестких условиях образуются уксусная и щавелевая кислоты в молярном отношении 2 : 1. Напишите структурные формулы веществ А и Б.
Решение. Проба Бейльштейна – качественная реакция на наличие в молекуле органического вещества атомов галогенов. Исходя из результатов окисления Б, это вещество имеет структуру:
CH3 – CO – CH2 – CH2 – CO – CH3,
Оно получается при гидролизе тетрахлоралкана А:
CH3 – C(Cl)2 – CH2 – CH2 – C(Cl)2 – CH3
Задание 2. Предложите способ выделения компонентов из смеси н-октана, 2,2,4-триметилпентана, фенола и бензойной кислоты.
Решение. Обработка смеси водным раствором щелочи ведет к переходу в раствор фенола и бензойной кислоты:
C6H5OH + NaOH → C6H5ONa + H2O,
C6H5COOH + NaOH → C6H5COONa + H2O.
Если через полученный раствор пропустить СО2, осаждается фенол:
C6H5ONa + H2O + СО2 →C6H5OH↓ + NaHСO3,
а обработка оставшегося раствора сильной кислоты ведет к выделению бензойной кислоты:
C6H5 – COONa + HCl → C6H5COOH↓ + NaCl.
К оставшейся смеси углеводородов можно добавить мочевину
H2N – CO – NH2, образующую с н-октаном нерастворимое клатратное соединение. Обработка этого клатрата водой вызовет его разрушение с образованием мочевины и н-октана.
Задание 3. В произвольном порядке приведены значения константы диссоциации (КД) веществ: фенола, этанола, хлоруксусной кислоты, бензойной кислоты, угольной кислоты: 1,8·10-18; 4,9·10-7; 1,3·10-10; 1,4·10-5; 6,3·10-5.
Какое из приведенных значений КД соответствует каждому из соединений.
Решение.
-
Вещество
КД
Фенол
1,3·10-10
Этанол
1,8·10-18
Хлоруксусная кислота
1,4·10-5
Бензойная кислота
6,3·10-5
Угольная кислота
4,9·10-7
Задание 4. Составьте уравнения реакций, описывающие схему превращений:
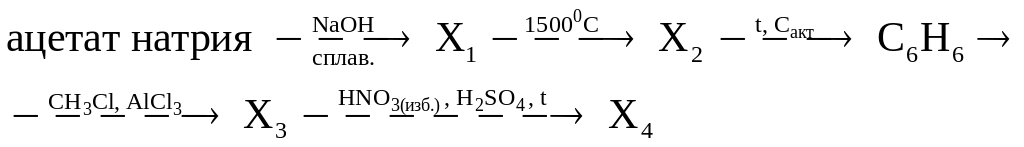
Решение.
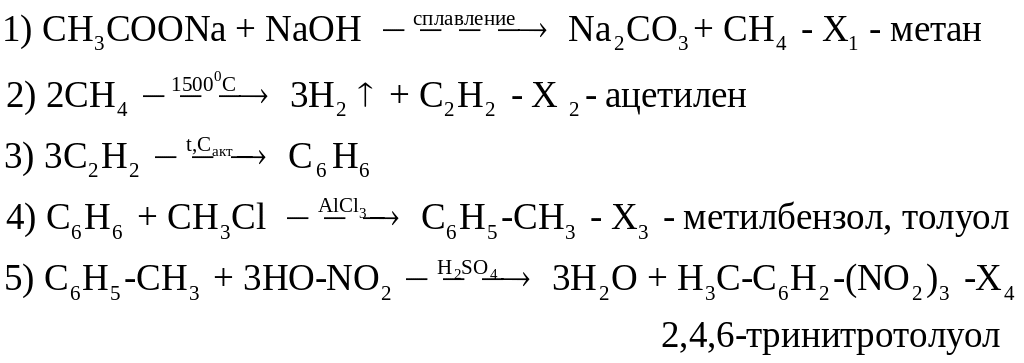
Задания для самоконтроля
Составьте уравнения реакций, описывающие схему превращений:
а)

б)
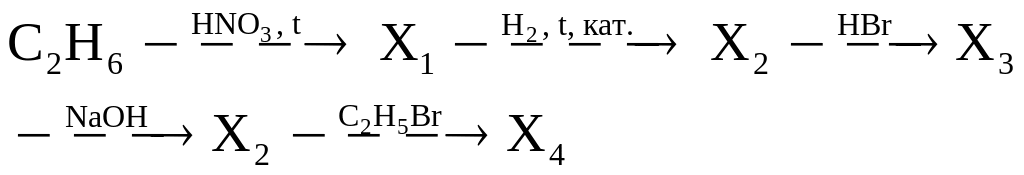
в)
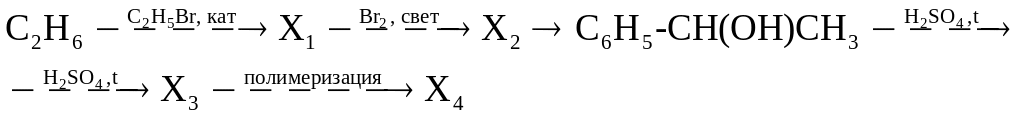
г)
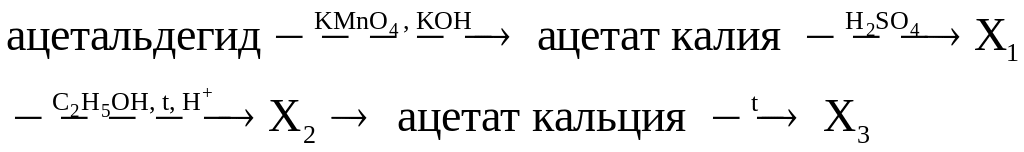
д)
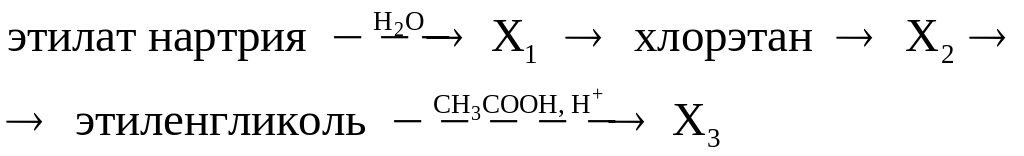
Используя только неорганические реагенты, из ацетилена получите этиловый эфир уксусной кислоты.
Производное бензола состава С9Н8 реагирует с амидом натрия, вступает в реакцию Кучерова и при окислении перманганатом калия дает бензойную кислоту. Установите структурную формулу производного бензола и напишите реакции.
При взаимодействии соединения С2Н4О2 с водно-аммиачным раствором Ag2O выделяется серебро, а исчерпывающее восстановление приводит к метанолу. Определите структурную формулу С2Н4О2 и предложите способ его синтеза из метана.
