
- •Учебно-методический комплекс по дисциплине «органическая химия»
- •Предисловие
- •Содержание
- •Раздел I Основы строения и реакционная способность органических соединений…………………………………………………………………………...7
- •Раздел II Насыщенные, ненасыщенные и ароматические ув……………15
- •Раздел III Производные ув…………………………………………………30
- •Содержание дисциплины «органическая химия»
- •Краткий курс лекций
- •Раздел I Основы строения и реакционная способность органических соединений
- •1.1 Теория строения органических соединений
- •1.2 Классификация органических соединений
- •1.3 Изомерия органических соединений
- •1.4 Строение атома углерода. Типы гибридизаций
- •1.5 Классификация органических реакций
- •Раздел II Насыщенные, ненасыщенные и ароматические ув
- •2.1 Алканы (предельные ув)
- •2.2 Циклоалканы
- •2.3 Алкены (непредельные ув, олефины)
- •3. Гидрирование алкинов:
- •2.4 Алкины (ненасыщенные ув)
- •2.5 Алкадиены
- •2.6 Арены (ароматические ув)
- •Раздел III Производные ув
- •3.1 Кислородсодержащие производные ув
- •3.1.1 Спирты
- •2) Взаимодействие с аммиаком с образованием аминов (300ºС).
- •3.1.2 Альдегиды (оксосоединения)
- •2. Циклическая полимеризация (тримеризация, тетрамеризация).
- •3.1.3 Карбоновые кислоты
- •2. Взаимодействие с аммиаком с образованием амидов кислот.
- •1. Общие способы получения:
- •3.1.4 Сложные эфиры. Жиры
- •Получение жиров.
- •3.2 Галогенпроизводные ув
- •3.3 Азотсодержащие производные ув
- •3.3.1 Амины. Анилин
- •3.3.2 Аминокислоты
- •Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1. Качественный элементный анализ органических соединений
- •Экспериментальная часть.
- •Экспериментальная часть
- •Экспериментальная часть.
- •Экспериментальная часть.
- •Методические указания для самостоятельной работы студентов Задания в тестовой форме для самоконтроля
- •1 Предельные, непредельные и ароматические ув
- •2 Кислородсодержащие производные ув: спирты, карбонильные соединения, карбоновые кислоты.
- •30. Определите промежуточное вещество х в синтезе ацетона по схеме: пропен → х → ацетон
- •3 Азотсодержащие производные ув: амины, нитросоединения, аминокислоты
- •4 Высокомолекулярные соединения
- •Перечень контрольных вопросов
- •Список рекомендуемой литературы
1. Общие способы получения:
- окисление первичных спиртов и альдегидов под действием различных окислителей:
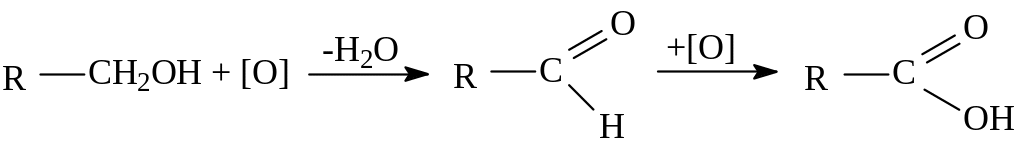
- окисление алканов кислородом воздуха (в присутствии Мn2+ или при нагревании под давлением). Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
![]()
- омыление сложных эфиров (т.е. их щелочной гидролиз):
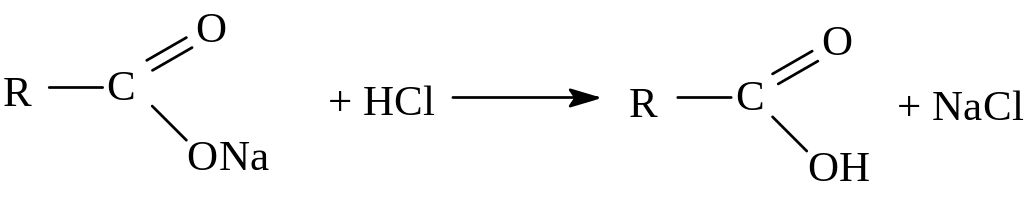
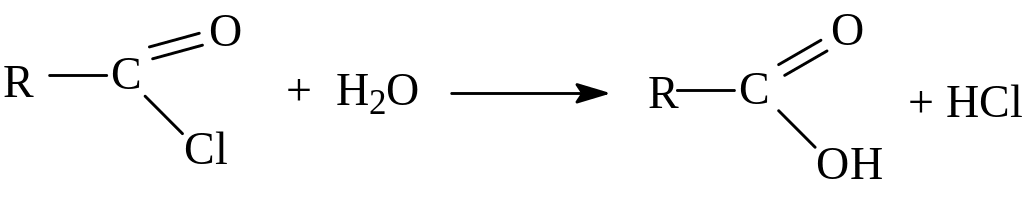
- гидролиз галогенангидридов кислот:
2.Специфические способы получения кислот:
![]()
2HCOONa + H2SO4 → 2HCOOH + Na2SO4
ферменты
СН3–СН2ОН + O2 → СН3СООН + Н2O
![]()
3.1.4 Сложные эфиры. Жиры
Сложные эфиры – это производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на алкильный радикал; или это продукты замещения гидроксильного атома водорода в спиртах на кислотный радикал (ацил).
Номенклатура. Названия сложных эфиров образуются из названий соответствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов:

метиловый эфир муравьиной кислоты амиловый эфир уксусной кислоты
(муравьинометиловый эфир, (уксусноамиловый эфир, амилацетат)
метилформиат)
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны карбоновым кислотам); 3) оптическая.
Физические свойства. Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры – воскообразные вещества (пчелиный воск), все сложные эфиры в воде растворяются плохо.
Химические свойства.
Гидролиз – важнейшее химическое свойство сложных эфиров:
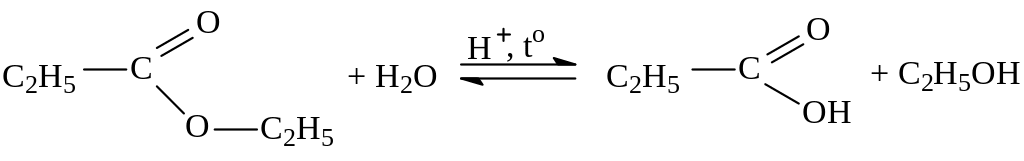
этилпропионат
Для смещения реакции в сторону образования эфира можно «связать» образующуюся воду водоотнимающим средствам (например, конц. H2SO4). В том случае, когда необходимо провести гидролиз эфира, реакцию иногда проводят в присутствии щелочи, которая позволяет «связать» образующуюся кислоту.
Жиры – это смесь сложных эфиров трехатомного спирта глицерина и высших карбоновых кислот (ВКК).
Общая формула жира:
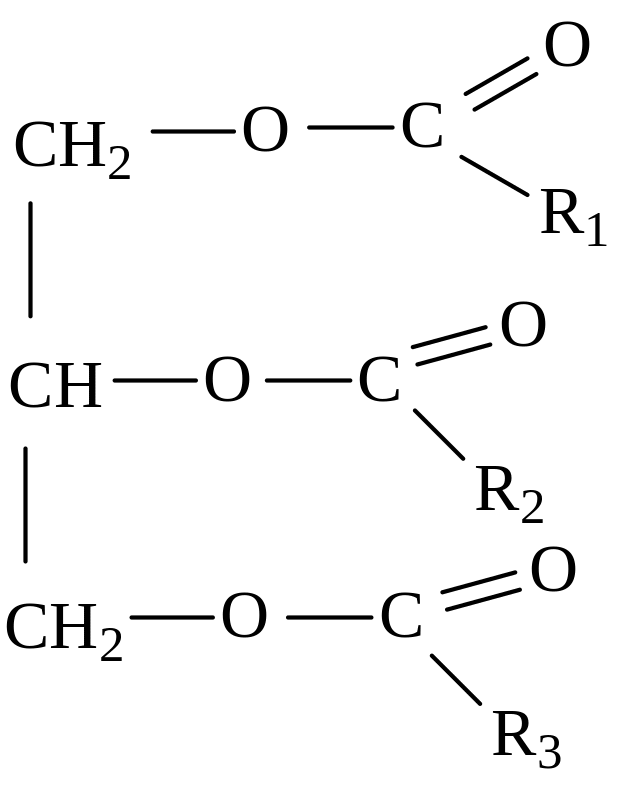
где R, R2, R3 – углеводородные радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Впервые синтез жиров был осуществлен французским химиком М. Бертло в 1854 г. (реакция Бертло).
Номенклатура. По систематической номенклатуре жиры называют, добавляя окончание -ин к названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано.
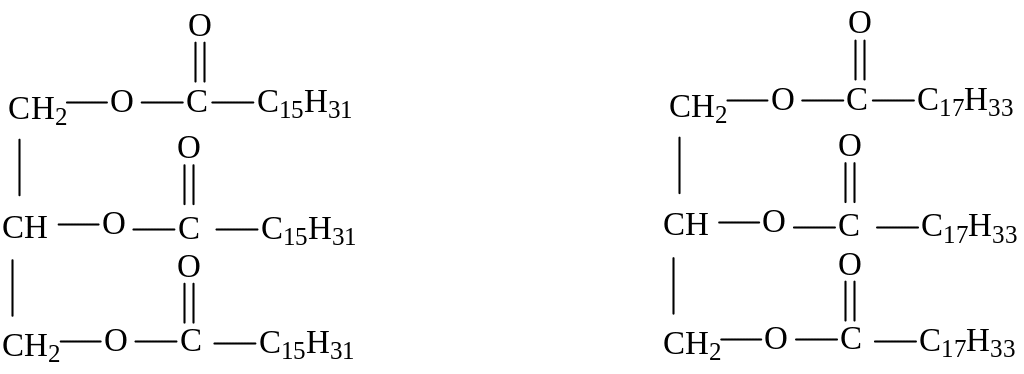
эфир глицерина и пальмитиновой эфир глицерина и олеиновой кислоты, трипальмитат глицерина, кислоты, триолеат глицерина,
трипальмитин триолеин
Физические свойства. При комнатной температуре жиры (триглицериды) – вязкие жидкости или твердые вещества, легче воды; в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле и др.).
Классификация жиров по агрегатному состоянию, химическому строению и происхождению приведена в таблице 5.
Химические свойства.
I. Гидролиз. В зависимости от условий гидролиз бывает:
1. Водный (без катализатора, при высоких t0 и Р);
Таблица 5 – Классификации жиров
Агрегатное состояние жиров |
Различия в химическом строении |
Происхождение жиров |
Исключения |
твердые жиры |
содержат остатки насыщенных ВКК |
животные жиры |
рыбий жир (жидкий) |
смешанные жиры |
содержат остатки насыщенных и ненасыщенных ВКК |
||
жидкие жиры (масла) |
содержат остатки ненасыщенных ВКК |
растительные жиры |
кокосовое масло (твердое) |
2. Кислотный (в присутствии кислоты в качестве катализатора);
3. Ферментативный (происходит в живых организмах);
4. Щелочной (под действием щелочей).
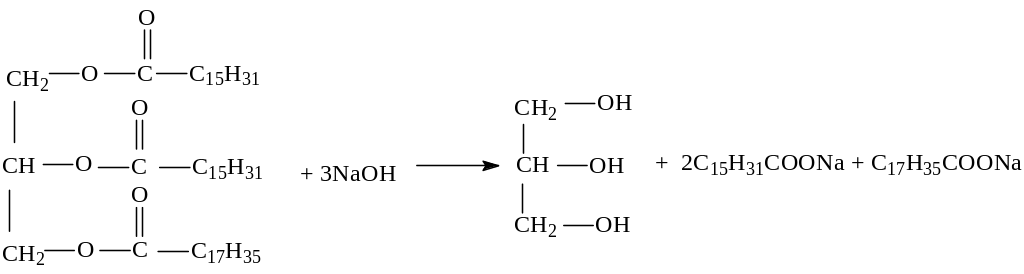
дипальмитостеарин
Образующиеся в результате щелочного гидролиза натриевые и калиевые соли ВКК представляют собой мыла. Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
II. Реакция присоединения (для жидких ненасыщенных жиров).
1. Присоединение водорода (гидрирование, гидрогенизация):
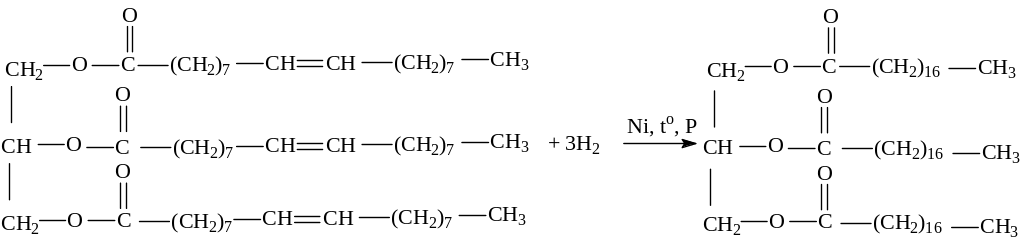
триолеин (жидкий жир) тристеарин (твердый жир)
2. Присоединение галогенов. Растительные масла обесцвечивают бромную воду:
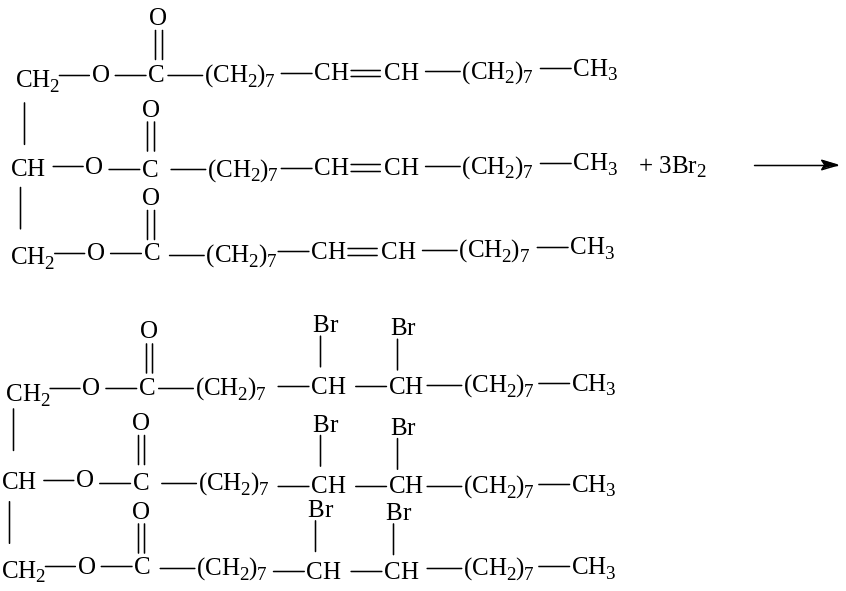
9,10-гексабромтристеарин
Реакции окисления и полимеризации (для жидких ненасыщенных жиров). Жиры, содержащие остатки непредельных кислот (высыхающие масла), под действием кислорода воздуха окисляются и полимеризуются.
