
- •Белки, их строение и биологическая роль
- •Строение белков. Первичная структура.
- •Вторичная структура
- •Третичная структура
- •Понятие о нативном белке
- •Классификация. Биологические и химические свойства белков
- •Физико-химические свойства белков
- •Биохимия сложных белков
- •Некоторые особенности строения миоглобина и гемоглобина
- •Гемаглобинопатии
- •Ферменты
- •Механизм действия ферментов. Основные черты ферментативного катализа, его этапы.
- •1. Частичный протеолиз (Трипсиноген------ Трипсин)
- •Факторы, оказывающие влияние на активность ферментов.
- •Конкурентное ингибирование.
- •Неконкурентное ингибирование.
- •Биохимия нуклеотидов и нуклеиновых кислот. Матричные биосинтезы.
- •Характеристика репликации.
- •Транскрипция. Трансляция.
- •1 ).Инициация
- •1. Обмен веществ включает в себя 3 этапа:
- •Организация цпэ (по рис.1)
- •Пиридинзависимые дегидрогеназы (над, надф)
- •Флавинзависимые дегидрогеназы (фад,фмн)
- •Функции дыхательной цепи:
- •Дыхательный контроль.
- •Токсичное действие кислорода. Защита от токсичного действия кислорода.
- •Обмен углеводов.
- •Функции углеводов.
- •Всасывание углеводов в кишечнике.
- •Метаболизм глюкозы.
- •Гликолиз (дихотомический процесс).
- •Биомедицинское значение ферментативных реакций гликолиза.
- •Суммарная реакция и выход энергии при гликолизе.
- •Пентофозофосфатный путь ( пфп).
- •Биомедицинское значение.
- •Общая схема биохимических реакций пфп.
- •Медицинское значение.
- •Глюконеогенез.
- •Биомедицинское значение.
- •Биомедицинское значение.
- •Биосинтез гликогена.
- •Обмен фруктозы и галактозы.
- •Обмен липидов.
- •Функции липидов в организме.
- •Переваривание и всасывание жиров.
- •Желчные кислоты.
- •Всасывание продуктов гидролиза.
- •Биосинтез кетоновых тел.
- •Распад кетоновых тел.
- •Биосинтез высших жк.
- •Синтез жиров (таг).
- •Отличие действия инсулина в жировой ткани и печени:
- •Синтез холестерина.
- •Биосинтез Хс.
- •Ферменты.
- •Регуляция синтеза нуклеотидов.
- •Синтез пиримидиновых нуклеотидов.
- •Регуляция.
- •Катаболизм.
- •Катаболизм пуриновых нуклеотидов.
- •Регуляция обмена веществ. Гормоны (химические посредники).
- •1. По химической структуре:
- •2. По механизму действия;
- •3. По влиянию на организм:
- •Синтез и секреция гормонов.
- •Механизм действия гормонов белково-пептидной природы через вторичных посредников.
- •Эффекты, осуществляемые через ц амф.
- •Кальций как вторичный посредник.
- •Биохимия печени
- •Обезвреживающая функция печени
- •Обезвреживание веществ
- •Отличие этих цепей от цпэ
- •Биохимия крови
- •Белки плазмы крови
- •Сывороточный альбумин
- •Глобулины
- •Конверсия метгемоглобина
- •Биосинтез тема и его регуляция
- •Гемостаз
- •1 Фаза: первичный гемостаз.
- •2 Фаза: гемокоагуляция
- •Фибрина
- •Противосвертывающая система
- •Биохимический_анализ
- •Гормоны
- •Липотропины
Организация цпэ (по рис.1)
Окисление субстратов в процессе дыхания можно представить как перенос ёиН (т.е. атомов Н), которые отщепляются от субстратов (например, в ЦТК и ОДПВК). Этот процесс включает несколько этапов и в нем участвует ряд переносчиков, образующих ЦПЭ. ЦПЭ локализована во внутренней мембране митохондрий. В переносе ё и Н (т.е. атомов Н) участвуют три класса окислительно-восстановительных ферментов:
Пиридинзависимые дегидрогеназы (над, надф)
Флавинзависимые дегидрогеназы (фад,фмн)
цитохромы, содержащие железопорфириновую кольцевую систему
По рис.1: первый компонент ЦПЭ - НАДН+Н-кофермент дегидрогеназ, который легко
отделяется от своего фермента и диффундирует к внутренней мембране митохондрий и
становится первым компонентом дыхательной цепи - производное витамина PP.
Второй компонент - НАДН - ДГ -белок - кофермент флавинмононуклеотид -
производное Bj, называется так по субстрату, от которого отщепляет или отнимает 2Н
(НАДН+Н*)
Третий компонент — кофермент Q или убихинон, структура его сходна со структурой
витамина Е и К, содержание KoQ значительно превосходит содержание других
компонентов. Липофилен, может перемещаться в липидном слое мембраны
митохондрий.
Четвертый компонент - система цитохромов - это сложные белки-гемопротеины. Атом
Fe в отличие от Fe гемоглобина может менять валентность, при присоединении или
отдаче электронов.
Цитохром В и С функционируют в комплексе, обладают ферментативной активностью,
называются по субстрату, который окисляет QH - ДГ.
Пятый компонент - цитохром С - подвижный.
Цитохромы а и а3 функционируют как ферментцитохромоксидаза, в своем составе
помимо Fe содержат ионы Си/которые участвуют в передаче электронов на конечный
акцептор Ол.
Функции дыхательной цепи:
утилизация водорода, отщепленного от субстратов, и образование метаболической воды,
разбивают свободную энергию Гиббса, выделяющуюся при переносе электронов и Н по дыхательной цепи к Ол на порции, достаточные для сопряженного синтеза АТФ (указаны J,)
ЦПЭ участвует в создании электрохимического трансмембранного протонного градиента - движущей силы синтеза (АТФ).
Водород от субстратов (например, ЦГК или ОДПВК) (а) при помощи НАД-зависимых и
ФАД-зависимых ДГ (б) вводится соответственно или в начало (НАДН+Н1) или в
середину ЦПЭ (Q). 2 атома Н в виде 2ё и 2Н передаются на НАДН-ДГ. Q
восстанавливается и становится QH .
Пути Н и электронов расходятся, Н^выходят в матрикс и восстанавливают кислород, а
электроны передаются далее по цепи, т.к. система цитохромов переносит только
электроны. Поэтому дыхательная цепь называется ЦПЭ.
Система цитохромов может переносить только 1 электрон, поэтому существует 2 теории:
либо электроны переносятся по очереди, либо существуют 2 параллельные системы
цитохромов. Электроны передаются через всю систему цитохромов и вместе с Н+,
которые высвободились восстанавливают O2 до метаболической воды - расшифровка 1 функции.
Таким образом, главные компоненты дыхательной цепи располагаются во внутренней мембране строго определенным образом - в порядке возрастания окислительно-восстановительного потенциала. Атомы Н (в виде 2ệ и 2Н) перемещаются по цепи от более электроотрицательного компонента к более электроположительному кислороду, (способность отдавать электроны убывает от начала цепи к концу, способность присоединять электроны увеличивается).
Самый сильный восстановитель - НАДН, окислитель – O2. Электроны, поступающие в начало ЦПЭ, обладают | энергией, по мере продвижения по ЦПЭ запас энергии будет уменьшаться. Общая разность окислительно-восстановительных потенциалов между НАДН (начало) и O2 (концом) = 1,14В.
Этому соответствует разность свободной энергии Гиббса (-220кДж), этой энергии хватило бы на синтез четырех молекул АТФ, но синтезируется всего 3, остальное рассеивается в виде теплоты.
При переносе двух атомов Н, от окисленных субстратов, происходит изменение свободной энергии Гиббса на каждом этапе ЦПЭ. В дыхательной цепи есть три участка, в которых наблюдается большое ↓G ( смотрите рисунок рядом с ↓).
Эта энергия используется для сопряженного синтеза АТФ, т.е. дыхательная цепь - это такой механизм, который позволяет высвобождать свободную энергию порциями. Если бы энергия высвобождалась единоразово, то она рассеивалась бы в виде тепла. Места сопряженного синтеза были исследованы при помощи ингибиторов дыхательной цепи (3 жирные J, показывают ингибирование) - расшифровка второй функции. Для объяснения механизма сопряжение существует хемиосмотическая теория Митчелла. Согласно которой при переносе е по дыхательной цепи, свободная энергия, выделяемая в трех участках, направленная на выталкивание Н в межмембранное пространство. На каждую пару электронов, переносимую по цепи высвобождается 3 пары Н. Наружная поверхность внутренней мембраны заряжается положительно, а внутренняя -отрицательно.
Таким образом, возникает электрохимический трансмембранный протонный градиент. Т.к. внутренняя мембрана не проницаема для протонов, следовательно, для их выталкивания необходима свободная энергия.
Создавшийся градиент Н+ заставляет их двигаться в обратном направлении из межмембранного пространства в матрикс. Существует специальный протонный канал, называемый F1 -комплексом, через который H+ возвращается из межмембранного пространства в матрикс.
F1 - комплекс - это белок, находящийся на внутренней поверхности внутренней мембраны, обращенной в матрикс ( смотрите рис.2) и представляет собой протон-зависимую АТФ-синтетазу, которая преобразует энергию обратного потока Н в энергию фосфатных связей АТФ. При прохождении через F1 -комплекс 1 пары Н АТФ -синтетаза активируется и катализирует реакцию образования одной молекулы АТФ из АДФ и Ф (неорганического).
Т.к. при переносе электронов по дыхательной цепи к О2, в межмембранное пространство выталкивается 3 пары Н, то синтезируется 3 молекулы АТФ.
Таким образом, в ЦПЭ существует 3 участка сопряженного синтеза. 1 участок по рис.1 на уровне НАДН- дегидрогиназы, 2 - на уровне цитохромов В и С1, 3 - на уровне цитохромов а и аЗ .
Рис.2
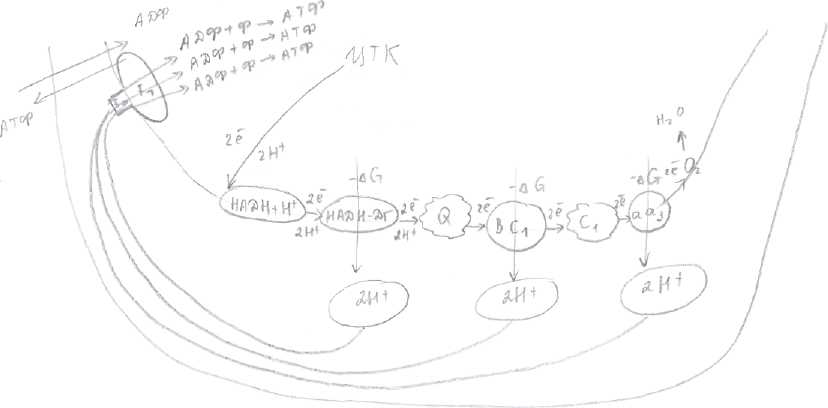
Количество АТФ, которое образуется при переносе пары электронов в дыхательной
цепи, называется дыхательным коэффициентом Р/О. Если электроны переносятся с
начала цепи, образуется 3 молекулы АТФ, в результате сопряженного процесса, который
называется окислительным фосфорилированием (окисление ЦПЭ — фосфорилирование в
F1 -комплексе). Если электроны вводятся в цепь на уровне убихинона при помощи
ФАД-зависимых ДГ. (см. рис.2), то дыхательная цепь укорочена. Электроны проходят
всего 2 сопряженных участка, следовательно, Р/О будет равен 2.
Т.к. только в двух местах происходит выталкивание пары Н и они только дважды
активируют АТФ-синтетазу—» синтезируется всего 2 молекулы АТФ.
Разобщители окислительного фосфорилирования разобщают перенос электронов по цепи
и фосфорилирования в F1-комплексе (ионофоры и протонофоры).
Например, 2,4 -динитрофенол — это липофильное вещество, которое может свободно
проникать через мембрану митохондрий и переносить Hf из межмембранного
пространства в матрикс. То есть не возникает протонного градиента —» не синтезируется
АТФ, а вся энергия, которая выделяется при переносе электронов по ЦПЭ рассеивается в
виде тепла, так называемый пирогенный эффект, потому что повышается температура
тела.
Пирогенным эффектом обладают гормоны щитовидной железы. Валиномицин (ионофор)
действует также, но имеет сродство к К+
