
- •Содержание
- •Введение
- •Возникновение и развитие металлургии
- •История развития металлургии в России. Возникновение и развитие высшего металлургического образования
- •Выдающиеся российские ученые металлурги
- •Павел Петрович Аносов (1799 – 1851 гг.)
- •Павел Матвеевич Обухов
- •Дмитрий Константинович Чернов
- •Владимир Ефимович Грум-Гржимайло
- •Михаил Александрович Павлов
- •Евгений Оскарович Патон (1870 – 1953 гг.)
- •Борис Евгеньевич Патон
- •Николай Тимофеевич Гудцов
- •Иван Павлович Бардин
- •Сергейй Иванович Губкин
- •История развития металлургии и металлургического образования на Урале. Подготовка персонала для металлургических предприятий
- •2.1. Основатель Уральской научно-педагогической школы по обработке металлов давлением
- •Головин Аким Филиппович
- •Развитие теории обработки металлов давлением и работа на заводах
- •Выдрин в.Н. Доктор технических наук, Тарновский и.Я. Доктор технических наук, профессор, основатель кафедры профессор, заведующий кафедрой
- •Создание новых методов расчета формоизменения и силы деформации
- •Красовский н.Н. И Поздеев а.А. Выпускники 1949 г., отличные студенты и спортсмены, стали членами Академии наук ссср
- •Кафедра "Обработка металлов давлением"
- •Основы материаловедения
- •3.1.1. Классификация металлов
- •Средний химический состав земной коры по а.П. Виноградову (мощность 16 км без океана и атмосферы), % мас.
- •3.1.2. Потребительские свойства некоторых металлов и сплавов. Область применения
- •Примерные объемы мирового годового производства некоторых металлов
- •Разбивка нанопорошков по типам
- •3.2. Металлофонд России
- •Кристаллическое строение металлов. Аллотропические или полиморфные превращения
- •От расстояния между ними
- •Элементарной ячейки.
- •Аллотропические формы некоторых металлов
- •3.4. Структура реальных кристаллов
- •3.5. Кристаллизация металлов
- •3.6.1. Диаграмма состояния сплавов, образующих механическую смесь компонентов
- •Механическую смесь компонентов:
- •(Кристаллизации) эвтектики
- •3.6.2. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии
- •3.6.3. Диаграмма состояния сплавов, образующих ограниченные твердые растворы
- •3.6.4. Диаграмма состояния сплавов, образующих химические соединения
- •Системы Mg-Pb
- •Системы Cu-Zn
- •Свойства и деформация металлов и сплавов
- •Физико-химические и физико-механические свойства металлов и сплавов
- •В таблице Менделеева
- •Физические и механические свойства важнейших металлов
- •3.7.2. Механические свойства металлов и сплавов
- •Деформация металлов и сплавов
- •Сдвига в положение а'в' (б); в - выход дислокации на поверхность кристалла
- •Возврат и рекристаллизация
- •Основы металлургии
- •4.1. Принципиальные основы производства металлов
- •4.2. Руды, подготовка руд к металлургическому переделу
- •4.2.1. Способы добычи руд
- •4.2.2. Цель подготовки руд к металлургическому переделу
- •4.2.3. Дробление и измельчение руд
- •4.2.4. Грохочение и классификация
- •А) в открытом цикле; б) в закрытом
- •4.2.5. Обогащение руд
- •Сепаратора:
- •Для очистки барабана;
- •4.2.6. Обжиг руд
- •Температуры плавления и кипения хлоридов металлов
- •4.2.7. Усреднение
- •4.2.8. Окускование
- •Рекуперации и охлаждения
- •Основы технологии производства важнейших металлов и сплавов
- •5.1. Производство железа – чугунов и сталей
- •5.1.1. Рудная база черной металлургии
- •5.1.2. I стадия - подготовка железных руд к плавке
- •Важнейшие железорудные месторождения России
- •Химические составы железной руды Оленегорского месторождения и полученного из нее концентрата
- •Месторождения
- •5.1.3. II стадия - доменное производство
- •5.1.3.1. Химические процессы в доменной печи
- •5.1.3.2. Управление доменным процессом
- •Калькуляция себестоимости передельного чугуна (в ценах 1985 г.)
- •Калькуляция себестоимости передельного чугуна (в ценах 1985 г.)
- •5.1.3.3. Мероприятия по повышению количества воздуха, вдуваемого в печь
- •5.1.3.4. Устройство и оборудование доменной печи
- •Ленточными конвейерами (галереи обозначены стрелками)
- •В доменную печь:
- •5 .1.3.5. Устройства для подачи и нагрева дутья
- •И «на дутье» (б):
- •5.1.3.6. Устройства для обслуживания горна и уборки чугуна и шлака
- •Огнеупорной массы; 6 - механизм поворота пушки к летке; 7 - защелка; 8 - люк для загрузки огнеупорной массы
- •Доменной печи:
- •5.1.3.7. Использование продуктов доменной плавки
- •5.1.4. III стадия - сталеплавильное производство
- •5.1.4.1. Принципиальные основы сталеплавильного производства
- •Химические составы чугуна и стали
- •5.1.4.2. Шлаковый режим сталеплавильного процесса
- •5.1.4.3. Мартеновское производство стали
- •5.1.4.4. Кислородно-конвертерный способ производства стали
- •Элементов в металле по ходу продувки в кислородном конвертере
- •Конвертерных газов:
- •5.1.4.5. Выплавка стали в конвертерах дуплекс-процессом
- •Транспортного назначения
- •5.1.4.6. Производство стали в электрических печах
- •5.1.4.6. Разливка стали
- •5.1.4.7. Классификация сталей
- •5.1.4.8. Бездоменные способы получения железа
- •Составы восстановительного и колошникового газов шахтиой восстановительной печи, %
- •5.1.4.9. Получение особо чистого железа
- •5.1.4.10. Производство ферросплавов
- •Удельные расходы шихтовых материалов и электроэнергии при выплавке ферросплавов
- •5.1.5. IV стадия - методы повышения качества стали
- •5.1.6. Современный электросталеплавильный цех по производству трубной непрерывнолитой заготовки
- •Технические характеристики мнлз №1
- •5.2. Производство алюминия
- •5.2.1. Рудная база
- •Из высококремиземистых бокситов
- •5.2.2. II стадия - получение а12о3
- •Выщелачивания бокситов:
- •Алюминатного раствора:
- •Перемешиванием; 2- гидроциклон;
- •5.2.3. III стадия - получение металлического алюминия
- •Р ис. 5.50. Схема электролиза для получения алюминия:
- •5.2.4. IV стадия - получение чистого алюминия
- •5.3. Производство меди
- •5.3.1. Рудная база
- •Химический состав медных руд, %
- •5.3.2. I стадия передела - механическое обогащение руд
- •5.3.3. II стадия - выплавка штейна (химическое обогащение)
- •Пирометаллургическим способом
- •Р ис. 5.56. Схема распределения химических процессов по высоте шахтной печи при полупиритной плавке
- •Тепловой баланс полупиритной плавки
- •Р ис. 5.58. Схема печи для взвешенной плавки:
- •Р ис. 5.59. Схема печи Ванюкова:
- •5.3.4. III стадия - получение черновой меди
- •Р ис. 5.60. Схема горизонтального конвертера:
- •5.3.5. IV стадия - получение чистой меди
- •Распределение элементов медных анодов в процессе электролиза, %
- •5.4. Производство титана
- •5.4.1. I стадия - механическое обогащение ильменитовых руд
- •5.4.2. II стадия - химическое обогащение
- •5.4.3. Ill стадия - получение чистых TiCl4 и то2
- •Непрерывного действия:
- •И кипения (верхняя горизонталь) некоторых хлоридов; штриховкой показан температурный диапазон, в котором производится ректификация TiCl4
- •От примесей:
- •Хлоридов; 7 - бак для сбора высококипящих хлоридов; 8 - запорные и регулирующие краны;
- •5.4.4. Получение конечной продукции
- •Восстановлением TiCl4
- •Для алюмотермического производства ферротитаиа:
- •Производство изделий из металлов и сплавов металлургическими методами
- •6.1. Обработка металлов давлением
- •Классификация процессов обработки металлов давлением. Методы омд
- •Классификация процессов листовой штамповки
- •6.1.1.1. Прокатка
- •6.1.1.2. Ковка
- •Боёк; 3 - обрабатываемое изделие; 4 и 5 - верхний и нижний штампы;
- •6.1.1.3. Штамповка
- •6.1.1.4. Прессование
- •6.1.1.5. Волочение
- •6.1.2. Элементы теории обработки металлов давлением
- •Оценка степени деформации металлического тела
- •Напряженное состояние
- •Принцип минимума энергии деформации (наименьшего сопротивления)
- •Элементы теории продольной прокатки
- •Очаг деформации, угол захвата
- •Опережение и отставание
- •Уширение при прокатке
- •Усилие и давление при прокатке
- •Механическое оборудование прокатных цехов
- •Главная линия прокатного стана и ее элементы
- •Вспомогательное оборудование
- •Классификация прокатных станов
- •Для холодной прокатки жести:
- •И рельсобалочных станах:
- •И трамвайные рельсы; 8 - двутавровая балка; 9 - швеллер; 10 - z-образный профиль
- •Технология прокатного производства
- •Нагрев металла перед омд
- •Калибровка прокатных валков
- •Для упрощения рисунка из девяти калибров приведено только четыре
- •Производство заготовок
- •Стана 900/700/500
- •Производство рельсов и балок
- •Производство листового проката
- •Стана холодной прокатки
- •Обозначения те же, что и на рис. 6.23
- •Производство труб
- •6.2. Литейное производство
- •Принципиальная схема изготовления отливок
- •6.2.2. Формовочные материалы и смеси
- •6.2.2.1. Требования, предъявляемые к формовочным и стержневым смесям
- •Свойства компонентов формовочных и стержневых смесей
- •6.2.3. Изготовление форм
- •6.2.4. Заливка форм металлом
- •Основные элементы литниковых систем
- •Типы литниковых систем
- •6.2.5. Литейные сплавы
- •6.2.6. Дефекты отливок
- •6.2.7. Специальные методы литья
- •6.2.7.1. Литье по выплавляемым моделям
- •С выплавляемыми моделями
- •Литье в металлические формы
- •Литье под давлением
- •Литье под регулируемым давлением
- •Центробежное литье
Кристаллическое строение металлов. Аллотропические или полиморфные превращения
Как известно, атомы всех элементов состоят из положительно заряженного ядра (с определенным числом протонов и нейтронов) и с огромной скоростью движущихся вокруг него по круговым или эллиптическим орбитам отрицательно заряженных электронов. Число электронов в атоме равно положительному заряду ядра.
Электроны каждого атома распределены по электронным слоям (с различными радиусами). В каждом слое может находиться не более строго определенного числа электронов: в первом - 2х12= 2; во втором -2х22 = 8; в третьем - 2х32 = 18. Каждый слой электронов разделен на подгруппы в зависимости от энергетического уровня электронов. Особенностью атомов металлов является то, что они имеют небольшое количество электронов на последней электронной оболочке (эти электроны называют ещё валентными). Такие электроны слабо связаны с ядром и могут легко отрываться от «своих» атомов, которые при этом превращаются в положительно заряженные ионы. Свободные электроны в твердом металле называют «электронным газом». Подобные электроны коллективно «обслуживают» всю упорядоченно расположенную систему ионов; при этом общая система электронов и ионов остается электрически нейтральной. Следовательно, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых «газом» из свободных коллективизированных электронов. Такое взаимодействие между ионным каркасом и электронным газом называют металлической связью.
В твердых металлах между соседними атомами (ионами) существует сложное взаимодействие, при котором одновременно действуют силы притяжения и отталкивания. В общем виде результаты такого взаимодействия можно представить кривой на рис. 3.1.
Находящиеся в парообразном состоянии (при высоких температурах) и обладающие большой кинетической энергией атомы металлов участвуют в броуновском движении. Никакого взаимодействия между атомами, находящимися на большом удалении друг от друга, не существует (кроме отталкивания в моменты случайных столкновений). При снижении температуры интенсивность движения атомов уменьшается, они приближаются друг к другу - между ними возникает слабое притяжение.
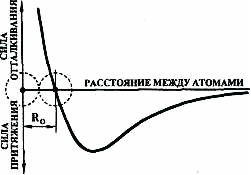
Рис. 3.1. Схема взаимодействия двух атомов в зависимости
От расстояния между ними
При дальнейшем падении температуры атомы сближаются еще больше - вещество переходит в жидкое состояние, силы взаимного притяжения между атомами становятся еще больше. Наконец, при уменьшении температуры ниже определенного уровня энергия броуновского движения становится незначительной, и атомы под действием сил притяжения сближаются до расстояния R0, когда «соприкасаются» внешние электронные оболочки их атомов и когда силы притяжения и отталкивания уравновешиваются - вещество переходит в твердое состояние. Дальнейшее сближение или удаление атомов друг от друга требует затраты энергии.
Таким образом, в твердом металле атомы (ионы) располагаются равномерно, на строго определенном расстоянии друг от друга, образуя трехмерную кристаллическую решетку. Кристаллическую решетку можно представить как структуру, состоящую их трёх групп воображаемых параллельных плоскостей, определенным образом ориентированных в пространстве; для кубической решетки - в трех взаимно перпендикулярных направлениях. В точках пересечения этих плоскостей - узлах - расположены атомы металла - рис. 3.2.

Рис. 3.2. Схема кристаллической решетки:
а, в, с - линейные параметры элементарной ячейки; α, β, γ - угловые параметры
